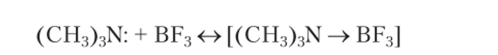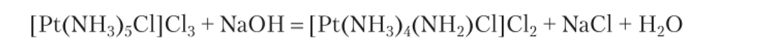По мысли Лыоиса[1], взаимодействие между кислотой и основанием обусловлено переносом электронной пары. При таком представлении в качестве основания принимается химическое соединение — донор неподеленной электронной пары (например, молекула NH3), а в качестве кислоты — химическое соединение, способное к акцептированию этой пары, т. е. такое, в котором имеется атом с вакантными орбиталями (как, например, у атома бора в BF3). Критерием реализации кислотно-основного процесса, таким образом, служит образование координационной ковалентной связи, например: 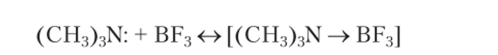
Кислотно-основное взаимодействие с образованием донорноакцепторной связи между ионом металла и лигандом можно рассматривать и как процесс комплексообразования. Важно при этом, что кислотная и основная функции слабо зависят от механизма переноса иона и от растворителя.
Как отмечал Ю. Ы. Кукушкин, одной из предпосылок к возникновению теории Льюиса была, в частности, работа Л. А. Чугаева 1915 г., в которой показано, что при действии щелочи на комплекс |Pt (NH3)5Cl]Cl3 выделяется осадок состава [Pt (NH3)4(NH2)Cl]Cl2 по схеме.
т.е. налицо реакция, похожая на реакцию нейтрализации, а аммиак проявляет ярко выраженное свойство кислоты. Этот факт нашел объяснение по Льюису, а проявление кислотных свойств координированной молекулой аммиака объясняется связыванием в комплексе неподеленной электронной пары па атоме азота, что устраняет и основные свойства молекулы аммиака.
Говоря о кислотно-основном или донорно-акцепторном взаимодействии, нельзя не упомянуть про растворители (см. главу 14). Большинство широко известных растворителей обладает донорными свойствами, поэтому в реакциях комплексообразования в растворах происходит конкуренция между лигандами и молекулами растворителя. Такие реакции в растворах можно рассматривать как реакции замещения молекул растворителя, координированных ионом или молекулой, конкурирующими нейтральными либо заряженными лигандами L или X. Реализация замещения или обмена лигандов зависит от относительной силы двух доноров (молекул растворителя D и лигандов L или X) по отношению к рассматриваемому иону, А (или молекуле).
Таким образом, реакции комплексообразования, включая координацию растворителя или сольватацию, можно рассматривать как донорно-акцепторные реакции (рис. 11.1), в которых решающее значение имеет донорная сила растворителя.
- [1] Lewis G. N //}. Franklin Inst. 1938. V. 226. Р. 293.