Металлическая связь.
Основы химии

Водородная связь. Водородная связь осуществляется между поляризованным водородом одной молекулы и каким-то электроотрицательным атомом или группой атомов другой или одной и той же молекулы (например, кислородом, гидроксогруппой, фтором, азотом, карбоксильной группой, реже хлором, серой и др.): Донорно-акцепторное взаимодействие. Если одна из двух молекул имеет атом со свободными орбиталями… Читать ещё >
Металлическая связь. Основы химии (реферат, курсовая, диплом, контрольная)
Атомы металлов на внешнем энергетическом уровне содержат малое число электронов и обладают большим радиусом. Поэтому они легко отдают наружные электроны и превращаются в положительно заряженные ионы. Оторвавшись от атомов, электроны перемещаются между положительно заряженными ионами металлов, находящихся в узлах кристаллической решетки. Таким образом, металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронным газом).
Металлическая связь — это связь между положительно заряженными ионами металлов и делокализованными электронами, принадлежащими всему объему металлического кристалла.
В чистом виде металлическая связь проявляется только для металлов I, IIгрупп, т.к. количество валентных электронов и электронов проводимости у них одно и тоже.
Для металлов III-VIII групп связь в кристаллических решетках будет смешанной (ковалентно — металлической или ковалентно — ионно — металлической).
Основные виды межмолекулярного взаимодействия
Силы межмолекулярного взаимодействия. Между молекулами может осуществляться как электростатическое так и донорно — акцепторное взаимодействие.
Силы межмолекулярного взаимодействия, возникающие без передачи атомами электронов, носят название ван-дер-ваальсовых сил.
Изучение электростатического межмолекулярного взаимодействия имеет большое значение для исследования свойств и структуры газов, жидкостей и твердых веществ. Ван-дер-ваальсовы силы обусловливают притяжение молекул и агрегацию вещества, превращение газообразного вещества в жидкое и далее в твердое состояние.
По сравнению с ковалентной связью ван-дер-ваальсово взаимодействие очень слабо.
Ван-дер-ваальсово взаимодействие молекул рассматривается, как результат трёх эффектов: ориентационного, индукционного и дисперсионного.
Наиболее универсально (т.е. проявляется в любых случаях) дисперсионное, так как оно обусловлено взаимодействием молекул друг с другом за счет их мгновенных микродиполей (рис. 15а). При сближении молекул ориентация микродиполей перестает быть независимой, и их появление и исчезновение в разных молекулах происходит в такт друг другу. Синхронное появление и исчезновение микродиполей разных молекул сопровождается их притяжением. При отсутствии синхронности в появлении и исчезновении микродиполей происходит отталкивание.
Ориентационное (диполь-дипольное) взаимодействие проявляется между полярными молекулами (рис. 15б), В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие.
Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей (рис. 15в). Допустим, что встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная молекула деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной молекулы.
Индукционное взаимодействие тем больше, чем больше момент диполя и поляризуемость молекулы.
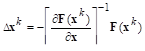
Ван-дер-ваальсовы взаимодействия молекул: а — дисперсионное; б — ориентационное (диполь — дипольное); в — индукционное.
Донорно-акцепторное взаимодействие. Если одна из двух молекул имеет атом со свободными орбиталями, а другая — атом с парой неподелённых электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH3+BF3=NH3BF3.
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора — вакантная орбиталь.
При взаимодействии по донорно — акцепторному механизму атом азота отдает на связь пару электронов, а атом бора — вакантную орбиталь, в результате чего возникает ковалентная связь:

Аналогичным образом образуется комплексное соединение при взаимодействии сульфата меди и аммиака:
CuSO4+ 4NH3= [Cu (NH3)4]SO4.
Водородная связь. Водородная связь осуществляется между поляризованным водородом одной молекулы и каким-то электроотрицательным атомом или группой атомов другой или одной и той же молекулы (например, кислородом, гидроксогруппой, фтором, азотом, карбоксильной группой, реже хлором, серой и др.):
С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В). Последняя связь получила название водородной. Ее обычно изображают точками или пунктиром.
Водородная связь — это промежуточный случай между ван-дер-ваальсовым взаимодействием и ковалентной связью. Она по прочности превосходит ван-дер-ваальсово взаимодействие, и ее энергия составляет 8 — 40 кДж/моль. Однако она обычно на порядок слабее ковалентной связи.
Например, в твердом, жидком и даже в газовом состоянии молекулы фторида водорода НFассоциированы в зигзагообразные цепочки вида, что обусловлено водородной связью.
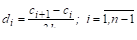
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность молекулы воды обусловливает строение воды и льда.