Промышленные процессы с использованием иммобилизованных ферментов и клеток

Анаэробные способы очистки применяются, как правило, для обработки высококонцентрированных стоков и осадков, содержащих большое количество органических веществ. Процесс брожения осуществляется в метантенках. Анаэробное превращение органических веществ происходит под действием бактериальной микрофлоры (в ее состав входит до тысячи микроорганизмов) через четыре последовательных этапа: фаза… Читать ещё >
Промышленные процессы с использованием иммобилизованных ферментов и клеток (реферат, курсовая, диплом, контрольная)
Сочетание уникальных каталитических свойств энзимов с преимуществами иммобилизованных ферментов как гетерогенных катализаторов позволило создать новые промышленные технологические процессы. Следует отметить, что все они относятся к производству пищевых продуктов и лекарственных препаратов.
В настоящее время в мире разработаны следующие крупномасштабные производства с использованием иммобилизованных ферментов и клеток:
- 1. Получение глюкозофруктозных сиропов.
- 2. Получение оптически активных L-аминокислот из их рацемических смесей.
- 3. Синтез L-аспарагиновой кислоты из фумарата аммония.
- 4. Синтез L-аланина из L-аспарагиновой кислоты.
- 5. Синтез L-яблочной кислоты из фумаровой кислоты.
- 6. Получение безлактозного молока.
- 7. Получение сахаров из молочной сыворотки.
- 8. Получение 6-аминопенициллановой кислоты.
В качестве примера рассмотрим некоторые из них.
Получение глюкозофруктозных сиропов.
Фруктоза (фрукто-вый, плодовый или медовый сахар) — важнейший в физиологическом и технологическом отношении природный моносахарид. Превращаясь в печени и кишечнике млекопитающих в глюкозу, фруктоза включается в пластический и энергетический обмен клетки. Она в 2,5 раза слаще глюкозы и в 1,7 раза слаще тростникового сахара (сахароза), благодаря чему фруктоза — менее калорийный пищевой продукт по сравнению с последними. В отличие от глюкозы обмен фруктозы не контролируется инсулином, поэтому фруктозный сахар может потребляться больными диабетом. Фруктоза практически не вызывает кариеса зубов. В смеси с глюкозой фруктоза не кристаллизуется, поэтому широко используется для производства кондитерских изделий.
Объем производства сахарозы за последние 100 лет возрос в 15 раз и составляет, по разным оценкам, 30 — 40 кг в год на человека. Однако, несмотря на явные преимущества использования фруктозы, первая промышленная установка для превращения глюкозы во фруктозу с помощью иммобилизованной глюкоизомеразы была запущена лишь в 1973 г. (компания «Клинтон Корн», США). Исходным сырьем для этого процесса служит глюкоза, которую получают при гидролизе кукурузного или картофельного крахмала в присутствии минеральных кислот. Для конструирования промышленного биокатализатора глюкозоизомеразу сорбируют на пористых неорганических носителях или ионообменных смолах. Во многих случаях используют иммобилизованные клетки разного происхождения (Aspergillus niger, A. oryzae, Streptomyces phaeochro-mogenes, S. olivaceus, S. venezuelae). Коммерческие препараты иммобилизованной глюкоизомеразы имеют вид гранул, шариков, волокон или аморфной массы. Наиболее эффективными биореакторами для получения фруктозы признаны аппараты колонного типа высотой около 5 м, в которых по сравнению с реакторами перемешивания расход фермента минимален. Производительность такого реактора варьирует от 600 до 9000 кг глюкозофруктозного сиропа на 1 кг иммобилизованного фермента в зависимости от чистоты исходного сырья, а время полуинактивации катализатора — 20 — 50 суток. Возникающий в результате каталитического процесса глюкозофруктозный сироп содержит 42 —45% фруктозы, около 51% глюкозы, небольшое количество олигосахаридов и по сладости соответствует инвертному сахару, получаемому при гидролизе сахарозы. Эти смеси постепенно вытесняют инвертированный сахар в промышленности и медицине. Глюкозофруктозную смесь широко применяют для производства тонизирующих напитков, консервированных фруктов, кондитерских изделий, хлеба, мороженого и пр. Экономические расчеты показали, что производство глюкозофруктозных сиропов с использованием иммобилизованной глюкоизомеразы в 1,5 раза выгоднее получения сахарозы из сахарной свеклы по традиционной технологии. Благодаря этому обстоятельству производство глюкозофруктозных сиропов в мире постоянно растет. Так, в 1980 г. 10% потребляемого населением Японии сахара заменено на глюкозофруктозную смесь. В США эта доля к 2000 г. достигла уже 40%.
Биотрансформация других углеводов.Кроме изомеризации углеводов, важную роль также играют процессы микробиологической окислительной и восстановительной трансформации углеводов. Окислительная трансформация представляет собой окисление полиолов, например, маннита во фруктозу или сорбита в сорбозу. Окислению подвергаются все полиолы (полиспирты), обладающие двумя вторичными гидроксилами в цис-положении, прилежащими к терминальной первичной спиртовой группе, причем окисляется атом углерода, смежный с терминальным. Окисление полиолов получило название кетогенной ферментации.
В промышленном масштабе (при использовании свободных клеток) применяются два процесса окисления полиолов: превращение глицерина в диоксиацетон и превращение D-сорбита в L-сорбозу (одна из стадий синтеза аскорбиновой кислоты).
Диоксиацетон (1.3-дигидрокси-2-пропанон) используется для обработки изделий из целлюлозных волокон для придания им несминаемости, устойчивости к стирке и прочих важных эксплуатационных свойств; сложные эфиры диоксиацетона являются репеллентами; из диоксиацетона и аминокислот синтезируют пищевые и косметические красители; производные диоксиацетона применяют как консерванты, эмульгаторы, пластификаторы, фунгициды; наконец, диоксиацетон широко используют в медицине.
Для промышленного производства диоксиацетона применяется культура Acetobacter suboxydans (НПО «Биолар»). Известны лабораторные методы реализации процесса с помощью иммобилизованных клеток (как А. suboxydans, так и Cluconobacter oxydans), когда иммобилизацию проводят в ПААГ или Са-альгинате.
Окисление D-сорбита в L-сорбозу в промышленных условиях также осуществляют с помощью клеток А. suboxydans или G. suboxydans. L-сорбозу получают с 93%-ным выходом из 15−20%-ных растворов D-сорбита в аэробных условиях.
В лабораторных условиях окисление D-сорбита в L-сорбозу проводят с помощью бактерий, иммобилизованных включением в каррагинановый гель, а также в ПААГ. Осуществлено также окисление иммобилизованными клетками рибита и маннита в соответствующие кетоны. Следует, однако, отметить существенное снижение скорости окислительных процессов при использовании иммобилизованных в гель клеток по сравнению со свободными.
Восстановительная трансформация углеводов заключается в превращении альдоз или кетоз в полиолы. Промышленно значимым является процесс получения ксилита из ксилозы, поскольку ксилит используется в пищевой промышленности и служит заменителем сахара. Для восстановления ксилозы применяют дрожжи C. utilis, которые были иммобилизованы в ПААГ.
Еще один класс реакций, касающийся углеводов и приводящий к получению полезных продуктов, представляют гидролитические реакции. Важную роль играют следующие процессы: гидролиз лактозы, сахарозы, раффинозы и целлобиозы.
Гидролиз лактозы с получением глюкозы и галактозы и гидролиз сахарозы с получением глюкозы и фруктозы являются хорошими примерами биотехнологических процессов, основанных на использовании иммобилизованных биокатализаторов, внедренных в широком масштабе. Лактоза содержится в молоке и молочной сыворотке, причем определенная часть населения не может употреблять молоко именно из-за наличия в нем лактозы, но усваивает (без аллергических эффектов) безлактозное молоко. Гидролиз же лактозы в молочной сыворотке, содержащей около 5% лактозы в жидкой и около 75% в высушенной сыворотке, открывает новые возможности получения сахаристых веществ из нетрадиционного сырья.
Следует отметить, что технология гидролиза лактозы основана на применении иммобилизованных грибных или дрожжевых ферментовлактозидаз, в частности опытные и опытно-промышленные установки существуют в РФ, США, Англии, Франции. Тем не менее, уже созданы и промышленные установки для гидролиза лактозы с помощью иммобилизованных клеток, обладающихгалактозидазной активностью. Одна из них разработана фирмой «NOVO» (Дания). В ней используются клетки Bacillus sp., иммобилизованные за счет поперечной сшивки глутаровым альдегидом. В лабораторных условиях иммобилизацию проводили с помощью адсорбции на полифениленоксиде (Caldariella acidophila), включением в ПААГ, агар, волокна коллагена (Е.alcalescens, E. coli, K. lactis, L. bulgaricus), адсорбцией на полиуретанах, стекле, поликарбонате, полистироле, хитозане (K.lactis).
Инвертный сахар (почти эквивалентную смесь глюкозы и фруктозы) получают из сахарозы с помощью иммобилизованного фермента инвертазы на уровне пилотных установок в РФ и США (компания Snam Progesty). В настоящее время существуют лабораторные разработки по получению биокатализаторов в виде иммобилизованных в ПААГ, или желатине дрожжей (S.cerevisiae), не уступающие по эффективности иммобилизованным ферментам.
Раффиноза, или галактозилсахароза, является наиболее распространенным после сахарозы олигосахаридом, встречающимся в свободном виде в сахарной свекле и других растениях (при ферментативном гидролизе раффинозы образуется галактоза и сахароза). Американская компания Great Western Sugar использовала в технологии иммобилизованный биокатализатор, представляющий собой клетки Vortierella vinacea, сшитые глутаровым альдегидом, обладающиегалактозидазной активностью.
Гидролиз целлобиозы осуществлен иммобилизованными в Са-альгинате микроорганизмами с целлобиазной активностью. Этот биокатализатор может быть использован, например, при реализации процессов ферментативного осахаривания целлюлозы, когда гидролизат содержит целлобиозу.
К микробным продуктам, синтезируемым в больших количествах, относятся полисахариды — декстраны, леваны, маннаны, ксантаны. Декстраны продуцируются при использовании сахарозы в качестве субстрата бактериями Leuconostoc mesenteroidis, обладающими декстрансахарозной (или транс-глюкозидазной) активностью. Молекулы декстранов построены из остатков глюкозы с -1.6-связью, имеют небольшое количество ветвлений, частично гидрализованные декстраны с молекулярной массой 40−80 тыс. служат заменителями плазмы крови, модифицированные декстраны также используются в медицине, поперечно-сшитые декстраны (сефадексы) применяются в качестве молекулярных сит для гельфильтрации.
Ксантаны — это смолы, синтезируемые Xanthamonas campestis при анаэробном росте на глюкозной среде. Ксантаны представляют собой разветвленные полимеры, состоящие из остатков глюкозы, маннозы и глюкуроновой кислоты, некоторые из которых имеют ацетильную (СН3СО) или пируватную (СН3СОСО) группы. Ксантаны добавляют ко многим пищевым продуктам в качестве загустителей и стабилизаторов, используют как красители в текстильной промышленности и полиграфии, в производстве косметических и фармацевтических препаратов, а также при бурении нефтяных скважин в качестве добавки к буровому шламу, поскольку они обладают свойствами ПАВ.
Для получения микробных полисахаридов используют, как правило, свободные клетки, однако имеется опыт применения и иммобилизованных клеток. Иммобилизацию проводят адсорбцией на полиуретане, песке, активированном угле, силохромах. Установлено, в частности, что целесообразно осуществлять синтез полисахаридов в условиях периодической смены среды (азотсодержащей и безазотистой).
Введение
безазотистой среды приводит к дополнительному закреплению клеток на носителе, так что они длительное время сохраняются в адсорбированном состоянии, однако, биосинтетическая активность клеток при этом снижается. При введении в реактор азотсодержащей среды сохраняется жизнеспособность клеток и восстанавливается уровень биосинтеза. В случае биосинтеза полисахаридов иммобилизация путем адсорбции более целесообразна, чем включением в гели, однако при адсорбционной иммобилизации велика вероятность десорбции клеток и смешивания их с целевым продуктом, причем в случае полисахаридов отделение целевого продукта от клеток затруднено. Поэтому метод, основанный на периодической смене сред играет в случае биосинтеза полисахаридов важную роль.
Получение L — аминокислот из их рацемических смесей.
Наряду с микробиологическими способами важное значение имеют химические методы промышленного получения природных аминокислот, в том числе незаменимых. Однако в результате химических реакций, используемых для синтеза аминокислот, содержащих асимметрические атомы углерода, с одинаковой скоростью образуются как D-, так и L-стереоизомеры, т. е. всегда возникает рацемическая смесь. Между тем в живых клетках обмену подвергаются лишь L-аминокислоты. Разделение рацемических смесей на составляющие их оптические изомеры (представляющее труднейшую задачу) явилось первым промышленным процессом с использованием иммобилизованных ферментов. Этот процесс был осуществлен в Японии в 1969 г. (компания «Танабе Сейяку») с помощью аминоацилазы, иммобилизованной на ДЕАЕ-целлюлозе. В качестве исходных соединений в данном превращении используют N-ацилированные производные D-, L-аминокислот, получаемые с помощью химического синтеза. Вследствие своей стереоспецифичности аминоацилаза гидролизует лишь N-ацил-L-стереоизомер, отщепляя от него ацильный радикал, в результате чего растворимость образующейся L-аминокислоты резко возрастает и ее легко можно отделить от своего антипода физико-химическими методами. При нагревании оставшаяся N-ацил-D-аминокислота рацемизируется, т. е. превращается в исходную смесь, которая вновь подвергается воздействию фермента:
Аминоацилаза строго специфична к структуре только ацильной части субстрата, поэтому одна и та же установка с иммобилизованным ферментом используется для получения различных аминокислот, в том числе L-валина, L-метионина, L-фенилаланина и L-триптофана. Время полуинактивации иммобилизованного энзима составляет 65 суток; на японских предприятиях он используется без замены более 8 лет и обеспечивает снижение стоимости производства аминокислот на 40% по сравнению с технологией, где применяются свободные молекулы фермента.
Получение L-аспарагиновой кислоты.
Аспарагиновая кислота широко употребляется в качестве пищевой добавки (подсластитель и подкислитель). Первая в мире промышленная установка для синтеза L-аспарагиновой кислоты из получаемого химическим путем фумарата аммония была запущена в 1973 г. в Японии (фирма «Танабе Сейяку»); в ней использованы иммобилизованные в полиакриламидном геле клетки кишечной палочки Е. coli, содержащие аспартат-аммиаклиазу.
Полиакриламидный гель с иммобилизованными микробными клетками формуют в виде кубиков размером 2 — 3 мм, которыми заполняют колонку объемом 1 м3. Через колонку пропускают раствор фумарата аммония. При подкислении выходящего из колонки элюата до рН 2,8 и охлаждении до 150С из него выкристаллизовывается аспарагиновая кислота в виде препарата 100%-ой чистоты. Процесс получения аспартата полностью автоматизирован и осуществляется в непрерывном режиме. Производительность процесса — 1700 кг чистой аспарагиновой кислоты в сутки на |реактор. Иммобилизованные клетки кишечной палочки сохраняют активность фермента на 80% в течение 120 дней и на 50% в течение 600 дней работы реактора, в то время как свободные клетки — всего на протяжении 10 дней с уровнем активности 25% от исходной. В Армении был налажен промышленный процесс получения аспартата особой степени чистоты с использованием иммобилизованной аспартат-аммиак-лиазы на базе научных разработок химфака МГУ им. М. В. Ломоносова (1974).
Получение L-аланина. В настоящее время основной промышленный способ получения L-аланина — ферментативное декарбоксилирование L-аспарагиновой кислоты:
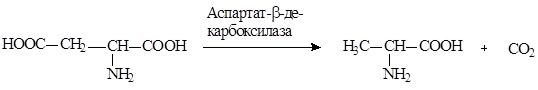
Процесс превращения L-аспартата в L-аланин катализируется аспартат-в-декарбоксилазой ряда микроорганизмов (Pseudomonas dacunhae, Alcaligenes faecalis, Achromobacter pestifier), иммобилизованных в полиакриламидном геле, каррагинане или полиуретане. Установка, разработанная японской фирмой «Танабе Сейяку», производит этим способом 10 тонн аланина в месяц. Усовершенствование процесса связано с использованием в качестве сырья фумарата аммония. В данном случае процесс получения L-аланина становится двустадийным и реализуется в двух последовательно расположенных реакционных колонках. На первом этапе фумарат аммония превращается в L-аспарагиновую кислоту, которая без выделения из реакционной среды на втором этапе претерпевает в-декарбоксилирование с образованием аланина.
С помощью иммобилизованных клеток Serratia marcescens из треонина и глюкозы синтезируют L-изолейцин, а с помощью иммобилизованных клеток Corynebacterium glutamicum — L-глутаминовую кислоту из L-глюкозы; L-триптофан — из индола; L-орнитин — из L-аргинина.
Таким образом расширение производства аминокислот стало возможным благодаря изменению технологии получения промышленных биокатализаторов и снижению затрат при их производстве.
Получение органических кислот.
Органические кислоты и их соли широко используются в пищевой, фармацевтической, текстильной, кожевенной, химической, металлургической и других отраслях промышленности, поэтому их получение является важным направлением крупнотоннажного микробиологического синтеза. Многие кислоты можно производить как химическим, так и микробиологическим путем, причем первый путь более предпочтителен, когда кислоты предполагается использовать для технических нужд, второй путь — для целей пищевой промышленности и медицины.
Источником углерода для микроорганизмов-продуцентов органических кислот являются углеводы, органические кислоты, спирты, алканы. Кислоты часто секретируются клетками, когда рост культуры в силу определенных причин тормозится и переходит в стационарную фазу.
Фактором, вызывающим прекращение роста микробных культур, может быть недостаток минеральных компонентов или витаминов. В случае получения органических кислот рост культур лимитируют источником азота, используя при этом избыточное количество источника углерода (и энергии). Интенсивный синтез кислот в стационарной фазе роста после исчерпывания дефицитного компонента продолжается до тех пор, пока в среде присутствует источник углерода и пока клетки продуцента жизнеспособны. Это в принципе позволяет надеяться на широкое применение иммобилизованных клеточных препаратов для получения органических кислот.
Хотя свойство продуцировать ту или иную органическую кислоту широко распространено среди микроорганизмов, на практике для получения кислот используют специально отобранные или мутантные высокопродуктивные штаммы, не синтезирующие побочных продуктов. В этих случаях выходы органических кислот — по существу, монопродуктов процесса — являются высокими: для молочной кислоты 90, глюконовой — 90−95, уксусной — 90−98, лимонной — 85%.
В настоящее время семь органических кислот производятся в промышленных масштабах, причем лимонную, глюконовую, кетоглюконовую, итаконовую и яблочную кислоты получают только микробиологическим путем, а молочную и уксусную — химическим и микробиологическим методами.
Важнейшей для промышленности органической кислотой является уксусная. Она используется при производстве волокон, фармацевтических препаратов, инсектицидов, в пищевой промышленности, как субстрат для получения аминокислот. Микробиологический способ экономически оправдан в случае получения пищевого уксуса (окисление этанола ацетобактериями). Производство столового уксуса (10%-ная кислота) составляет в мире 8−10 млн. м3 в год. Техническую уксусную кислоту получают химическим синтезом (карбонили-рование метанола).
В зависимости от способа иммобилизации (адсорбция на буковых стружках, TiO2, ZrO2, керамике, хлопке, ионообменных смолах, включение в гели каррагинана, коллагена) продуктивность процесса варьирует в пределах 60 раз, концентрация уксусной кислоты изменяется от 20 до 110 г/л, операционная стабильность иммобилизованного биокатализатора достигает 270 сут. Иммобилизованные на древесной стружке ацетобактерии применяются в промышленности; ряд биокатализаторов, полученных на основе использования других способов иммобилизации, успешно испытан в установках и реакторах пилотного масштаба.
Молочная кислота — первая из органических кислот, которую начали производить путем брожения, в конце XIX века было налажено промышленное производство молочной кислоты при участии молочнокислых бактерий (Lactobacillus debrueckii, L. Leichmanii и L. bulgaricus). Молочную кислоту используют в качестве добавки к пищевым продуктам, сокам, эссенциям и напиткам, как окислитель в пищевой промышленности, в гальваностегии, а также при производстве пластмасс, когда L (+)форму кислоты полимеризуют в полилактам. За 1980 г. в США и Европе было произведено 40 000 т молочной кислоты. Следует отметить, что практически вся производимая в США молочная кислота синтезируется химическим путем, в Европе половину ее получают при сбраживании глюкозы L.delbrueckii. Для интенсификации процессов получения молочной кислоты проводят исследования по применению иммобилизованных молочнокислых бактерий, а также по оптимизации конструкции биореакторов.
Молочнокислые бактерии были иммобилизованы путем включения в различные гели. Для получения молочной кислоты предложено использовать мембранный реактор, колонный реактор с полыми волокнами, колонный реактор с иммобилизованными включением в Са-альгинатный гель бактериями, соединенный с электродиализной ячейкой. Имеющиеся данные позволяют рассчитывать на 50−100-кратное увеличение производительности процесса. Время полужизни иммобилизованного Са-альгенатбиокатализатора на основе L. delbrueckii составляет 100 сут.
Лимонную кислоту получают из мелассы с помощью микроскопических грибов Aspergillus niger. В 1980 г. ее мировое производство составило 175 000 т. Лимонная кислота применяется как ароматизирующее средство и консервант пищевых продуктов, для очистки и шлифовки металлов (хелатирующий агент), в качестве пластификатора лакокрасочных материалов. Эфиры лимонной кислоты применяются при производстве пластмасс. В лабораторных условиях иммобилизация А. niger проводилась в гелях Са-альгената, каррагинана, агара, полиакриламида, путем адсорбции на полипропиленовых пленках и пластинках, включением в поперечно-сшитую глутаровым альдегидом коллагеновую мембрану. Применение иммобилизованных клеток приводит к увеличению скорости образования лимонной кислоты в несколько раз, операционная стабильность иммобилизованного биокатализатора достигает 30 сут.
Лимонную и изолимонную кислоты получают с помощью дрожжей Candida sp. Изолимонная кислота синтезируется и при использовании Penicillium janthinellum (некоторые виды Penicillium синтезируют диастереомер лимонной кислоты — аллозо-Lsизолимонную кислоту). В лабораторных условиях осущест-влена иммобилизация указанных микроорганизмов в Са-альгинат и ПААГ.
Хорошие результаты по технологическому применению иммобилизованных клеток продемонстрированы при получении яблочной кислоты путем микробиологической трансформации фумаровой кислоты. С 1974 г. японская фирма «Танабо Сеяку» приступила к промышленному выпуску яблочной кислоты с использованием включенных в ПААГ мертвых клеток Brevibacterium ammoniagenes. В 1978 г. ПААГ был заменен на каррагинан, что позволило в 2,3 раза увеличить эффективность биокатализатора, а замена В. ammoniagenes на В. flavum еще в 2 раза увеличила его эффективность. В итоге появилась возможность с помощью однократно приготовленной партии иммобилизованного биокатализатора получить до 100 т яблочной кислоты (в настоящий момент производится 180 т). Продолжительность функционирования иммобилизованных в полиакриламидный гель клеток составляет около 60 суток, в геле на основе каррагинана — до 160 суток против 6 суток для свободных клеток. Конверсия фумарата (1М) — до 70%, время одного трансформационного цикла — около 5 ч. Глюконовая кислота и ее лактон являются продуктами окисления глюкозы. Промышленное производство глюконовой кислоты с помощью А. niger было налажено еще в начале 20-х годов. Выход процессов ферментации (свободные клетки) с получением глюконовой кислоты равен 95%, концентрация глюкозы — 150−200 г/л. Глюконовая кислота находит применение как моющее средство, ее соли используются в медицине, а лактон — как подкислитель в пищевой промышленности. Производные глюконовой кислоты — 2-кетоглюконовую и 5-кетоглюконовую кислоты — получают с помощью микроорганизмов Pseudomonas sp., Gluconobacter sp., Acetobacter sp., причем процесс получения 2-кетоглюконовой кислоты на основе свободных клеток нашел промышленное применение. Из 5-кетоглюконовой кислоты в результате химической гидрогенизации образуется L-идоновая кислота, а из нее осуществляется ферментативный синтез 2-кетогулоновой кислоты, являющейся полупродуктом для производства аскорбиновой кислоты.
Иммобилизацию микроорганизмов-продуцентов глюконовой и 2-кетоглюконовой кислот проводят с помощью адсорбционных методов (при использовании в качестве адсорбентов нейлонового волокна, керамики, анионообменника амберлита), а также включением в гели каррагинана, Са-альгината, коллагена, ПААГ.
Наиболее эффективны биокатализаторы, полученные методами включения в упругие гели ПААГ или Са-альгината, при их использовании были реализованы процессы превращения глюкозы, концентрацией до 200 г/л с продуктивностью до 10 г/лч (по глюконовой кислоте), продолжительность функционирования иммобилизованных клеток достигала 200 сут.
Итаконовую кислоту, применяющуюся при производстве пластмасс и красителей, получают с высоким выходом из глюкозы с помощью грибов А. terreus (процесс на основе свободных клеток внедрен в промышленную практику в СССР). На лабораторном уровне проводилась иммобилизация А. terreus в ПААГ, а также путем адсорбции на сетчатых дисках из пористой нержавеющей стали. В последнем случае использовался дисковый реактор: концентрация итаконовой кислоты достигала 20 г/л, реактор функционировал без изменения продуктивности, которая составляла до 1 г/л.ч, до 30 сут.
Получение антибиотиков. Применение биокатализаторов на основе иммобилизованных клеток позволило достичь больших успехов в области получения антибиотиков. Как важна область биотехнологии, связанная с синтезом антибиотиков, наглядно видно из стоимости мирового сбыта их четырех наиболее распространенных групп (пенициллинов, цефалоспоринов, тетрациклинов и эритромицинов (имеется в виду продажа для медицины и ветеринарии): в 1978 г она составляла свыше 4 млрд. дол., в 1980 г. — около 7 млрд. дол., в 1985 г. — около 8 млрд. дол. (объем производства превысил 60 тыс. т в год), в 2000 г. более 20 млрд. дол.
Важность и масштабы производства антибиотиков обусловлены их применением в медицине и ветеринарии как противомикробных и противоопухолевых препаратов. С их помощью контролируется рост растений и ведется борьба с болезнями.
Новые поколения синтетических антибиотиков представляют собой сложные по химическому строению вещества, поэтому методы получения на основе полного химического синтеза не могут конкурировать с методами, в которых используются микроорганизмы. Шесть родов филаментозных грибов синтезируют около тысячи различных антибиотиков, в том числе цефалоспорины и пенициллины. Два рода нефиламентозных бактерий синтезируют 500 видов антибиотиков, а три рода актиномицетов — около 3 000 видов. Число известных антибиотиков увеличивается на несколько сотен каждый год.
Начиная с середины 60-х годов исследователи перешли от поиска новых антибиотиков к модификации структуры уже имеющихся. Особенно это было характерно для пенициллинов и цефалоспоринов, структура которых включаетлактамное кольцо. Химическая модификациялактамного кольца («добавление» к нему какой-либо химической группы) позволяет получить новые виды антибиотиков; их называют полусинтетическими.
Ключевым полупродуктом для получения полусинтетических антибиотиков пенициллинового ряда является 6-аминопенициллановая кислота (6-АПК) Получение 6-АПК в промышленности путем химического гидролиза бензилпенициллина сопряжено с большими трудностями в связи с крайней неустойчивостью лактамного цикла его молекулы. Так, при щелочном гидролизе бензилпенициллина выход 6-АПК составляет всего 1%. Продуктивность этого процесса удалось значительно повысить благодаря применению для гидролиза иммобилизованных бактериальных клеток, содержащих пенициллинацилазу.
Со второй половины 70-х годов XX в. вся 6-АПК, выпускаема в России, и значительная часть 6-АПК, получаемая в Италии производятся с помощью иммобилизованных ферментов. На итальянских фирмах применяют фермент, иммобилизованный путем включения клеток Е. coli в волокна триацетата целлюлозы, на российских предприятиях используют бактериальные клетки, иммобилизованные в полиакриламидном геле. Переход к технологии, применяющей иммобилизованные бактериальные клетки обеспечивает высокий выход 6-АПК, составляющий 80−85%. По данным японских исследователей, время полуинактивации пенициллинацилазы, содержащейся в иммобилизованных в полиакриламидном геле бактериальных клетках, равно 42 суткам при 30 °C или 17 суткам при 400С.
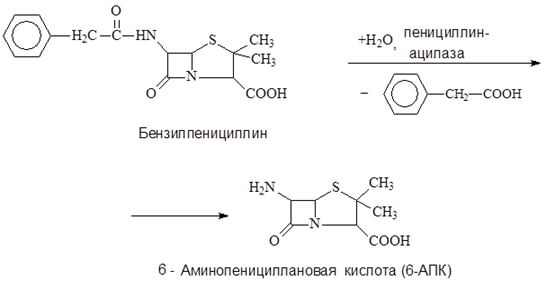
Внедрение в промышленность биокаталитической технологии производства 6-АПК привело к существенному увеличению выпуска полусинтетических пенициллинов и снижению их себестоимости.
Для получения промышленных биокатализаторов с целью трансформации антибиотиков используют иммобилизацию клеток микроорганизмов путем включения в ПААГ, сшитый глутаровым альдегидом желатиновый гель, связывание с глицидилметакрилатом с помощью глутарового альдегида. По существу при трансформации антибиотиков из всего многообразия ферментов клетки используется лишь один из них. Сохранять жизнеспособность клеткам при этом не обязательно, активность катализатора можно увеличивать за счет разрушения клеточных оболочек, служащих диффузионными барьерами на пути субстрата к ферменту.
Тем не менее, простота требований, предъявляемых к системе, когда при иммобилизации нет необходимости сохранять жизнеспособность клеток, является кажущейся. В частности, простое включение в гель клеток E. coli приводит к быстрой инактивации биокатализатора вследствие вымывания фермента в процессе получения геля. В связи с этим был разработан способ включения в ПААГ клеток, предварительно модифицированных в растворе мономеров путем сшивки бифункциональным реагентом.
При включении клеток E. coli в гели альгината по стандартной методике их содержимое конкурирует с полимером за связывание с ионами кальция. Результатом является лизис клеток, нарушение интактности клеточных структур. Стабильность такого биокатализатора иллюстрируют катализаторы фирмы «Спофа», полученные на основе разрушенных клеток E.coli.
Резкого повышения стабильности удается достичь после «фиксирующей» модификации поверхности клеток до их контакта с раствором, содержащим ионы кальция. Эта фиксация резко меняет картину ультраструктуры иммобилизованных клеток, их удается сохранить структурно неизмененными.
Мягкое воздействие на клетки E. coli органическими растворителями, замещающими часть воды в клетке, приводит к изменению проницаемости клеточной стенки, увеличению доступа субстрата к внутриклеточным ферментам и ускорению вывода продукта при одновременном сохранении целостности покровов клетки, и, как следствие, активность биокатализатора и его стабильность существенно возрастают. Воздействие на клетки в процессе выращивания (температурный фактор, химические агенты) также позволяет получить микроорганизмы с повышенной проницаемостью клеточных оболочек. Активность и стабильность иммобилизованного биокатализатора на основе таких клеток возрастает.
Для иммобилизации микроорганизмов, осуществляющих биосинтез антибиотиков, применяют разные методы — включение в ПААГ, гели Са-альгината, каррагинана, агара, коллагена, включение в полые волокна, адсорбция на цеолите, пенополиуретане, поликарбонате, нейлоне, полисульфоне, стали. Биосинтез антибиотиков с помощью иммобилизованных клеток не имеет пока промышленного значения, но исследования в этом направлении интенсивно развиваются.
Трансформация стероидов.
Одна из первых работ, посвященных иммобилизованным клеткам, касалась трансформации стероидов (в ней шла речь о гидроксилировании стероида кортексолона). В настоящее время все основные энзиматические процессы, используемые в стероидной химии, осуществлены с помощью иммобилизованных клеток: 1.2-дегидрирование, 11— и 11—гидрокси-лирование, стереоспецифическое 17—восстановление, 20— и 20—восстановление, дезацетилированние, трансформация стеринов и некоторые другие. Острая необходимость применения для трансформации иммобилизованных клеток обусловлена тем, что стереотрансформирующие ферменты, особенно гидролазы и гидрогеназы, являются весьма лабильными, их выделение и очистка затруднены. Иммобилизованные клетки могут служить в этих случаях «носителем» активных и стабильных полиферментных систем, регенерирующих необходимые им кофакторы.
Промышленный синтез многих лекарственных препаратов на основе стероидов стал возможен с развитием методов микробиологической трансформации. В качестве сырья для промышленных процессов используют природные стерины, выделяемые из растений или различных органов животных.
Трансформацию стероидов осуществляют с помощью различных микроорганизмов, для иммобилизации которых предложен широкий круг методов.
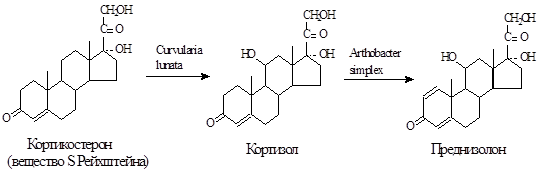
Максимальная стабильность и активность в непрерывном (проточном) реакторе наблюдается у клеток, адсорбированном на керамическом носителе, в условиях периодического реактора — у клеток, включенных в ПААГ. В случае иммобилизации в ПААГ период полуинактивации составил 5 мес. (160 циклов трансформации) при сохранении 95%-ного превращения гидрокортизона в преднизолон. Практически во всех носителях (кроме каррагинана) дегидрогеназная активность сохраняется на уровне активности свободных клеток, причем клетки в иммобилизованном состоянии остаются жизнеспособны.
Трансформация стероидов является одним из примеров реализованных в промышленности процессов, основанных на использовании иммобилизованных клеток.
В настоящее время интенсивно разрабатываются методы использования нерастворимых микрокристаллических стероидных субстратов для иммобилизованных клеток. В этих случаях применяют диспергирование и измельчение субстрата, а также превращение его в водорастворимое состояние (с помощью циклодекстринов). Предложен также новый метод проведения реакций, как для свободных, так и для иммобилизованных клеток и в двухфазных водно-органических системах. Клетки при этом локализованы в водной фазе (внутри гранул носителя) и мало подвержены воздействию органического растворителя, не смешивающегося с водой.
В качестве катализатора реакции дегидрирования стероидов в среде бензола и гептана используются различные виды бактерий Nocargia sp., иммобилизованные в гидрофобном носителе. Бактерии, включенные в гидрофобные гели (уретановые полимеры), обладают большей активностью и стабильностью, чем находящиеся в гидрофильном окружении, что определяется характером распределения субстрата между гелем и окружающим растворителем.
Наконец, следует отметить еще одну возможность утилизации нерастворимого стероидного субстрата, когда клетки и частицы субстрата одновременно включают в гранулы геля (альгината, агара, агарозы). После осуществления цикла трансформаций гранулы геля разрушают, клетки удаляют центрифугированием и рециклизуют, а продукт (преднизолон) экстрагируют из супернатанта органическими растворителями.
Получение ферментов.
С точки зрения применения иммобили-зованных клеток речь может идти в первую очередь о получении внеклеточных ферментов (производство в мире составляет сотни тысяч тонн в год), среди которых промышленно важными являются амилазы, целлюлозы, гемицеллюлазы, пуллуланазы, декстраназа, пектиназы, лактаза, липазы, протеазы. Внутри-клеточные ферменты — глюкозооксидазу, каталазу, аспарагиназу, пенницилин-ацилазу, инвертазу, -галактозидазу, глюкозоизомеразу, выделение которых требует разрушения клеточной стенки микроорганизма-продуцента, получать с помощью иммобилизованных микроорганизмов нецелесообразно.
По существу, из трех классических методов культивирования микро-организмов — на жидких питательных средах (глубинный), на твердых питатель-ных средах (поверхностный) и непрерывное культивирование — два последних можно с определенными оговорками отнести к методам, связанным с применением иммобилизованных клеток, которые закреплены на нерастворимом субстрате (источнике углерода) или отделяются от целевого продукта для последующего использования (рециклизуются).
Применение иммобилизованных клеток для утилизации отходов.
Утилизация разнообразных органических отходов, жидких стоков различных отраслей промышленности, сельского хозяйства, бытовой деятельности человека является чрезвычайно злободневной и острой проблемой, вклад в решение которой биотехнологических (микробиологических) методов трудно переоценить. Большую роль в очистке воды играют микроорганизмы-деструкторы пестицидов, поверхностно-активных веществ, нефтяных загрязнений ксенобиотиков и т. д. Микробиологическая очистка сточных вод способствует также получению альтернативных энергоресурсов и сырья, поскольку продуктом обработки во многих случаях является биогаз (смесь метана и углекислого газа в соотношении 3: 1). Масштабы некоторых из биотехнологических очистных процессов огромны: уже существуют биореакторы емкостью 4000−5000 м3 и выше.
В основе биотехнологии очистки сточных вод лежат два подхода, в одном из которых используют аэробные, а в другом — анаэробные микроорганизмы. В аэробной очистке применяют активный ил (биопленку), представляющий собой скопление разнообразных микроорганизмов, видовой состав которых регулируется конкретными экологическими условиями. В большинстве случаев в развитых странах используют именно аэробную очистку.
Активный ил представляет собой темно-коричневые хлопья размером до сотен микрон, причем он состоит примерно на 70% из живых организмов и около 30% составляют частицы неорганической природы. Живые организмы вместе с твердым носителем, к которому они прикреплены, образуют так называемый зооглей-симбиоз популяций организмов, покрытый общей слизистой оболочкой. Зооглей может формироваться как за счет флокуляции, так и адгезии клеток на поверхности носителя. Микроорганизмы, входящие в состав активного ила, относятся к различным родам: Actinomyces, Actinobacter, Bacillus, Corynebacterium, Desulfiomaculum, Microcjccus, Pseudomonas, Sarcina и другие, которые окисляют спирты, жирные кислоты, парафины, ароматические углеводороды, нафтены, фенолы, осуществляют деградацию нефти (фенолы и формальдегид уже в незначительных концентрациях угнетают развитие микроорганизмов).
Аэробный способ очистки сточных вод основан на использовании системы из двух аппаратов: аэротенк и вторичный отстойник. Аэротенк — это открытое сооружение, через которое пропускается аэрируемая сточная вода и суспензия активного ила, в отстойнике же осуществляется доочистка воды. Применение активного ила по данной технологии относится, по существу, к методам, связанным с использованием иммобилизованных клеток. Однако кроме этого существуют промышленные методы использования активного ила, где иммобилизацию используют в «чистом» виде. Речь идет о биофильтрах, представляющих собой проточные емкости с принудительной или естественной циркуляцией, содержащие консорциум клеток активного ила, прикрепленных к поверхности пористого носителя, которым служит обладающая достаточной механической прочностью керамика, щебень, гравий, песок, керамзит, кольца Рашига, стекловолокно, нити синтетических волокон, металлические полимерные материалы.
Глубина и скорость очистки сточных вод в биофильтрах выше, чем в аэротенках (скорость в 10−15 раз выше и достигается практически полная очистка), однако содержание органики в очищаемых водах не должно превышать 500 мг/л (иначе трудно осуществить полную аэрацию биофильтра), кроме того, сточные воды перед биофильтром должны быть очищены от взвешенных частиц, в противном случае биофильтры быстро забиваются и происходит заиливание. Биофильтры целесообразно применять для очистки локальных стоков.
В последние годы конструкция биофильтров совершенствуется, например, в качестве носителя используют мелкозернистую полимерную или металлическую сетку. Биомассу клеток наращивают в пустотах внутри прокладок из пористого полиэфира, прокладки удерживают внутри реактора с помощью сеток и периодически удаляют из реактора. Густую биомассу отжимают, и пустые прокладки вновь возвращают в реактор. Запуск промышленных аэротенков и биофильтров в эксплуатацию занимает обычно десятки суток, время же их непрерывного функционирования составляет десятки месяцев.
Анаэробные способы очистки применяются, как правило, для обработки высококонцентрированных стоков и осадков, содержащих большое количество органических веществ. Процесс брожения осуществляется в метантенках. Анаэробное превращение органических веществ происходит под действием бактериальной микрофлоры (в ее состав входит до тысячи микроорганизмов) через четыре последовательных этапа: фаза гидролиза (расщепления) биополимерных молекул (белков, липидов, полисахаридов и других) на более простые, например, мономеры, аминокислоты, углеводы и другие; фаза ферментации мономеров до низших кислот и спиртов, аммиака, сероводорода; ацетогенная фаза (образование Н2, СО2, формиата, ацетата); непосредственно метаногенная фаза, которая ведет к конечному продукту расщепления — метану. Кроме метана, продуктом является углекислый газ (их смесь образует биогаз). В результате действия метанногенного консорциума микроорганизмов происходит резкое снижение концентрации органических загрязнений в отходах или сточных водах с одновременным образованием биогаза, который можно в дальнейшем использовать как энергоноситель или углеродный субстрат для синтеза микробной (кормовой) биомассы. Активное использование метаногенеза при сбраживании органических отходов является, по современным представлениям, одним из наиболее перспективных путей совместного решения экологических и энергетических проблем.
Конструкционное оформление метантанков весьма разнообразно, в общем случае это строго герметичный ферментер объемом до нескольких сотен кубометров с перемешиванием и рубашкой для обогрева, работающий в периодическом режиме загрузки отходов или сточных вод с постоянным отбором биогаза и выгрузкой твердого осадка по мере развития процесса. Обеспечение задержки (фиксирования) клеток в объеме метантенка при его работе и выгрузке позволяет значительно интенсифицировать процесс и увеличить выход биогаза.
Эффективность действия метантанков с иммобилизованными клетками в 2.5−3 раза выше, чем со свободными (во столько раз увеличивается выход биогаза с единицы объема метантенка), недостатком процессов с иммобилизованными клетками является то, что они приспособлены для переработки растворимой органики. С этой точки зрения метантенки с иммобилизованной биомассой чрезвычайно удобны для обработки сточных вод предприятий пищевой промышленности, например молокоперерабатывающих, спиртовых заводов, целлюлознобумажных производств и т. д. (их стоки не содержат значительного количества взвесей).
Важную роль в процессах очистки сточных вод играет денитрификация, осуществляемая, например бактериями Pseudomonas sp. Сущность денитрификации отражает схема:
NO3- + источник углерода N2 + CO2 + биомасса Отдельной и важной задачей представляются процессы биодеградации сложных смесей углеводородов и их производных в средах, загрязненных нефтью. Сточные воды нефтяной промышленности обычно очищают биологическим способом или с помощью коагулянтов. Самые значительные утечки нефти происходят в море. Очистку морской поверхности от нефти проводят путем ее биодеградации природным симбиозом бактерий, способных расти на компонентах нефти и окислять их (конечными продуктами окисления являются СО2 и Н2О). Эти микроорганизмы действуют, по существу, в иммобилизованном состоянии на поверхности капель нефтепродуктов, причем, чем больше степень дисперсности нефти, тем быстрее осуществляется биодеградация. Наибольший эффект наблюдается, когда нефть эмульгирована в воде.
К числу острых экологических проблем относится проблема удаления из воды металлов (кадмия, свинца, цинка, урана, плутония), трития. Биотехнологический принцип решения этой проблемы состоит в применении иммобилизованных клеток микроорганизмов (бактерий) и микроводорослей, аккумулирующих металлы. Механизм процесса состоит в основном в комплексообразовании катионов металлов с функциональными группами клеточной стенки (натрием, фосфатными), в ион-ионном взаимодействии с заряженными группами, а также в адгезии частиц оксидов металлов (например, оксида урана) на поверхности клеток в результате электростатического взаимодействия.
Иммобилизацию клеток проводят адсорбцией на шариках из поливинилхлорида, полипропилена, цилиндрических частицах из стекла; включением в гели каррагинана, альгината, ПААГ.
Промышленные установки по извлечению металлов из сточных вод действуют в США и Венгрии. Экономический эффект их использования очень значителен: применение 10 г клеток (сырая биомасса), иммобилизованных в альгинатный или каррагинановый гели при очистке сточных вод от трития, эквивалентно действию 1 г платинового катализатора.
Некоторые микроорганизмы (мицелиальные грибы и бактерии, выделенные из золоторудных месторождений, а также дрожжи) способны к аккумуляции золота, которое в техногенных условиях встречается в элементарном состоянии, а также в виде ионов — Au+ и Au3+. Адсорбируемое золото в некоторых случаях связывается с маннаном клеточной стенки.
Для практической реализации процессов удаления металлов из сточных вод (аккумулирования с целью концентрирования или выделения, например, урана из морской воды, золота) необходимо пропускать большие массы воды через колонные аппараты с иммобилизованными клетками, периодически меняя колонки или их содержимое; отделять клетки от носителя; выделять из них, если необходимо, металл т.д. Эта технология существенно упрощается, если использовать методы обратимой электроиммобилизации клеток.
Следует отметить, что с точки зрения технической микробиологии и биотехнологии биологическая очистка воды (в том числе с помощью иммобилизованных клеток микроорганизмов) представляется необыкновенным процессом. Его необычность состоит в том, что обработке подвергается огромное количество воды. В развитых странах в сутки биологически очищается больше воды, чем вырабатывается в год таких крупнотоннажных продуктов, как сталь, молоко, пиво, сахар. В РФ биологически очищается сточных вод в год больше, чем добывается угля и нефти, производится чугуна, стали, цемента, зерна, вместе взятых, в течение пятилетки.
Очистка воды является тем чрезвычайно крупномасштабным процессом, где необходимость и возможность применения иммобилизованных клеток полностью доказаны, причем реально может быть использован наиболее доступный тип иммобилизации — адсорбционный.
Биогеотехнология.
Приложение биотехнологии к добыче, обога-щению и переработке руд и угля, отделению и концентрированию металлов, экстракции остаточных порций нефти из иссякающих месторождений относится к области биогеотехнологии.
Одним из направлений биогеотехнологии является получение металлов из бедных руд и производственных отходов. Традиционные способы извлечения металлов в таких случаях непригодны и не обеспечивают комплексное и рациональное использование руд и охрану окружающей среды.
В основе биотехнологии извлечения металлов из руд, концентратов, горных пород лежат химические процессы, осуществляемые микроорганизмами или их метаболитами: окисление сульфитных минералов, серы, Fe2+, разложение силикатов. В большинстве случаев клетки микроорганизмов используют в иммобилизованном состоянии — в виде биопленки на поверхности частиц руды, горной породы или минералов.
Для выщелачивания металлов из сульфидных и смешанных руд и концентратов, из отходов пирометаллургического производства и для удаления серы из угля используют Thiobacillus ferroxidans, Leptospirillum ferroxidans в ассоциации с Т. thiooxidans, T.organoparus. Микроорганизмы (грибы, бактерии, дрожжи) и их метаболиты используют для извлечения химических элементов из силикатных и карбонатных руд, для выщелачивания золота.
К процессам, непосредственно катализируемым бактериями, относятся окисление железа:
4FeSO4 + O2 + 2H2SO4 2Fe2(SO4)3 + 2H2O.
и окисление серы:
S8 + 12O2 + 8H2O 8H2SO4.
Ряд минералов окисляется некоторыми выщелачивающими микроорганизмами, например пирит:
4FeS2 + 15O2 + 2H2O 2Fe2(SO4)3 + 2H2SO4.
и сфалерит:
ZnS + 2O2 ZnSO4.
Ион трехвалентного железа служит сильным окисляющим агентом, переводящим в раствор многие минералы, например халькоцит:
CuS + 2Fe2(SO4)3 2CuSO4 + 4FeSO4 + S.
и уранит:
UO2 + Fe2(SO4)3 UO2 SO4 + 2FeSO4.
Выщелачивание, происходящее при участии иона трехвалентного железа, который образуется в результате жизнедеятельности бактерий, называют «непрямой «экстракцией.
В настоящее время бактериальное выщелачивание, известное как биогидрометаллургия или биоэкстрактивная металлургия, применяется в промышленных масштабах для перевода в растворимую форму меди и урана (выщелачивание отвалов и бедных руд). Бедную руду или отвальную породу перевозят из карьера в расположенную поблизости местность с естественным уклоном, который дает возможность собирать используемые растворы. Воизбежании загрязнения подпочвенных и поверхностных вод выбирают непроницаемые для воды участки. Для начала процесса выщелачивания отвал смачивают водой, подкисленной серной кислотой до рН= 1.5 — 3.0. Кислый раствор просачивается сквозь руду и, поскольку он содержит углекислый газ и кислород, создает благоприятную среду для размножения природных ацидофильных тиобацилл. Из выщелачиваемых отвалов вытекают растворы, содержащие металлы, они направляются в отстойники, откуда извлекаются путем осаждения или экстракции, а отработанные выщелачивающие растворы вновь поступают в отвал.
Промышленное применение нашел также процесс удаления серы из угля. Предварительная обработка бактериями T. ferrоoxidans приводит к окислению значительной доли серы (в виде пирита) до серной кислоты (60−98% за 7−10 суток). Обработку угля проводят открытым способом, но ведется поиск методов введения микроорганизмов в пласты угля.
Закрепленные на поверхности раздела (жидкость-твердое тело и жидкость-жидкость) микроорганизмы применяют для увеличения добычи нефти. Традиционными методами можно извлечь из месторождений лишь часть ее, около 50% нефти остается в капиллярах пор породы месторождений.
Интенсификация добычи нефти осуществляется микроорганизмами и продуктами их жизнедеятельности. Для этого используют стимуляцию деятельности природной микрофлоры месторождений путем введения в скважины питательных веществ (мелассы, молочной сыворотки, микроорганизмов, продуцирующих нужные метаболиты, а также введением определенных биопродуктов, наработанных вне месторождений.
В скважину вводят несколько сот литров посевного материала, содержащего раствор мелассы. Увеличение выхода нефти составляет 16−200%. Этот эффект обусловлен влиянием следующих продуктов жизнедеятельности микроорганизмов: газов — СО2, СН4, N2, Н2 (уменьшение вязкости и увеличение давления); полисахаридов — альгината, ксантана, курдлана, декстрана, пуллулана, эмульсана (уменьшение межповерхностного натяжения между нефтью и водой); поверхностно-активных веществ — глицеридов, липидов, пептидолипидов, софролипидов и других (уменьшение натяжения); органических кислот — муравьиной, масляной, молочной и других (увеличение проницаемости пород путем растворения карбонатов и доломитов); низкомолекулярных растворителей — спиртов, кетонов (уменьшение вязкости).
Биотехнологические методы добычи полезных ископаемых экономически выгодны. Новые методы добычи позволяют разрабатывать бедные и сложные по составу месторождения, осваивать глубинные места залегания, обеспечивать комплексную утилизацию сырья, исключить загрязнение окружающей среды элементами сырья, хотя экологическое влияние массированного использования микроорганизмов изучено недостаточно.
Биосенсоры на основе иммобилизованных ферментов.
Высокая эффективность биологических катализаторов и специфичность их действия делают ферменты идеальными реагентами для аналитической химии. Благодаря этим особенностям с помощью ферментов обнаруживаются вещества при предельно низкой концентрации (до 10-12 моль/л) в присутствии множества других соединений. К настоящему времени созданы искусственные аналитические системы различных конструкций (биосенсоры, датчики, ферментные электроды, проточные анализаторы), потенциометрического, амперометрического, калориметрического, пьезоэлектрического и оптического типа, содержащие иммобилизованные ферменты и клетки и предназначенные для автоматического детектирования продуктов энзиматических превращений. Например, если использовать иммобилизованную глюкозооксидазу, то концентрацию окисляемой кислородом глюкозы определяют, регистрируя количество выделившегося в ходе реакции пероксида водорода полярографическим, колориметрическим или люминесцентным методом.
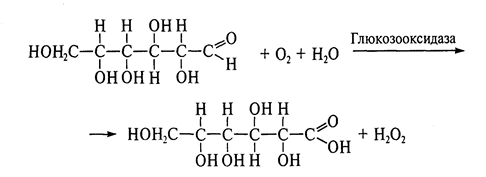
Технологические варианты сенсоров с иммобилизованными ферментами весьма разнообразны — колонки, трубки, полые волокна и пр. С их помощью на практике определяют концентрацию широкого спектра соединений — глюкозы, аминокислот, мочевины, пенициллина, АТФ, НАДН, ФМН, стероидов, триглице-ридов, желчных кислот и многих других. Так, американскими исследователями сконструирован микродатчик на основе глюкозооксидазы и рутениевого красите-ля, иммобилизованных в полиакриламидной матрице с использованием суб-микронных оптических волокон. Микробиосенсор, не вызывая повреждений, может быть введен в клетку и даже в отдельные ее компартменты для измерения содержания в них глюкозы и кислорода. Предложены датчики на базе иммунодетекции для проведения экспресс-анализов на присутствие производных диоксина и оценки содержания биогенных аминов (с помощью моноамино-оксидазы) в пищевых продуктах в связи с процессами их старения. Для определения мочевины ферментным электродом требуется всего 30 с.
Биосенсоры на основе иммобилизованных ферментов помогают выполнять десятки быстрых и точных анализов при диагностике заболеваний, контролировать содержание вредных веществ (инсектицидов, пестицидов, удобрений) в пищевых продуктах и в воздухе. Биосенсоры нашли применение в решении аналитических задач в химической и микробиологической промышлен-ности, а также в научных исследованиях.
Начаты разработки новых поколений биодатчиков на базе аффинных взаимодействий (биосродства) типа фермент-ингибитор, антитело-антиген, агонист (антагонист) — клеточный рецептор на основе полупроводниковых устройств-термисторов и пьезоэлектрического эффекта.
Термистор представляет собой полупроводниковый резистор, сопротивление которого изменяется с изменением температуры. Датчик представляет собой термистор, на поверхности которого находятся иммобилизованные клетки или молекулы ферментов или антител. Он с высокой чувствительностью регистрирует изменения температуры, происходящие при протекании биохимических реакций с анализируемыми веществами.
Особенно высокой чувствительностью обладают пьезоэлектрические биосенсоры. Принцип их действия основан на изменении частоты переменного тока, при которой пьезоэлектрик, например кристалл кварца, колеблется в резонансном режиме. Химически чистый и физически однородный кристалл пьезоэлектрика характеризуется постоянной резонансной частотой колебаний, которая для кварца составляет 9 или 14 МГц. Если на кристалл налипает то или иное вещество, частота резонансных колебаний меняется в соответствии с уравнением:
dн/н = -dm/Apt ,.
где v — частота колебаний; dv — ее приращение; dm — изменение массы кристалла; А — поверхность кристалла; р — его плотность; t — его толщина.
Пьезоэлектрики регистрируют изменение массы порядка 10-12г. Биосенсоры на их основе содержат иммобилизованный на пьезокристалле фермент, антитело, антиген или нить ДНК (РНК). О наличии детектируемого агента, вступающего в ферментативную, иммунную реакцию или образующего гибридную молекулу (ДНК (РНК) с иммобилизованным биообъектом, свидетельствует формирование соответствующего комплекса на пьезоэлектрике, которое увеличивает его массу и меняет частоту резонансных колебаний. С помощью пьезоэлектрического биосенсора с иммобилизованным антигеном можно обнаружить антитела в сыворотке крови, разведенной в 1000 раз.
Правда, в водном растворе кристалл реагирует слабее (изменением резонансной частоты) на увеличение своей суммарной массы, чем на воздухе. Поэтому предполагают погружать пьезоэлектрический биосенсор в раствор, где будет формироваться фермент-субстратный (фермент-ингибиторный) или иммунный комплекс, а далее определять колебательные характеристики кристалла в воздухе. Высокая чувствительность пьезоэлектриков к изменениям массы в воздушной среде позволяет использовать их в биосенсорах на газы, загрязняющие атмосферу.
Учеными из Университета Пердью (США) разработаны био-оптические лазерные диски «BioCD», которые, в перспективе, предполагается применять при проведении детального анализа крови. Принцип действия «BioCD» аналогичен принципам, положенным в основу традиционных компакт-дисков. В частности, как и обычные носители, «BioCD» имеют дорожки. Правда, они используются не для записи информации, а для хранения специальных веществ, реагирующих на строго определенный тип белков. Другими словами, треки «BioCD» напоминают микроскопические пробирки с реактивами. Для проведения анализа достаточно нанести каплю крови на поверхность диска и считать результаты при помощи лазерного привода.
По словам Дэвида Нолта, руководителя проекта, человеческая кровь содержит порядка десяти тысяч различных белков, которые, в идеале, должны регистрировать био-оптические диски. Ведь даже незначительные изменения концентрации некоторых из этих белков могут предвещать развитие серьезных заболеваний. Следует отметить, что в настоящее время при проведении детальных исследований крови применяется очень дорогое оборудование стоимостью до 50 тысяч долларов и выше. Вместе с тем, появление био-оптических детекторов позволит значительно снизить стоимость проведения процедур, поскольку считывать данные можно будет посредством лишь незначительно модифицированных CD-приводов. Правда, в настоящее время предложенная методика нуждается в серьезных доработках, и прежде чем «BioCD» появятся на рынке, пройдет не менее десяти лет.
Иммобилизованные клетки микроорганизмов обычно применяют в комбинации с амперометрическими или потенциометрическими (газовыми) электродами для регистрации отдельных веществ и комплексных физиолого-биохимических параметров, которые трудно или вовсе невозможно оценить с помощью изолированных ферментов: потребление кислорода (показатель органического загрязнения природных или сточных вод), измеряемое амперометрически по поглощению О2 или потенциометрически по образованию СО2 клетками гриба Trichosporon cutaneum или бактерий Azotobacter vinelandii, Ecoli и др.; токсичность водного раствора или воздуха, измеряемая сенсорами на базе иммобилизованных цианобактерий, у которых активность фотосистемы II снижается при наличии в среде токсических компонентов, особенно гербицидов; мутагенное действие тестируемого агента, определяемое стандартными методами обнаружения мутантных клеток, например, растущих и соответственно выделяющих СО2 лишь на обогащенной среде.
Микробные биосенсоры, в отличие от ферментных, не требуют регенерации кофакторов, стабильны (срок службы от 5 до 60 дней), причем стабильность может быть повышена периодическим погружением иммобилизованных клеток в свежую питательную среду. Недостаток микробных биосенсоров — медленный отклик на детектируемый агент (обычно от 10 до 60 мин), что объясняется затратами времени на транспорт этого агента внутрь клетки и его ферментативное расщепление, предшествующее появлению вне клеток продуктов, взаимодействующих с электродом (О2, СО2 и др.). Клетка в некоторых случаях откликается и на посторонние агенты, поэтому иммобилизованные на биосенсоре клетки целесообразно обрабатывать ингибиторами побочных ферментативных реакций, не специфичных по отношению к детектируемому агенту.
Известны биосенсоры с соиммобилизованными клетками и изолированными ферментами, что позволяет осуществлять многостадийные ферментативные реакции. Так, соиммобилизация уреазы и нитрифицирующих бактерий на О2-электроде дает чувствительный биосенсор на мочевину. Возможно также совместное применение двух и более видов микроорганизмов в составе одного биосенсора.
Использование тканей растений и животных перспективно, но применяются сравнительно редко. Во многих случаях они более стабильны, чем ферменты и клетки, а порой более специфичны, чем микробные клетки. Так, глутаматный биосенсор на основе ткани свиной почки не откликается на мочевину, аланин, аргинин, гистидин и другие аминокислоты. Сложные органические соединения, такие как АМФ, дофамин, аскорбиновая кислота, в растительных тканях разлагаются до простых ионных или газообразных продуктов, что дает возможность регистрировать их ионоселективными (газовыми) электродами. Иммобилизация тканевых срезов — укрытие под сеткой или под мембраной — подкупает своей простотой. Например, дофамин регистрируют с помощью «бананотрода» — тонкого среза мякоти банана, иммобилизованного на О2-электроде.
Созданы датчики, в которых используют рецепторные системы различных организмов: пучок нервов или отдельные нервы из усов краба (биосенсор на аминокислоты и пуриновые основания), щупальца синих крабов, раков (биосенсоры на аминокислоты и гормоны), собачий нос (обнаружение контрабандных наркотиков и взрывчатки). Иногда предпочитают не весь рецепторный орган, а лишь клетки или даже их органеллы, непосредственно отвечающие за узнавание того или иного агента. Таковы биосенсоры с изолированными рецепторами растений на ауксины и токсины.
Рецепторные биосенсоры дают быстрые ответы на детектируемый агент, высокоспецифичны, баснословно чувствительны: биосенсор на базе щупалец атлантического синего краба отвечает на 10-13 моль/л глутамина. Однако изолированные рецепторы недостаточно стабильны. Продление их жизни ищут на путях инкапсулирования рецепторов в бислойные липидные мембраны, в том числе в липосомы.
Иммобилизованные ферменты в медицине.
Иммобили-зованные ферменты имеют огромное значение для медицины. В частности, большой рынок сбыта занимают тромболитические ферменты, предназначенные для борьбы с сердечнососудистыми заболеваниями. Так, в отечественную клиническую, практику внедрен препарат «стрептодеказа», содержащий стрептокиназу — активатор предшественника протеиназы плазмина, предотвра-щающий образование тромба в кровеносной системе.
Ферменты, разрушающие некоторые незаменимые аминокислоты (например, аспарагиназа), используют для борьбы со злокачественным ростом опухолей. Протеолитические ферменты (трипсин, химотрипсин, субтилизин, коллагеназа), иммобилизованные на волокнистых материалах (целлюлоза, полиамидные волокна, декстран и др.), применяют для эффективного лечения ран, язв, ожогов, абсцессов, а их белковые ингибиторы — в заместительной терапии для лечения эмфиземы и панкреатитов.
В 2004 г. появилось сообщение о том, что британская компания «Cell Tran», разработала уникальную технологию заживления ран, которая, в перспективе, может существенно ускорить процесс реабилитации пациентов с тяжелыми ожогами или язвами. Материал, получивший название «MySkin», представляет собой специальную мембрану, созданную из безопасного, с медицинской точки зрения, полимера. Поверхность мембраны покрыта питательным веществом, создающим благоприятные условия для размножения клеток. В процессе лечения у пациента сначала берется небольшой образец ткани, который затем выращивается в лаборатории до образования колонии. Далее клетки сформировавшейся кожи помещаются на мембрану, а повязка закрепляется на поврежденном участке тела. Поскольку бандаж «MySkin» использует ткани самого пациента, то выращенные клетки не только не отторгаются, но, напротив, очень быстро приживаются на ране.
Как сообщается, повязки «MySkin» будут применяться, в первую очередь, при заживлении диабетических язв. Такие язвы могут оставаться открытыми в течение многих месяцев, доставляя немало проблем, как самим пациентам, так и лечащим врачам. Кроме того, бандажи «MySkin» смогут помочь людям, пострадавшим в пожарах. О сроках появления «самозаживляющих бинтов» в продаже пока ничего не известно, однако медики намерены вывести новый продукт на рынок как можно скорее.
Исключительно важны с практической точки зрения работы, посвященные направленному транспорту лекарственных веществ. В этом отношении особенно выгодны инкапсулированные ферменты типа искусственной клетки. Так, микрокапсулы, стенки которых представлены оболочкой эритроцита («тень эритроцита»), а их содержимое заполнено ферментом аспарагиназой, переносятся кровотоком к зонам скопления аспарагина и поэтому применяются для лечения аспарагинзависимых опухолей, в частности саркомы. Колонки, заполненные микрокапсулами с ферментом, используют для диализа в аппарате «искусственная почка», которая работает в 100 раз эффективнее обычного аппарата.
Таким образом, использование иммобилизованных ферментов во многих жизненно важных отраслях народного хозяйства становится все более массовым. Выгодное сочетание избирательности и эффективности с долговечностью и стабильностью иммобилизованных ферментов в корне меняет химическое производство, способы добывания сырья, способствует созданию новых биотехнологических процессов и методов терапии, совершенствует медицинскую диагностику, анализ, органический синтез и оказывает огромное влияние на образ жизни человека.