Основы электрохимии.
Основы электрохимии
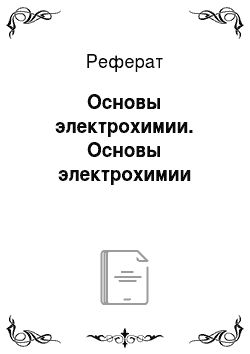
Окислительно-восстановительные процессы. Процесс отдачи электронов, т. е. повышения степени окисления, называется окислением; элемент, отдающий электроны — восстановитель. Которое характеризуется электродным потенциалом, определяющим меру окислительно-восстановительной способности металла в растворе электролита (уравнение Нернста). Причиной сдвига потенциала от равновесного значения… Читать ещё >
Основы электрохимии. Основы электрохимии (реферат, курсовая, диплом, контрольная)
Основы электрохимии
Бестоковые окислительно-восстановительные процессы:
G0 < 0.
Окислитель + восстановитель продукты: .
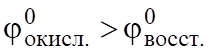
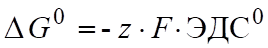
; bB + dD > lL + mM;
ЭДС = ЭДС0 + .
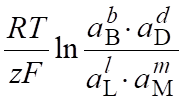
Ме.
;
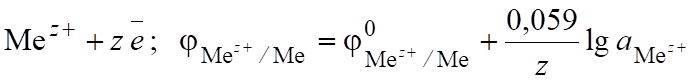
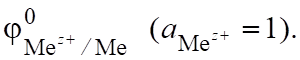
Химические источники тока (превращение химической энергии в электрическую).
Необратимые (гальванические и топливные элементы):
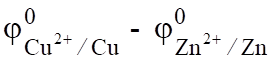
Zn0 + Cu2+ Zn2+ + Cu0; ЭДС0 = ;
восст. окисл.
U = ЭДС0 — IR — ДЕполяр.; ДЕполяр. = Дца + (-Дцк);
Дцэлектр. = а + blg i.
Обратимые (аккумуляторы):
Pb + PbO2 + 2H2SO4 2 PbSO4 +2 H2O;
Fe + 2 Ni (OH)3 Fe (OH)2 + 2 Ni (OH)2.
Электролиз (превращение электрической энергии в химическую):
Катод (-) Анод (+).
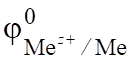
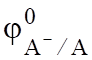
; полож. ионы;; отриц. ионы.
Uэл. = ЭДС0 + Eполяр. + I (Rl + R0);
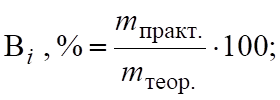
mтеор = бэл · I. t; A/zF = бэл = mтеор при Q = 1 Кл;
F = 96 500 Кл. моль-1; F = 26,8 А. г. моль-1.
Окислительно-восстановительные процессы. Процесс отдачи электронов, т. е. повышения степени окисления, называется окислением; элемент, отдающий электроны — восстановитель.
Процесс присоединения электронов, т. е. понижения степени окисления, называется восстановлением; элемент, присоединяющий электроны — окислитель.
Окисление:
Ме0 — z > Мez+. (6.1).
восстановитель.
Восстановление:
2Н+ + 2 > Н. (6.2).
окислитель Важнейшие восстановители: металлы (Al, Zn, Mg); водород (Н2); углерод (С); анионы: I, S2-; ионы металлов: Sn2+, Fe2+.
Важнейшие окислители: галогены (F2, Cl2 …); O2, S, P; анионы: Cr2O, NO, MnO, ClO; оксиды: Cl2O7, MnO2, N2O4; катионы: Fe3+, Mn4+.
В роли окислителей и восстановителей в зависимости от условий среды выступают анионы SO, NO, молекулы Н2О2.
Окислительно-восстановительные реакции — реакции, при которых вследствие окисления и восстановления происходит изменение степеней окисления элементов.
Возможность самопроизвольного протекания окислительно-восстановительных реакций определяется знаком энергии Гиббса.
В общем виде окислительно-восстановительную реакцию записывают следующим образом:
Ох + z Red; (6.3).
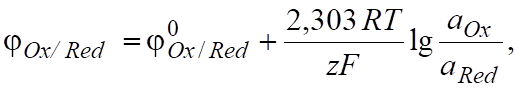
(6.4).
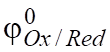
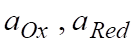
где — стандартный окислительно-восстановительный потен-циал при; - активности соответственно окис-лителя и восстановителя.
Рассмотрим реакцию.
2KMnO4+5NaNO2+3H2SO4 >2MnSO4+5NaNO3+K2SO4+3H2O; (6.5).
MnO + 5 + 8H+ > Mn2+ + 4H2O; (6.6).
окисл.
NO — 2 + H2O > NO + 2 H+; (6.7).
восст.
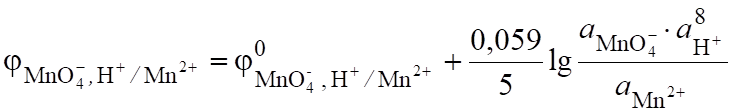
(6.8).

(6.9).
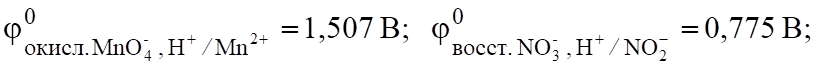
окисл. > восст.; G < 0.
Значит, эта реакция протекает самопроизвольно.
Рассмотренная выше реакция, протекающая в кислой среде (рН 7 MnO переходит в MnO, где ион марганца шестивалентен). В ряде случаев окислительно-восстановительные реакции протекают без участия ионов и молекул воды.
Химические источники тока. При погружении металла в раствор его собственной соли устанавливается равновесие Ме Меz+ + z,.
которое характеризуется электродным потенциалом, определяющим меру окислительно-восстановительной способности металла в растворе электролита (уравнение Нернста).
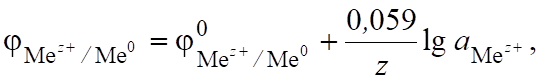
(6.10).
где величина 0,059 В относится к Т = 298 К.
Для измерения электродного потенциала металла, опущенного в растворы с определенной концентрацией его соли, используют электроды сравнения, электродный потенциал которых постоянен и не меняется при изменении поляризации.
В качестве электрода сравнения используют следующие (приводятся токообразующие реакции):
хлорсеребряный электрод:
AgCl + Ag + Cl;
каломельный электрод:
Hg2Cl2 + 2 2Hg + 2Cl;
ртутно-оксидный электрод:
Hg2O + 2 + H2O 2Hg + 2OH.
Для хлорсеребряного электрода потенциал при 298 К равен 0,202 В (раствор KCl насыщ.).
Электродвижущая сила (ЭДС) составит:
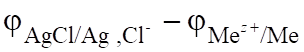
ЭДС = цокисл — цвосст =. (6.11).
Электролиз. Электролизом называются окислительно-восстановительные процессы, происходящие раздельно на электродах при протекании через раствор или расплав электролита электрического тока. В электролизере имеется два типа электродов: катод (), подключенный к отрицательному полюсу источника тока, и анод (+), подключенный соответственно к положительному полюсу.
Электролиз подчиняется закону Фарадея:
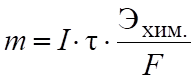
(6.12).
где m — количество вещества, выделяющегося на электродах; I — ток, А; - время, с; Эхим. — химический эквивалент; F — число Фарадея (96 500 Кл. моль-1).
Отношение Эхим./F — электрохимический эквивалент, масса вещества, выделяющегося на электродах при пропускании 1 кулона электричества.
Выход по току (ВТ) — отношение mпракт. на электроде к mтеор. по закону Фарадея.
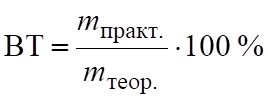
. (6.13).
Кинетика электродных процессов. При прохождении тока электродные потенциалы анода сдвигаются в область более положительных значений (анодная поляризация), а катода — в область более отрицательных значений (катодная поляризация).
Величина сдвига потенциала от равновесного значения — перенапряжение .
Поэтому напряжение электролизера всегда больше равновесного значения электродвижущей силы и включает значение поляризации на электродах, омического падения напряжения в электролите I· r1 и в проводниках первого рода I· r2.
U = ЭДСравн. + поляр. + I (r1 + r2). (6.14).
Плотность тока i = I/S (A/см2).
Потенциал катода при плотности тока i составляет.
iк = равн. — к. (6.15).
Потенциал анода при плотности тока i составляет.
ia = равн. + а. (6.16).
Причиной сдвига потенциала от равновесного значения (перенапряжение) является концентрационная (конц.), химическая (х), электрохимическая (Дэл.х) поляризация:
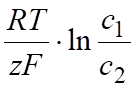
конц.() =, (6.17).
где с1 — концентрация у электрода; с2 — концентрация в глубине раствора.
Химическая поляризация обусловлена протеканием вторичных химических процессов окисления, солеобразования на электродах.
Электрохимическая поляризация эл. х — замедленность электродной реакции окисления или восстановления.
На катоде в первую очередь протекает процесс восстановления катиона, которому соответствует наиболее положительное значение электродного потенциала.
На аноде в первую очередь протекает процесс окисления материала анода, анионов, которые обладают наиболее отрицательной величиной электродных потенциалов.
При электролизе водного раствора щелочи NaOH к катоду подходят ионы Na+, H2O; к аноду — анионы ОН.
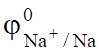
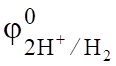
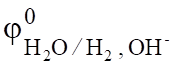
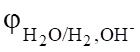
Сравнивая электродные потенциалы для катиона Na+ (= - 2,714 B) и иона водорода (= -0,059 рН, а в щелочной среде (рН=14) = -0,82 В), перенапряжение выделения водорода на свинце в растворе NaOH (1,56 В), определим потенциал водородного электрода = -0,82 — 1,56 = -2,38 В.
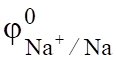
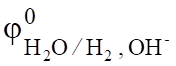
Сравнивая значения = -2,714 В и = -2,38 В, можно установить, что на катоде восстанавливается вода по реакции.
2Н2О + 2 = Н2 + 2ОН, (6.18).
а на аноде окисляются гидроксид-ионы.
4ОН — 4 = 2Н2О + О2. (6.19).
Потенциалы этих процессов во многом зависят от парциальных давлений газов.
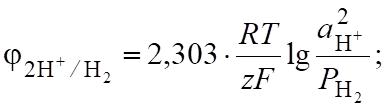
(6.20).
(рН<7).
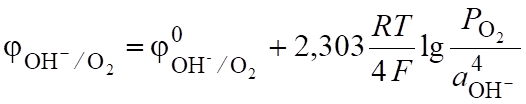
. (6.21).
(pH 7).
окислитель восстановитель химический электрон.