Механизм биосинтеза белков

При блокировке процесса синтеза в клетке ускоряется транспорт питательных веществ (аминокислот, липидов, глюкозы) из кровяного русла и активируется внутриклеточный кругооборот веществ. В первую очередь ускоряется поток белков в ядро клетки, с ними поступают ферменты, активирующие транскрипцию и процесс создания субчастиц рибосом. Последние в большем количестве поступают в цитоплазму, где… Читать ещё >
Механизм биосинтеза белков (реферат, курсовая, диплом, контрольная)
Процесс биосинтеза многостадийный. Сначала необходимо получить доступ к информации, спрятанной в двойной спирали ДНК. Для этого существуют механизмы расплетения нитей ДНК особым ферментом РНК-полимеразой и образования копии требуемой информации (рис. 115).
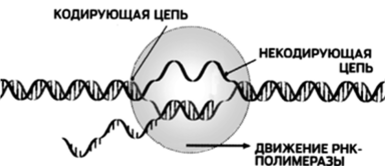
Рис. 115. Образование транскрипта с помощью РНК-полимеразы
Первый этап, этап транскрипции (перезаписи), завершается образованием матричной РНК (мРНК) и её выходом из ядра клетки, где находятся цепи ДНК, в цитоплазму. Так генетическая информация физически переносится в новую среду.
В цитоплазме клетки происходит процесс сборки белка из растворенных в цитоплазме аминокислот, эту стадию синтеза принято называть трансляцией. Между этими основными стадиями существует промежуточный этап, на котором мРНК, несущая полную копию определенного участка ДНК, подвергается процессингу — таково общее название различных модификаций мРНК, в которых к её концам могут добавляться различные структуры, из неё могут вырезаться нитроны и т. д.
Первая стадия — расплетение ДНК и получение мРНК-когши контролируется ферментом полимеразой. В неактивном состоянии цепи ДНК навернуты на белок гистон и защищены от внешнего воздействия (см. рис. 112). Молекулы РНК-полимеразы вытесняют гистон, и двойная цепь раскручивается, расходясь па расстояние около 10 им в диаметре (см. рис. 115) Фермент способен образовывать связи не только с цепями ДНК, вызывая их расхождение, но и с отдельными нуклеотидами. Он служит катализатором присоединения нуклеотидов к кодонам мРНК. При этом действует принцип комплементарное™ и растущая цепь мРНК оказывается построенной из антикодонов (рис. 116).
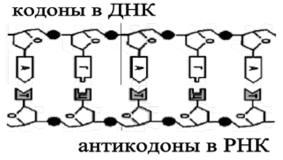
Рис. 116. Принцип комплементарного соответствия
Близкое расположение антикодонов приводит к соединению свободных «хвостов» остатков фосфорных кислот с атомами углерода соседних «платформ» (рибозами), и формируется цепь мРНК.
Вдали от РНК-полимеразы её стабилизирующая роль уменьшается и цепь антикодонов постепенно отделяется от цепи ДНК. Образно говоря, РНКполимераза выполняет роль зажима, удерживающего нуклеотиды в нужном положении на время, необходимое для переключения химических связей.
Следует отметить, что в клетках эукариот (т. е. имеющих ядра) имеется три типа РНК-полимераз: одна из них производит мРНК, две другие образуют рибосомныс рРНК и транспортные тРНК. Через поры в оболочке ядра все три типа РНК поступают в цитоплазму. Здесь происходит процессинг и матричная РНК превращается в необходимую для данной клетки полноценную матричную мРНК. Основным звеном процессинга является альтернативный сплайсинг — процесс вырезания нитронов, т. е. некодирующих участков цепей РНК.
Роль альтернативного сплайсинга очень важна. Он позволяет из одной последовательности, мозаики кодирующих и некодирующих участков гена, получить множество вариантов белков, отличающихся по составу, структуре и свойствам. Поясним ситуацию, представленную на рис. 117, где приведены два варианта вырезания нитронов с присоединенными к ним экзонами (кодирующими участками гена) [13].
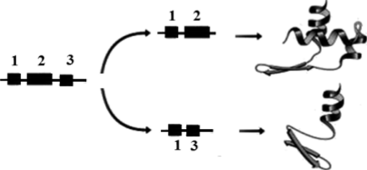
Рис. 117. Два варианта сплайсинга
Если в кодирующей последовательности останутся участки 1 и 2, то в результате синтеза получится один вариант белка. Если останутся участки 1 и 3, то результат синтеза будет другим. Процесс сплайсинга позволяет получить из одного и того же гена нс один белок (как считалось ранее), а целое семейство белков сходных, но все же отличающихся по «нюансам». В рекордном случае можно получить несколько тысяч вариантов (!).
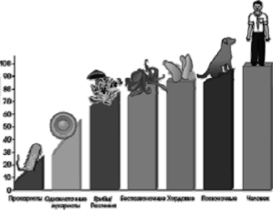
Рис. 118. Увеличение доли интронов в геноме организмов
Таким образом, в отдельных клетках из общей базы данных образуются различные, необходимые конкретной клетке белки. Совсем недавно было установлено, что по мере увеличения сложности организмов увеличивается и длина нитронов в геноме организмов (рис. 118).
В общем гене сложных организмов суммарная длина интронов может превосходить суммарную длину экзонов в десятки и сотни раз. Более того, если сравнивать между собой кодирующие последовательности (экзоны) в геномах мыши и человека, то окажется, что они идентичны на 99%. Почему же мы так не похожи на мышей?
Может быть, потому, что у нас альтернативный сплайсинг идёт или по другому пути, или более множественный. Или и то и другое одновременно [13].
После процессинга наступает второй этап синтеза, в котором главным действующим лицом является рибосома. Рибосома состоит из двух субчастиц — большой и малой. Они имеют различные молярные массы и поэтому различаются по скорости осаждения на центрифуге. Большую субчастицу обозначают как 60S, малую — как 40S. Субчастицы находятся в цитоплазме раздельно и собираются вместе на цепи матричной РНК. Каждая из субчастиц состоит из белкового каркаса и внутренней рРНК, в малой частице 40S рРНК имеет спирализацию, в большой субчастице рРНК имеет зигзагообразную форму без вторичной структуры.
На одной цепи мРНК, как правило, рядом собираются несколько рибосом, образуя комплекс полирибосомы. Каждая рибосома служит станком для сборки своей цепи белка, так что при согласованном передвижении полирибосомы вдоль цепи мРНК сразу синтезируется несколько одинаковых молекул данного вида белка.
В процессе сборки полипептидной цепи транспортные тРНК переносят к рибосоме каждая свою аминокислоту; для 20 аминокислот имеется 20 типов транспортных РНК (рис. 119).
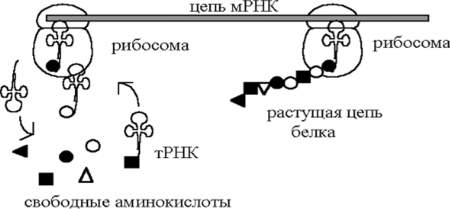
Рис. 119. Схема процесса сборки полипептидной цепи
Цепи тРНК — самые короткие (около 80 нуклеотидов), в центральной части большой петли встроен кодон одной из аминокислот, которая способна соединяться со свободным концом тРНК. По правилу комплементарное™ кодон может подойти (как ключ к замку) только к своему антикодону, поэтому цепь белка строится в точном соответствии с расположением кодонов в ДНК.
Таким образом, биологическая информация проходит последовательность: кодон — антикодон — и снова кодон. Энергия, необходимая для передвижения рибосомы вдоль цепи мРНК, поступает в результате гидролиза на большой субчастице гуанозинтрифосфата ГТФ: ГТФ «теряет» группу Р04 и превращается в гуанозиндифосфат ГДФ. Рибосома присоединяется малой субчастицсй к цепи матричной РНК, транспортная РНК доставляет очередную аминокислоту, которая сначала закрепляется на большой субчастице, а затем соединяется с растущей полипептидной цепыо.
Процесс сшивания в полимерную цепь (по крайней мерс в некоторых случаях) происходит при участии соответствующих ферментов. После этого тРНК освобождается и возвращается в цитоплазму за очередным «грузом».
Документальная фотография, приведенная на рис. 120, иллюстрирует начальный момент сборки на матричной РНК комплекса полирибосомы и цепи белка, которые на нем синтезируются [14].
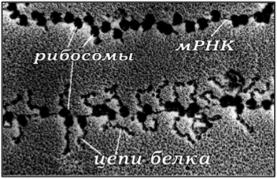
Рис. 120. Синтез цепей белка на комплексе полирибосомы
Белки проходят дополнительную обработку сначала внутри эндоплазматического ретикулума, затем в так называемом аппарате Гольджи. После этого везикулы с белком подходят к мембране клетки и происходит экзоцитоз — выход синтезированного белка в межклеточное пространство или в кровоток без нарушения герметичности самой клетки. Следует отметить высокую эффективность процесса синтеза белков, он происходит с выходом продукта, соответствующим подходу тысяч тРНК к рибосоме за одну секунду. При этом «подбор ключа» кодона тРНК к антикодону мРНК обеспечивается интенсивным тепловым движением всех молекул.
При рассмотрении процессов в клетке невольно возникает ассоциация с фабрикой или химическим заводом. Есть участок копировальный, есть производство конечного продукта для собственных нужд и на экспорт в другие клетки. Что произойдет, если синтез белков на существующих рибосомах вдруг будет заблокирован?
В экспериментах сбой в синтезе (его остановка) производился путем введения конкурента для ГТФ, который занимает его место на рибосоме, но не выделяет при этом энергии, достаточной для сдвига рибосомы на следующий кодон. Оказывается, что на фабрике-клетке производятся и белоксинтезирующие «станки"-рибосомы. Это производство организовано в пределах ядра клетки. Между ядром и цитоплазмой существуют встречные потоки веществ.
Рибосомные белки, произведенные по вышеописанной «технологии», поступают в ядро, где идет процесс транскрипции генов рРНК в виде общей длинной цепи. В результате процессинга (обработки) из длинной цепи выделяются короткие участки двух видов — рРНК 185 и рРНК 285. На эти рибосомы осаждаются поступившие рибосомные белки и образуются 405 и 605 субчастицы рибосомы. Эти «полуфабрикаты» выходят через поры ядра в цитоплазму (размеры целой рибосомы велики для «проходной»). В цитоплазме растворены свободные рибосомы, но они также группируются на мембране так называемого эндоплазматического ретикулума в полирибосомы. По макроскопической аналогии это целая станочная линия, проходя по которой (движение относительно, рибосомы «протягивают» мРНК) матричная РНК, вместо спирали стружки, производит спирали белков. При этом через специальные поры белок сразу попадает внутрь эндоплазматического ретикулума.
При блокировке процесса синтеза в клетке ускоряется транспорт питательных веществ (аминокислот, липидов, глюкозы) из кровяного русла и активируется внутриклеточный кругооборот веществ. В первую очередь ускоряется поток белков в ядро клетки, с ними поступают ферменты, активирующие транскрипцию и процесс создания субчастиц рибосом. Последние в большем количестве поступают в цитоплазму, где собираются в резервный «станочный парк», заменяющий испорченный. Таким путем восстанавливается работоспособность клетки и осуществляется экспорт вырабатываемых ею веществ в кровяное русло.
В многоклеточных организмах на любое нарушение гомеостаза клетка реагирует интегральным повышением мощности работы всего белоксинтезирующего конвейера и сопряженным с ним увеличением белковой массы, то есть ростом. Это повышает защитный и энергетический потенциал клеток и позволяет им преодолеть вредоносное действие нагрузочного фактора (или стресса), если его сила не окажется чрезмерной (несовместимой с жизнью клетки).
Из этого следуют два вывода. Во-первых, умеренные нагрузки на клетки (через нагружение, иногда через стрессы всего организма) сопровождаются повышенным энсрговыдслснисм и ростом отдельных клеток, а с ними и организма в целом. В этом объяснение эмпирически известного факта повышения физических возможностей людей, занимающихся спортом или тяжелой работой. Во-вторых, при частых и значительных химических нагрузках на клетки (будь то последствия эмоций, или приема алкоголя, или радиационно-химических воздействий) адаптационный механизм «сбоит» и создает лишь дополнительные «машины трансляции», осуществляющие плохо контролируемый рост клеток, что приводит к избыточной массе организма, а по некоторым данным — к росту канцерогенных опухолей.