ДНК-полиморфизм и генетическое разнообразие популяций яблонной плодожорки и хлопковой совки по микросателлитным локусам

Изучение генетики популяций сельскохозяйственно-значимых вредных насекомых имеет большое значение в понимании миграционных процессов и потока генов при мониторинге вредителей. Для успешного контроля численности таких вредителей сельскохозяйственных растений, как хлопковая совка Helicoverpa armigera Hbn. (Lepidoptera:Noctuidae) и яблонная плодожорка, Cydia pomonella (L.) (Lepidoptera… Читать ещё >
ДНК-полиморфизм и генетическое разнообразие популяций яблонной плодожорки и хлопковой совки по микросателлитным локусам (реферат, курсовая, диплом, контрольная)
Изучение генетики популяций сельскохозяйственно-значимых вредных насекомых имеет большое значение в понимании миграционных процессов и потока генов при мониторинге вредителей [1,2]. Для успешного контроля численности таких вредителей сельскохозяйственных растений, как хлопковая совка Helicoverpa armigera Hbn. (Lepidoptera:Noctuidae) и яблонная плодожорка, Cydia pomonella (L.) (Lepidoptera: Tortricidae), необходимо всестороннее изучение изменчивости генетической структуры популяций этих видов насекомых, в том числе и на молекулярном уровне. Оценка изменчивости молекулярно-генетической структуры популяций насекомых будет способствовать также более полному пониманию микроэволюционных процессов, связанных с адаптивностью насекомых к инсектицидам и другим стрессовым факторам внешней среды.
Несмотря на экономическую значимость данных видов вредителей, очень мало сегодня известно о генетической структуре популяций яблонной плодожорки и хлопковой совки, что является важным аспектом по созданию стратегии контроля их численности. Проведение молекулярно-генетического анализа популяций C. pomonella с использованием кодоминантных маркеров, таких как микросателлиты (SSR, simple sequence repeat) стало возможным благодаря исследованиям последних лет [3,4]. Так, сконструированные французскими учеными для яблонной плодожорки SSR-праймеры [4], позволили проанализировать молекулярно-генетическую структуру популяций C. pomonella по микросателлитным локусам во Франции [5] и Чили [6]. плодожорка генетический микросателлитный ПЦР анализ популяций хлопковой совки, H. armigera, по микросателлитным локусам стал возможен, благодаря созданию и идентификации специфических для этого вида SSR-маркеров [7−10]. С использованием данных маркеров SSR-анализ хлопковой совки, Helicoverpa armigera, проводили исследователи из Индии [11]. В работе индийских авторов была исследована генетическая структура различных популяций H. armigera. Авторы обнаружили строгую генетическую дифференциацию популяций насекомых, собранных с различных видов растений.
В задачу наших исследований входила оценка молекулярно-генетического полиморфизма и генетического разнообразия краснодарской популяций хлопковой совки и ряда географических популяций яблонной плодожорки по SSR-маркерам.
Методика. Объектом исследований явились выборки из краснодарской популяции хлопковой совки и различных географических популяций яблонной плодожорки из Украины (две выборки: гг. Киев и Мелитополь) и России (четыре выборки: гг. Краснодар, Ейск, Ставрополь и Санкт-Петербург). Выделение ДНК из насекомых проводили СТАВ-методом по протоколам описанным нами ранее [12].
SSR-PCR проводили в конечном объеме 12,5 мкл, содержащем 10 mM Tris-HCl, pH 9.0, 50 mM KCl, 3,0 mM MgCl2, 50 µM каждого dNTP, 0,4µM каждого из праймеров, 0,5 U TaqДНК полимеразы (Диалат ЛТД, Москва) и 10−50 ng ДНК, на термоциклере iCycler (BioRad) с предварительной денатурацией (940С 2 мин) в режиме: денатурация — 940С 30с, отжиг праймера — 580С 40с, элонгация — 720С 40с (35 циклов), конечный синтез — 720С 3 мин.
В SSR-PCR хлопковой совки использовали две пары микросателлитных праймеров HaSSR1 (мотив повтора (TTGC)2GAT (TGY)4GAT (TGY)35), HaSSR3 (мотив повтора (TCA)6) [11]. В ПЦР анализе яблонной плодожорки использовали три пары микросателлитных праймеров Ср 1.63 (мотив повтора (GA)19), Ср 2.39 (мотив повтора (ТС)4АС (ТС)11) и Ср 2.157 (мотив повтора (GA)10) [4]. Наиболее высокое соотношение нулевых аллелей (более 50%) было отмечено для локуса Ср 2.157, поэтому он был исключен из дальнейшего анализа.
Продукты SSR-PCR разделяли в 8% полиакриламидном геле (ПААГ), длиной 20 см, толщиной 1 мм, при напряжении 300 В. Визуализацию ампликонов, после предварительного окрашивания бромистым этидием, проводили в УФ на трансиллюминаторе ECX-20.M (Vilber Lourmat). Генетическое разнообразие по Шеннону оценивали в популяциях яблонной плодожорки согласно [13], в популяции хлопковой совки — по Nei и Shennon, из пакета компьютерных программ POPGENE 32, version 1.31 (Francis C. Yeh).
Результаты.
Результаты ПЦР анализа ДНК хлопковой совки по двум микросателлитным локусам приведены на рисунке 1 и в таблице 1.
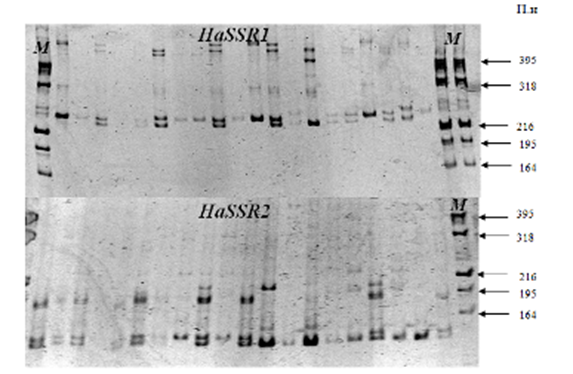
Рисунок 1 — SSR-фенотипы хлопковой совки. Электрофореграмма ампликонов H. armigera в 8% ПААГ (ПЦР анализ по двум микросателлитным локусам HaSSR1 и HaSSR3). М-маркеры молекулярных масс, пар нуклеотидов (п.н.).
Таблица 1 — ДНК-полиморфизм и генетическое разнообразие популяции H. armigera по двум микросателлитным локусам.
Локус. | Показатель. | |||||||
Р. | Sr. | A. | Ar. | N. | Ht. | h. | I. | |
HaSSR1. | 230−480. | 2,9. | 0,05. | 0,75. | 0,19. ±0,16. |
| ||
HaSSR3. | 100−220. | 2,7. | 0,05. | 0,75. | 0,23. ±0,17. | 0,37. ±0,21. | ||
Sr — размеры ДНК-фрагментов, п.н. (пар нуклеотидов). | ||||||||
A — число аллелей. | ||||||||
Ar — обогащенность аллелями (allelic richness) — средняя частота аллелей на особь. | ||||||||
N — доля нулевых гомозигот. | ||||||||
Ht — доля гетерозагот. | ||||||||
h — генетическое разнообразие по Nei (± стандартное отклонение). | ||||||||
I — индекс Шеннона (± стандартное отклонение). | ||||||||
Руровень полиморфизма,%. |
Размеры детектируемых ДНК-фрагментов варьировали от 230 до 480 пар нуклеотидов (п.н.) для HaSSR1 и от 100 до 220 п.н. — для HaSSR3. Оба локуса были высоко полиморфны (уровень полиморфизма 100%). Число детектируемых аллелей (вне зависимости от интенсивности ДНК-фрагментов) на локус составило 12 и 9 для HaSSR1 и HaSSR3, соответственно. Доля гетерозигот для обоих локусов была равна 0,75.
Полученные нами данные по генетическому полиморфизму популяции хлопковой совки в целом совпадали с данными полученными ранее на индийских популяциях [11]. Так, в частности, локус HaSSR1, выявлял большее количество аллелей, по сравнению с HaSSR3.
В то же время полиморфизм индийских популяций H. аrmigera по локусу HaSSR3 составлял только 50% (против 100% в наших опытах) и было выявлено только 4 аллеля, против 9 по нашим данным, что, вероятно, связано с генетическими особенностями столь географически отдаленных друг от друга популяций.
Молекулярно-генетическую структуру популяции хлопковой совки описывали по частотам встречаемости SSR-маркеров (таблица 2).
Таблица 2 — Частоты встречаемости SSR-маркеров в популяции хлопковой совки.
Аллель локуса HaSSR1 (п.н.). | Частота встречаемости. | Аллель локуса HaSSR3 (п.н.). | Частота встречаемости. |
0,03. | 0,08. | ||
0,08. | 0,08. | ||
0,19. | 0,03. | ||
0,19. | 0,05. | ||
0,11. | 0,26. | ||
0,03. | 0,11. | ||
0,03. | 0,05. | ||
0,05. | 0,37. | ||
0,05. | 0,61. | ||
0,05. | |||
0,55. | |||
0,34. |
Можно заметить, что из 12 аллелей локуса HaSSR1 наиболее часто встречались аллели 245 и 230 п.н., а локуса HaSSR3 — аллели размером 100 и 105 п.н.
Таким образом, Краснодарская популяция хлопковой совки генотипирована по двум микросателлитным локусам, что может явиться основой для дальнейших генетико-популяционных исследований данного вида насекомых.
Результаты ПЦР анализа ДНК яблонной плодожорки по двум микросателлитным локусам представлены на рисунке 2. Размеры детектируемых ДНК-фрагментов варьировали от 100 до 370 пар нуклеотидов (п.н.) для Ср 1.63 и от 100 до 480 п.н. — для Ср 2.39.

Рисунок 2 — SSR-фенотипы яблонной плодожорки. Электрофореграмма ампликонов C. pomonella в 8% ПААГ (ПЦР анализ по двум микросателлитным локусам Ср 1.63 и Ср 2.39). М-маркеры молекулярных масс, пар нуклеотидов (п.н.).
По всем популяциям в целом, оба локуса были высоко полиморфны (уровень полиморфизма 100%). Среднее количество аллелей на локус составило 2,3 и 3,2 для Ср 1.63 и Ср 2.39, соответственно. Доля гетерозигот в среднем по всем популяциям для обоих локусов была равна 0,57 (таблица 3).
ПЦР анализ ДНК насекомых из Украины (две выборки: Киев и Мелитополь) и России (четыре выборки: Краснодар, Ейск, Ставрополь и Санкт-Петербург) выявил значительные отличия в молекулярно-генетической структуре популяций C.pomonella. Среди выборок из разных стран наиболее гетерогенны были выборки из Украины: в среднем по локусам индекс Шеннона (Н) =6,4 и 6,3, для Киева и Мелитополя; и наименьшим генетическим разнообразием характеризовались выборки из России.
Таблица 3 — Генетический полиморфизм и генетическое разнообразие в различных выборках из географических популяций C.pomonella по двум микросателлитным локусам.
Локус. | Показатель. | Выборка. | По всем популяциям. | |||||
Краснодар | Ейск. | Ставрополь. | С.Петербург. | Киев. | Мелитополь. | |||
Ср.1.63. | Sr. | 110−320. | 110−310. | 110−160. | 100−260. | 100−370. | 100−350. | 100−370. |
A. | ||||||||
Ar. | 2,9. | 1,7. | 1,0. | 1,8. | 3,0. | 3,2. | 2,3. | |
N. | 0,10. | 0,20. | 0,15. | 0,10. | 0,09. | |||
Ht. | 0,80. | 0,45. | 0,10. | 0,60. | 0,65. | 0,80. | 0,57. | |
H. | 4,5. | 2,9. | 1,9. | 3,3. | 6,3. | 5,2. | 4,0. | |
Ср.2.39. | Sr. | 100−460. | 190−240. | 200−250. | 100−460. | 100−480. | 100−480. | 100−480. |
A. | ||||||||
Ar. | 4,1. | 0,9. | 1,1. | 1,3. | 4,3. | 7,3. | 3,2. | |
N. | 0,05. | 0,40. | 0,70. | 0,25. | 0,05. | 0,24. | ||
Ht. | 0,75. | 0,20. | 0,20. | 0,45. | 0,80. | 1,00. | 0,57. | |
H. | 7,3. | 1,7. | 2,8. | 3,4. | 6,4. | 7,5. | 4,9. | |
Sr — размеры ДНК-фрагментов, п.н. (пар нуклеотидов). | ||||||||
A — число аллелей. | ||||||||
Ar — обогащенность аллелями (allelic richness) — средняя частота аллелей на особь. | ||||||||
N — доля нулевых гомозигот. | ||||||||
Ht — доля гетерозагот. | ||||||||
H — генетическое разнообразие по Шеннону (1992). |
Ставрополь, Н=2,3 и 2,4, соответственно). Снижение генетического полиморфизма и гетерогенности популяций C.pomonella из России, вероятно, связано с большей пестицидной нагрузкой на фруктовые сады.
Работа выполнена при поддержке РФФИ и администрации Краснодарского края (грант № 09−04−96 514).
Благодарности: автор выражает искреннюю благодарность д.б.н. О. Д. Ниязову (ВНИИБЗР, г. Краснодар), к.б.н. Л. В. Розовой (институт орошаемого садоводства им. М. Ф. Сидоренко, г. Мелитополь), д.б.н. Т. М. Неверовской (Институт защиты растений УАН, г. Киев), д.б.н. И. Я. Гричанову, к.б.н. Е. И. Овсянниковой (ВИЗР, г. Санкт-Петербург) за предоставленный биоматериал.
- 1. Scott, L.J., Lawrence, N., Lange, C.L., et al. Population dynamics and gene flow of Helicoverpa armigera (Lepidoptera: Noctuidae) on cotton and grain crops in the Murrumbidgee Valley, Australia // J. Econ. Entomol. 2006. Vol.99. P.155−163.
- 2. Endersby, N.M., Hoffmann, A.A., McKechnie, S.W., Weeks, A.R. Is There genetic structure in populations of Helicoverpa armigera from Australia? // Entomol. Exp. Appl. 2007. Vol.122. P.253−263.
- 3. Zhou Y., Gu H., Dorn S. Isolation of microsatellite loci in the codling moth, Cydia pomonella (Lepidoptera: Tortricidae) // Molecular Ecology Notes. 2005. Vol.5. P.226−227.
- 4. Franck P., Guйrin F., Loiseau A., Sauphanor B. Isolation and characterization of microsatellite loci in the codling moth Cydia pomonella L. (Lepidoptera, Tortricidae) // Molecular Biology Notes. 2005. Vol.5. N 1. P. 99−102.
- 5. Franck P., Reyes M., Olivares J., Sauphanor B. Genetic architecture in codling moth populations: comparison between microsatellite and insecticide resistance markers // Mol. Ecology. 2007. Vol.16. P. 3554−3564.
- 6. Fuentes-Contreras E., Espinoza J.L., Lavandero B., Ramнrez C. C. Population Genetic Structure of Codling Moth (Lepidoptera: Tortricidae) from Apple Orchards in Central Chile // Journal of Economic Entomology. 2008. Vol.101. N 1. P.190−198.
- 7. Ji Y. J, Wu Y. C, Zhang D.X. Novel polymorphic microsatellite markers developed in the cotton bollworm Helicoverpa armigera (Lepidoptera: Noctuidae) // Insect Science. 2005. V.12. P.331 — 334.
- 8. Ji Y. J., Zhang D. X., Hewitt G. M., Kang L., Li D. M. Polymorphic microsatellite loci for the cotton bollworm Helicoverpa armigera (Lepidoptera: Noctuidae) and some remarks on their isolation. // Molecular Ecology Notes. 2003. Vol. 3. N 1. P. 102−104.
- 9. Scott, K. D, Lange, C. L, Scott, L. J, Graham, G. C. Isolation and characterization of microsatellite loci from Helicoverpa armigera. Hьbner (Lepidoptera: Noctuidae) // Molecular Ecology Notes. 2004. V. 4. P.204−205.
- 10. Tan S, Chen X, Zhang A, Li D. Isolation and characterization of DNA microsatellites from cotton bollworm (Helicoverpa armigera. Hьbner) // Molecular Ecology Notes. 2001. V.1. P.243−244.
- 11. Subramanian S., Mohankumar S. Genetic variability of the bollworm, Helicoverpa armigera, occurring on different host plants // Journal of Insect Science, 2006. Vol.6. P.26, available online: insectscience.org/6.26.
- 12. Киль В. И. Методика оценки ДНК полиморфизма популяций насекомых с помощью ПЦР (RAPDи ISSR-PCR) // Методические рекомендации. «ООО Просвещение-Юг». Краснодар. 2009. 16 с.
- 13. Chalmers, K.J., Waugh J.I., Sprent A.J., Simons A.J., Powell W. Detection of genetic variation between and within populations of Gliricidia sepium and G.maculata using RAPD markers // Heredity. 1992. V.69. P.465−472.