Протеолиз и профессиональные бронхо-лёгочные заболевания

Свое название матриксные металлопротеиназы получили за способность специфически гидролизовать основные белки экстраклеточного матрикса. ММП относятся к семейству цинковых металлопротеиназ, так как содержат в активном центре Zn2+. Известно около 20 представителей этого семейства (таблица1, рис. 4). Большинство ММП секретируется клетками в виде неактивных ферментов, в обычных условиях в тканях… Читать ещё >
Протеолиз и профессиональные бронхо-лёгочные заболевания (реферат, курсовая, диплом, контрольная)
К числу фундаментальных достижений молекулярной биологии последних лет относится осознание протеолиза как особой формы биологической регуляции. Анализ обширного материала показал, что ограниченный протеолиз служит пусковым механизмом многих процессов и обеспечивает быстрый физиологический ответ организма на изменяющиеся условия или поступающий извне сигнал [14,25,32]. Роль протеиназ многообразна и ещё до конца не изучена, но уже сейчас ясно, что эти ферменты вовлечены в регуляцию биологических процессов на разных уровнях: молекулярном, клеточном, органном.
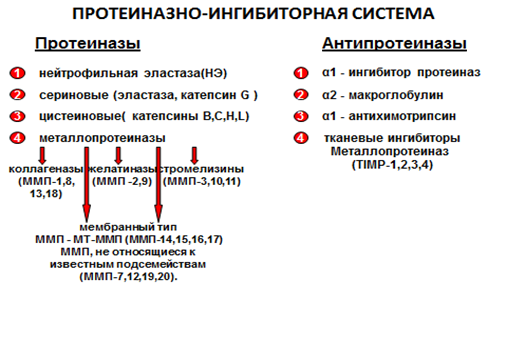
Рис. 1. Компоненты протеиназно-ингибиторной системы
протеолиз ингибиторный фермент молекулярный Регуляторный механизм действия протеолитических ферментов включает два типа реакций. Первый связан с полным расщеплением белковых молекул до аминокислот, которые впоследствии вовлекаются в общий метаболический обмен. Таким же путём происходит и удаление из организма аномальных белков, образующихся в результате мутаций и ошибок биосинтеза. Второй обусловлен реакциями ограниченного протеолиза и заключается в расщеплении одной или нескольких специфических пептидных связей в молекуле белков, что приводит к появлению активных продуктов из их биосинтетических предшественников [16,23,27,40]. Ограниченный протеолиз играет решающую роль в образовании активных форм ферментов и гормонов из неактивных, в синтезе биологически активных пептидов (ангиотензинов, кининов, нейропептидов), имеющих значение в регуляции сосудистого тонуса, артериального давления, деятельности мозга, воспалительных и аллергических реакциях. Защитные функции организма — свертывание крови, фибринолиз, иммунный ответ, осуществляются каскадными реакциями при участии протеиназ с ограниченной специфичностью [17,18,49].
Протеолитические ферменты обладают высокой биологической активностью и представляют потенциальную опасность для большинства белковых структур тканей. Протеиназы макрофагального, лейкоцитарного и бактериального происхождения выделяются клетками во время воспалительных явлений в бронхах и лёгких и могут привести к деструкции коллагеновых и эластиновых структур, способствуя развитию фиброза и эмфиземы [20,21,47].
При физиологических условиях активность этих ферментов подавляется специфическими белками — ингибиторами, которые быстро связывают протеиназы. Образующиеся комплексы протеиназы-ингибиторы выводятся из организма.
Сформулирована протеиназно-антипротеиназная теория, согласно которой деструктивные заболевания лёгких у человека развиваются в результате либо избыточного уровня протеолитических ферментов в очаге поражения, либо недостаточного содержания их ингибиторов, вследствие чего система протеолиза становится декомпенсированной [5,22,50,51,52]. Схема взаимодействия протеолитических ферментов и их ингибиторов представлена на рисунке 2.

Рис. 2. Схема взаимодействия протеолитических ферментов и их ингибиторов
Основное значение в развитии тканевого повреждения имеют фагоцитирующие клетки — нейтрофильные гранулоциты и альвеолярные макрофаги. При воспалении они накапливаются в экссудатах и во время фагоцитоза высвобождают избыточные количества высокоактивных протеиназ, имеющих в основном лизосомальное происхождение. Главную роль в ферментативных процессах играют нейтрофильные гранулоциты, действие же макрофагов ограничивается выделением хемотактических факторов для нейтрофилов, а также стимулированием высвобождения ферментов из их азурофильных гранул [6,9]. Лизосомальные протеиназы большинства клеток представлены ферментами, относящимися к цистеиновым (катепсины В, С, Н, L и некоторые другие) и сериновым (эластаза, катепсин G) пептидгидролазам и матриксным металлопротеиназам [24,42].
Лизосомальные протеиназы участвуют в деструкции тканей двояким образом: непосредственно воздействуя на основные компоненты межклеточного матрикса и путём активации других протеолитических ферментов. Межклеточный матрикс, как известно, представляет собой структурированный комплекс макромолекул, продуцируемых разными клетками. Основными его компонентами всегда являются коллаген, эластин, протеогликаны и гликопротеиды различной природы [12,13,61]. Коллагены, обладающие уникальной первичной и пространственной структурой, являются основными компонентами соединительной ткани. В настоящее время различают 17 типов коллагена. Основную их массу составляют коллагены Й, ЙЙ, ЙЙЙ типов (так называемые фибриллярные коллагены). Они образуют коллагеновые фибриллы и волокна, формируют опорный скелет организма, входят в состав костной и хрящевой ткани, а также в состав мягкой соединительной ткани, создающей «обрамление» и «архитектуру» органа. Коллаген ЙV типа образует своеобразную коллагеновую сеть, которая составляет основу базальных мембран [29,34]. В формировании стенок сосудов и других опорных элементов участвует ещё один белок с уникальной пространственной структурой — эластин, который образует эластиновые волокна [29]. Создающие основной каркас организма и определяющие его механические свойства, коллагеновые белки и эластин характеризуются устойчивостью к действию протеолитических ферментов и метаболической инертностью.
Основное вещество межклеточного матрикса, которое заполняет пространство между волокнистыми структурами, формируют протеогликаны. Они характеризуются высокой метаболической активностью. Полагают, что деструкция соединительной ткани начинается с их деградации [55,56].
Кроме этого в состав основного вещества межклеточного матрикса входят различные гликопротеиды, среди которых белки с адгезивными свойствами — фибронектин и ламинин. Эти белки, обуславливающие межклеточные взаимодействия и контакты клеток с компонентами матрикса, играют важную роль в процессах дифференцировки и трансформации тканей, перемещениях клеток и их внутренней организации [38].
В настоящее время считают, что деструкция соединительнотканного матрикса осуществляется двумя путями: внеклеточным и внутриклеточным. В обоих случаях принимают участие лизосомальные протеиназы [3,4,60]. Процессы внеклеточной и внутриклеточной деградации тесно связаны между собой. Только при их сочетании может произойти полная деструкция соединительнотканного матрикса. Оценить вклад внеклеточной и внутриклеточной деградации в процессе деструкции рассмотренных компонентов соединительной ткани в настоящее время довольно трудно. Это зависит от конкретных условий: тканевого окружения, типов клеток, физиологического состояния, а также от присутствия различных медиаторов. Роль лизосомальных протеиназ в деструкции тканей может быть связана не только с их непосредственным действием на компоненты матрикса, но и с активацией ряда других протеолитических ферментов и вовлечением их в процессы деградации. В этих случаях лизосомные протеиназы, освобождаясь из клеток, катализируют специфические реакции ограниченного протеолиза и выполняют важные регуляторные функции.
Другой путь участия лизосомальных протеиназ в контроле активности протеолитических ферментов демонстрируют данные о том, что катепсины L и H путем ограниченного протеолиза инактивируют б1-ИП [4,15]. Нарушая его баланс с соответствующими протеиназами, в частности, с эластазой гранулоцитов, цистеиновые протеиназы могут быть включены в регуляцию активности ряда сериновых протеиназ.
Основным ферментом, повреждающим эластические структуры бронхолёгочного дерева, является нейтрофильная эластаза [30]. Это доказывается тем, что в эксперименте можно вызвать эмфизему лёгких внутритрахеальным введением животным эластазы нейтрофилов, которая прочно фиксируется тканью лёгких в виде комплекса фермент-субстрат. Длительное существование этих комплексов может приводить к прогрессированию эмфиземы даже после однократного введения фермента. Возможность длительного сохранения эластолитической активности в бронхиальном дереве, также связывают с образованием комплекса б2- макроглобулин-эластаза, который сохраняет некоторую эластолитическую активность и может длительно находится в лёгком [10,34].
Менее изучен вопрос об участии в деструктивном поражении лёгких эластазы альвеолярных макрофагов. Макрофаги содержат две эластазы: одну — со свойствами сериновой протеиназы, другую — со свойствами металлопротеиназы (СаІ+ - зависимой) [24]. Однако остаётся не ясным — является ли первая из них собственным ферментом макрофагов или это эластаза нейтрофилов, фиксированная на специфических рецепторах поверхности макрофагов. Макрофаги синтезируют за 48 часов столько эластазы, сколько нейтрофилы за 1 час. Но макрофагальная эластаза не ингибируется б1-ИП [1,59].
Эластазу способны синтезировать также фибробласты, гладкомышечные клетки, моноциты, тромбоциты, б-клетки поджелудочной железы.
Эластолитическая активность панкреатической эластазы выше, чем нейтрофильной. Доказано, что панкреатическая эластаза связана в железе со своим ингибитором и может быть обнаружена не только в панкреатическом соке, но и в крови, и в подчелюстных слюнных железах. В лёгкие она может попасть не только гематогенно, но и через лимфатические пути брюшины и диафрагмы и вносить свой вклад в деструкцию тканей.
Эластаза способна вызывать деградацию не только эластина, но и нативного коллагена и протеогликанов дыхательных путей, что делает её участником процессов склерозирования [59].
В настоящее время большой интерес представляет изучение семейства матриксных металлопротеиназ. В литературе освещены вопросы участия системы матриксных металлопротеиназ в развитии доброкачественных, злокачественных и хронических заболеваниях легких, таких как ХОБЛ, астма, туберкулез, рак легкого. Однако, роль матриксных металлопротеиназ в патогенезе профессиональной бронхолегочной патологии остается менее изученной.
Свое название матриксные металлопротеиназы получили за способность специфически гидролизовать основные белки экстраклеточного матрикса. ММП относятся к семейству цинковых металлопротеиназ, так как содержат в активном центре Zn2+. Известно около 20 представителей этого семейства (таблица1, рис. 4). Большинство ММП секретируется клетками в виде неактивных ферментов, в обычных условиях в тканях обнаруживаются незначительные количества ММП, при этом их активация приводит к протеолитическому разложению окружающих клетку белков [32]. Активацию большинства ММП осуществляют протеазы типа плазмина и активатора плазминогена урокиназного типа [8,33]. Некоторые ММП могут активизировать друг друга. В норме существует биологический механизм ограничения протеолиза тканей, вызванного активными ММП, в виде секреции клетками стромы тканевых ингибиторов металлопротеаз. Это белки небольшого размера, способные формировать нековалентные комплексы со многими членами семейства матриксных металлопротеаз [35,39,45]. В таблице приведена классификация ММП на основе субстратной специфичности в пять подгрупп, которая является несколько произвольной, так как истинные физиологические субстраты для некоторых ММП в настоящее время до конца не определены. Тем не менее можно выделить группу коллагеназ, гидролизирующих интерстициальные коллагены I, II и III типов и группу желатиназ, гидролизующих коллаген IV типа [46,57]. Представители этих подсемейств инициируют инвазивные процессы, так как базальные мембраны состоят из коллагена IV типа, а экстраклеточный матрикс представлен в основном фибриллярными коллагенами I? III типов. Стромелизины гидролизуют протеогликаны и целый ряд адгезивных белков, мембраносвязанные ММП принимают участие в активации проММП-2 и могут разлагать коллагены [36,65,66]. Группа неклассифицированных ММП наименее изучена, некоторые ее представители могут расщеплять эластин [44,35,53]. Таким образом, ММП способны специфически гидролизовать основные компоненты матрикса: коллагены, желатин, ламинин, протеогликаны и эластин, а также адгезивные и другие белки соединительной ткани [65].
Источниками образования MMPs являются многие клетки, включая: фибробласты, макрофаги, гладкомышечные клетки сосудистой стенки, нейтрофилы [41,43]. Активность ферментов в тканях зависит от уровня экспрессии их генов и от наличия активаторов и ингибиторов. ММП относятся к «индуцируемым» ферментам, транскрипция которых зависит от целого ряда факторов (цитокинов, факторов роста и некроза опухолей, химических агентов и др.). Исключение составляет желатиназа, А (ММП-2), экспрессия которой происходит по конститутивному пути.
Таблица 1 — Семейство матриксных металлопротеаз.
Группа. | № ММП. | Полное название. | Субстрат. |
Коллагеназы. | Интерстициальная коллагеназа. | Коллагены (I, II, III, VII, VIII и X); желатин; аггрекан; протеогликан-связанный белок; б1 -антитрипсин/б1 -протеиназный ингибитор (б1 -АТ); б1 -антихимотрип син, ассоциированный с беременностью б2 макроглобулин (б2 М); MBP; L-селектин; IL-1в; сывороточный амилоид А; IGF-BP5; IGF-BP3; MMP-2; -9. | |
Нейтрофильная коллагеназа. | Коллаген I, II, III, VII, X типов. | ||
Коллагеназа 3. | Коллаген I, II, III, VII, X типов. | ||
Желатиназы. | Желатиназа А. | Коллагеназа IV типа Коллаген I, IV, V, X типов, желатин, ламинин V. | |
Желатиназа В. | Коллаген I, IV, V, X типов, желатин. | ||
Стромелизин 1. | Желатин, ламинин, проММП-1, протеогликаны, коллаген III, IV, V, IX, X типов? десмоплакин? Е-кадхерин? | ||
Стромелизин 2. | Желатин, проММП-1, ламинин, протеогликаны, коллаген III, IV, V, IX, X типов? | ||
Стромелизины. | Стромелизин 3. | Ь1-антипротеаза? | |
МТ1-ММП. | ПроММП-2, желатин, коллагены. | ||
МТ2-ММП. | ПроММП-2. | ||
МТ3-ММП. | ПроММП-2. | ||
Мембраносвязанные матриксные металлопротеазы. | МТ4-ММП. | ||
Матрилизин. | Желатин, проММП-1, фибронектин, эластин. | ||
Металлоэластаза. | Коллаген IV; желатин; эластин; и k-эластин; казеин; б1 -АТ; фибронектин; витронектин; ламинин; протеогликан мономер; GST-TNF; MBP; фибриноген; фибрин; плазминоген. | ||
18/19. | RASI-1. | ||
Неклассифицированные матриксные металлопротеазы. | Енамелизин. | Амелогенин. |
Фибриллярный интерстициальный коллаген типа I и III составляет более 90% коллагена в паренхиме легкого. MMP-1, -8 и -13 могут катализировать начальный этап их деградации [48]. Таким образом, изменение уровней или активности MMPs может играть существенную роль в изменении метаболизма коллагена.
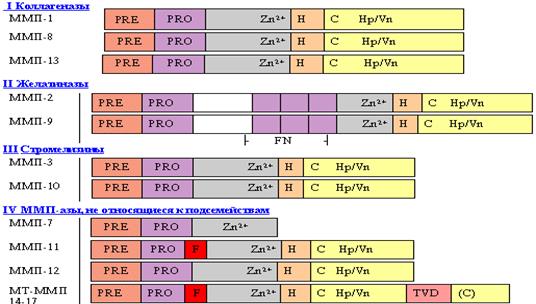
Рис. 3 Строение белков семейства матриксных металлопротеиназ
Активность протеиназ регулируется несколькими путями: пространственной разобщенностью фермента и субстрата, синтезом большинства протеолитических ферментов в форме неактивных предшествеников. К важнейшим физиологическим регуляторам протеолиза относятся также специфические белки — ингибиторы, содержащиеся в крови и тканях, которые связывают протеолитические ферменты, лишая их полностью или частично каталитической активности. После альбуминов и иммуноглобулинов они представляют по количеству (10% от общего уровня) третью группу функционально активных белков. Сейчас известно 6 хорошо охарактеризованных белков, полностью или частично угнетающих активность различных протеиназ: б1-ингибитор протеиназ, б2-макроглобулин (б2-МГ), антитромбин III, ингибитор I компонента комплемента, интер-б-ингибитор химотрипсина, ингибитор активации плазминогена.
Механизм регуляции протеолиза ингибиторами позволяет организму в нужное время быстро купировать протеолитические реакции и, таким образом, приостанавливать или замедлять развитие того или иного биологического процесса.
Наиболее универсальными ингибиторами, обладающими широким спектром действия, являются б1-ИП и б2-МГ.
б1-ИП является доминирующим антипротеолитическим ферментом в организме. Интерес медиков к этому белку резко возрос после обнаружения тесной связи наследственного дефицита б1-ИП с некоторыми формами патологии человека, в первую очередь, с эмфиземой лёгких и ювенильным циррозом печени [27,62].
По химическому составу это гликопротеид, выделенный из б1-глобулиновой фракции сыворотки крови. б1-ИП составляет 75% этой фракции и содержит 12,5% углеводов (галактозу, маннозу, Н-ацетилглюкозамин, сиаловую кислоту). В него входит 1 полипептидная цепь из 394 аминокислотных остатков, к которой присоединены 3 боковые углеводные цепи. Молекулярная масса белка варьирует в пределах 54 000 — 58 000 Д. Считается, что ингибирующий эффект б1-ИП связан с его сравнительно низкой молекулярной массой и способностью образовывать комплексы с протеиназами во внеклеточном пространстве. Эти комплексы выходятся в кровь и там взаимодействуют с б2-МГ, образуя новые соединения, которые затем катаболизируются в [26].
Кроме этого б1-ИП является белком острой фазы воспаления, концентрация которого повышается в сыворотке крови в ответ на активацию протеолитических ферментов.
б1-ИП обладает широким спектром действия, так как ингибирует многие протеазы, однако наибольшую активность он проявляет в отношении эластазы — фермента полиморфно-ядерных лейкоцитов [31]. Функциональная роль б1-ИП заключается в ингибировании коллагеназы и эластазы, освобождающихся при разрушении гранулоцитов, и, следовательно, в торможении тканевого протеолиза. Кроме того, б1-ИП инактивирует тромбин, калликреин и тормозит эстеразную и протеолитическую активность по крайне мере двух компонентов фибринолитической системы — плазмина и кофактора Хагемана и, таким образом, принимает участие в регуляции процессов свертывания крови, калликреин-кининовых реакций и фибринолиза. Показана роль б1-ИП в ингибировании биосинтеза ДНК в лимфоцитах человека; предполагается, что б1-ИП оказывает регуляторное воздействие на синтез ДНК in vitro.
Синтез б1-ИП контролируется единичным локусом PI (protease inhibitor), картированным на 14 хромосоме. Экспрессия (степень выраженности) гена проявляется в виде аллелей и фенотипических вариантов белка, выявляемых современными методами изоэлектрического фокусирования.
Аллели локуса PI кодоминантны, т. е. у людей, гетерозиготных по PI-локусу, синтезируется одновременно 2 различных варианта б1-ИП. Хотя в настоящее время известно более 75 аллелей PI-локуса, основную долю генофонда составляют подтипы аллеля М (М1,М2,М3) [28]. Среди них особый интерес представляют аллели Z и S, относящиеся к группе так называемых дефицитных аллелей. Содержание б1-ИП и соответственно антипротеазной активности сыворотки людей с генотипами ZZ, ZS, SS существенно снижены и составляют 15, 35 и 60% от активности при основном варианте ММ. Всё выше сказанное указывает на актуальность систематического обследования новорожденных на предмет выявления дефицита б1-ИП. При врождённом дефиците описаны случаи ювенильного цирроза печени, гломерулонефрита, гепатоклеточной карциномы, постнекротического цирроза. У 60% лиц с генотипом PI ZZ (резкий дефицит б1-ИП) развивается эмфизема лёгких. Развитие эмфиземы обусловлено тем, что при недостатке ингибитора, способного блокировать лейкоцитарные протеиназы, возникает интенсивный протеолиз лёгочной ткани, ведущий к разрушению стенок альвеол. При нерезком дефиците б1-ИП (генотипы PI MZ и PI MS), выявлена предрасположенность к атопической астме [7].
Недостаточность 1-ИП является одним из наиболее распространённых моногенных аутосомно-рецессивных наследственных заболеваний. Чаще всего количественная недостаточность белка ассоциирована с гипосекреторными мутациями гена 1-ИП (Z и S аллелями), которые представляют собой точковые замены с изменениями результирующего заряда белка, нарушениями его транспорта из эндоплазматического ретикулума в аппарат Гольджи и формированием в ходе транспорта специфической трёхмерной структуры. Реже встречаются нулевые аллели гена 1-ИП с нонсенс-мутациями и сдвигами рамки считывания.
В органах дыхания присутствуют две группы ингибиторов. Первая группа — лабильные ингибиторы, быстро инактивирующиеся при повышенной температуре и низких значениях pH. Эти ингибиторы (б1-ИП, б2-МГ, б1-антихимотрипсин) поступают в бронхиальный секрет вследствие транссудации из плазмы крови, а также местного биосинтеза или секреции лимфоцитами и макрофагами.
Роль лабильных ингибиторов гранулоцитов в верхних дыхательных путях, а также в бронхах крупного и среднего калибра ограничена. Они ответственны за 15−20% антипротеолитической активности бронхиального секрета. Однако в нижних отделах, на уровне альвеол б1-ИП приобретает значение главной антилейкопротеиназы, предотвращающей развитие эмфиземы. Но большая часть б1-ИП присутствует в бронхиальном секрете (особенно в гнойных образцах) человека в неактивной (частично протеолизированной или окисленной) форме, что может явиться следствием комплексообразования с протеиназами гранулоцитов или макрофагов [11].
Инактивация б1-ИП может наступить также вследствие окисления двух остатков метионина под действием миелопероксидазы гранулоцитов. Окислительная инактивация б1-ИП, по мнению некоторых авторов, может возрастать под влиянием сигаретного дыма, который усиливает хемотаксис гранулоцитов и макрофагов — потенциальных носителей окислителей. Ингибитор в окисленной форме не может тормозить эластолитическую активность, но сохраняет трипсинингибирующее действие.
Вторая группа ингибиторов — кислотостабильные ингибиторы (КСИ), которые синтезируются как местно серозными клетками подслизистых желез трахеи, крупных и средних бронхов, так и поступают из плазмы крови.
В норме в дыхательных путях существует динамическое равновесие между активностью протеиназ и их ингибиторов. У больных деструктивными заболеваниями лёгких и бронхов в процессе воспаления резко нарастает потенциал протеолитических ферментов вследствие усиления инфильтрации тканей нейтрофильными гранулоцитами, а также повышается их секреции под влиянием чужеродных веществ. Предполагают, что первой защитной реакцией организма на появление в просвете бронхов активных протеолитических ферментов является транссудация плазменных ингибиторов. Этого механизма защиты при умеренной выраженности процесса оказывается достаточно. На второй стадии, когда плазменные ингибиторы не справляются с подавлением протеиназной активности, слизистая начинает в повышенных количествах секретировать КСИ. Однако этот механизм лабилен и быстро истощается.
Основными ингибиторами матриксных металлопротеиназ являются их тканевые ингибиторы (TIMP-1,2,3,4), которые, блокируя активность этих ферментов, участвуют в регуляции тканевых перестроек [2,63].
Таким образом, при бронхолёгочной патологии происходит не только активация протеолиза, но и снижение ингибиторного потенциала, что приводит к декомпенсации протеиназно-ингибиторной системы. Уменьшение ингибиторного потенциала может быть связано и с генетически обусловленным дефицитом б1-ИП. У лиц с наследственной недостаточностью этого ингибитора выявлена предрасположенность к развитию тяжёлой эмфиземы лёгких в молодом возрасте. Наличие генетически обусловленного дефицита б1-ИП и работа на пылеопасных производствах повышают риск развития бронхолёгочной патологии.
Нами были проанализированы все имеющиеся методы генотипирования альфа-1-ингибитора протеиназ, изоэлектрофокусирование в полиакриламидном геле, определение мутаций гена альфа-1ингибитора протеиназ методом полимеразной цепной реакции с последующим рестриктазным расщеплением.
Был проведен литературный поиск данных о нуклеотидной последовательности гена, кодирующего альфа-1ингибитор протеиназ и об аминокислотной последовательности белка — продукта данного гена, затем подобраны праймеры, отработаны условия амплификации и разработана тест-система на выявление наиболее распространенных мутаций в Z и S аллелях с точковыми аминокислотными заменами методом полимеразной цепной реакции (Патент на изобретение № 2 218 094 от 02.04.2002 Способ определения риска развития фиброзных изменений в легких и в печени). Данная тест-система внедрена в клинике НИИ медицины труда РАМН.
Электрофореграмма продуктов ПЦР представлена на рисунке 4. Схема расположения в гене альфа-1 ингибитора протеиназ нуклеотидных замен, приводящих к S и Z мутациям представлена на рисунке 5.
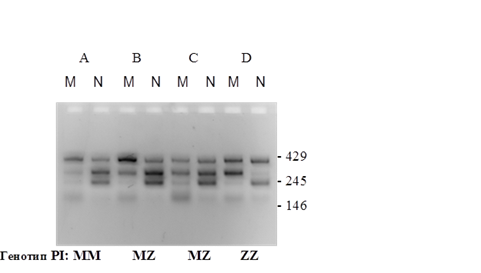
Рис. 4. Электрофореграмма продуктов ПЦР при определении S и Z мутаций у четырех пациентов А, В, С и D. Во всех случаях дорожка М соответствует анализу мутации, дорожка N — анализу нормы. Цифры справа указывают длину продуктов в н.п. Сигнал маркерного гена виден как фрагмент длиной 429 н.п., сигналы по точке Z — 245 н.п., сигналы по точке S — 146 н.п.

Рис. 5. Схема расположения в гене 1-ИП нуклеотидных замен, приводящих к S и Z мутациям, и праймеров (обозначены стрелками) для их выявления методом аллель-специфичной ПЦР.
Предполагается, что варианты РI*S и РI*Z содержат меньшее количество сиаловой кислоты, чем варианты РI*М (нормальный аллель, при котором активность ингибитора принята за 100%). С другой стороны, показано, что недостаток сиаловой кислоты в молекуле тормозит его секрецию гепатоцитами и ускоряет выведение из плазмы. Эти структурные особенности обусловливают разный уровень альфа-1-ингибитора протеиназ в сыворотке крови лиц с различными фенотипами.
Тест-система для обнаружения мутаций гена a1-ИП имеет ряд преимуществ. Применение метода ДНК-диагностики (аллель-специфичной ПЦР) позволяет проводить доклиническую диагностику. Он обладает высокой чувствительностью и специфичностью, автоматизацией исполнения. Однократность проведения теста у обследуемых, возможность проведения скрининга позволяют рекомендовать его для широкого практического применения в медицине труда при проведении предварительных и периодических медицинских осмотров.
Для определения полиморфизма гена матриксной металлопротеиназы-1(ММП-1) был применен метод пиросеквенирования, разработанный совместно с лабораторией постгеномных технологий НИИ МТ РАМН (зав лаборатории постгеномных технологий, академик РАМН В.В. Покровский). Ген ММП-1 расположен в 11-й паре хромосом. Был определен характер полиморфизма инсерций/делеций гуанина (1607delG) в промоторном участке гена ММР-1. Наличие инсерции/делеции влияет на уровень транскрипции гена, обуславливая повышенный синтез профермента и как следствие — повышение активности матриксной металлопротеиназы-1(ММП-1), избыток которой способствует деструкции компонентов соединительной ткани. При этом гомозиготный вариант с делецией гуанина (-/-) 2G имеет более высокую транскрипционную активность, чем промотор с гетерозиготным аллельным вариантом гена, имеющий инсерцию гуанина (G/-) 1G в промоторной области. При этом отсутствие инсерций/делеций гуанина определяет нормальный уровень синтеза и активности фермента (рис. 6,7,8).

Рис. 6. Программа с вариантом гомозиготного генотипа по определяемому аллельному варианту не имеющему инсерций/делеций гуанина в нуклеотидной последовательности — соответствует норме
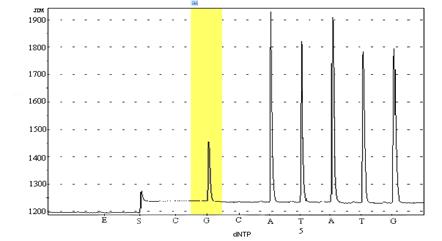
Рис. 7. Программа с вариантом гетерозиготного генотипа по определяемому аллельному варианту, имеющему инсерцию гуанина 1G
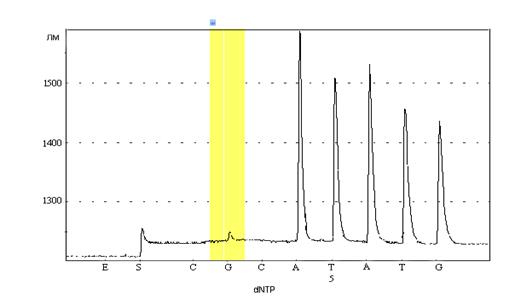
Рис. 8. Программа с вариантом гомозиготного генотипа по определяемому аллельному варианту, имеющему делецию гуанина в исследуемой области гена 2G
Используемый в основе метода принцип пиросеквенирующего синтеза обеспечивает надежность и точность полученных результатов, высокую пропускную способность, максимальную автоматизированность процесса, быстроту проведения анализа [37]. Пиросеквенирование является новым поколением методик секвенирования, нашедшее свое применение, как в фундаментальных исследованиях, так и в диагностических целях [64]. Эта методика позволяет анализировать большой объем клинического материала, не теряя при этом точности результатов. Метод не требует применения электрофоретической детекции продуктов амплификации, широко использующейся в области молекулярной диагностики [54]. Разработана тест-система на выявление полиморфных гиперсекреторных вариантов гена ММП-1, которая позволит определять индивидуальный риск развития заболеваний органов дыхания у здоровых лиц, поступающих на пылеопасные производства, проводить необходимые профилактические и реабилитационные мероприятия.
Таким образом, биохимическую диагностику целесообразно дополнять молекулярно-генетической, которая, обладая более широкими возможностями, одновременно является и более экономичной. Следует подчеркнуть, что указанные выше методы исследования являются необходимыми для выявления индивидуального риска развития бронхолёгочной патологии не только в клинике медицины труда, но активно используются в общей пульмонологии и в педиатрии.