Материалы и методы исследования

Специальные преобразователи аппарата Витафон-ИК устанавливали в области печени: вначале на правую область F, затем ее проекцию на переднюю поверхность грудной клетки — область М4. Применяли высокоинтенсивный режим — № 4. Продолжительность воздействия увеличивалась от 5 до 20 мин на каждую поверхность тела (при отсутствии у больного неприятных ощущений в области печени). Процедуры проводили 1 раз… Читать ещё >
Материалы и методы исследования (реферат, курсовая, диплом, контрольная)
Серологические методы исследования В основе всех серологических реакций лежит взаимодействие антигена и антитела. Метод обнаружения с диагностической целью антител в сыворотке крови обследуемого.
В этом случае из двух компонентов реакции (антитело, антиген) неизвестным является сыворотка крови, так как постановка реакции проводится с заведомо известными антигенами. Положительный результат реакции свидетельствует о наличии в крови антител, соответствующих применяемому антигену; отрицательный результат указывает на отсутствие таковых.
Достоверные результаты получают при исследовании «парных» сывороток крови больного, взятой вначале заболевания (3−7 день) и через 10−12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и более повышение титра антител во второй сыворотке имеет диагностическое значение.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (JgM и JgG), что существенным образом повысило информативность серологических методов диагностики.
При первичном иммунном ответе, когда иммунная система человека взаимодействует с инфекционным агентом в первый раз, синтезируются преимущественно антитела, относящиеся к иммуноглобулинам класса М (JgM). Лишь позднее, на 8−12-й день после попадания антигена в организм, в крови начинают накапливаться антитела иммуноглобулинов класса G (JgG). При иммунном ответе на инфекционные агенты вырабатываются также и антитела класса, А (JgA), которые играют важную роль в защите от инфекционных агентов кожи и слизистых оболочек [8, 15].
Метод полимеразной цепной реакции (ПЦР) Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеинов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется.
Для диагностики достаточно одной молекулы ДНК, т. е. одной бактерии или вирусной частицы.
Введение
в реакцию дополнительного этапа — синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы — позволило тестировать РНК-вирусы, например вирус гепатита С.
ПЦР — это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
Преимущество ПЦР в диагностике инфекционных заболеваний перед другими методами исследований заключается в следующем:
возбудитель инфекции может быть обнаружен в любой биологической среде организма, в том числе и в материале, получаемом при биопсии;
возможна диагностика инфекционных болезней на самых разных стадиях заболевания;
возможность количественной оценки результатов исследований (сколько вирусов или бактерий содержится в исследуемом материале);
высокая чувствительность метода.
Показаниями к лечению хронического ВГС интерфероном-альфа являются:
повышение уровня трансаминаз;
наличие РНК ВГС в крови;
генотип 1 ВГС;
высокий уровень виремии в крови;
гистологические изменения в печени: фиброз, умеренные или выраженные воспалительные явления.
При лечении интерфероном-альфа больных вирусным гепатитом С с субтипом 1b эффективность терапии отмечается в среднем в 18% случаев, у инфицированных другими субтипами — в 55%. Использование комбинированной схемы лечения (интерферон-альфа + рибавирин) повышает эффективность терапии. Стойкий ответ наблюдается у 28% больных с субтипом 1b и у 66% - с другими субтипами ВГС.
Увеличение интерферона Немедикаментозный метод повышения интерферона в 5−8 раз.
Организм больных хроническим гепатитом не реагирует адекватно на внедрение инфекционного патогена.
Как видно из представленных ниже графиков 1 и 2, инфекционный процесс у больных хроническими гепатитами В и С не сопровождается повышением сывороточных концентраций интерферонов-б и г (данные нулевого дня). То есть при развитии хронических вирусных гепатитов В и С организм не реагирует адекватно на внедрение инфекционного патогена. Поэтому для лечения хронических гепатитов обычно применяют интерфероновые препараты.
Активация выработки собственного интерферона методом фонирования Обследовано 16 больных (9 женщин и 7 мужчин, 18−34 лет), из них 8 — с хроническим вирусным гепатитом В в стадии репликации и 8 — с хроническим гепатитом С в фазе реактивации. Длительность заболевания составляла — от 1 до 5 лет. Больные до обследования не лечились противовирусными препаратами. Для активации интерферона использовался метод фонирования. Это свое рода массаж на клеточном уровне.
Специальные преобразователи аппарата Витафон-ИК устанавливали в области печени: вначале на правую область F, затем ее проекцию на переднюю поверхность грудной клетки — область М4. Применяли высокоинтенсивный режим — № 4. Продолжительность воздействия увеличивалась от 5 до 20 мин на каждую поверхность тела (при отсутствии у больного неприятных ощущений в области печени). Процедуры проводили 1 раз в сутки через четыре дня на пятый в течение 4 недель. Забор крови на исследования осуществляли через 1 час и 3 суток после процедуры. Концентрацию интерферонов в сыворотке крови определяли иммуноферментным методом с помощью тест-систем НПО «Протеиновый контур» (Санкт-Петербург). Одновременно оценивали степень выраженности цитолитического синдрома посредством определения активности аланинаминотрансферазы (АлАТ) в сыворотке крови больных на биохимическом анализаторе «Spectrum».
Результаты проведенных исследований концентрации интерферонов б и г, и активности аланинаминотрансферазы (АлАТ) в сыворотке крови больных хроническими вирусными гепатитами В и С на фоне воздействия аппаратом «Витафон-ИК» представлены на графиках 1 и 2, 3.
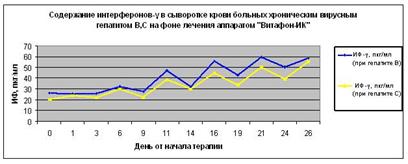
Рисунок 6. Содержание интерферонов г в сыворотке крови больных хроническим вирусным гепатитом В и С на фоне лечения аппаратом «Витафон-ИК».
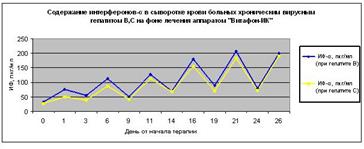
Рисунок 7. Содержание интерфероновб в сыворотке крови больных хроническим вирусным гепатитом В и С на фоне лечения аппаратом «Витафон-ИК».
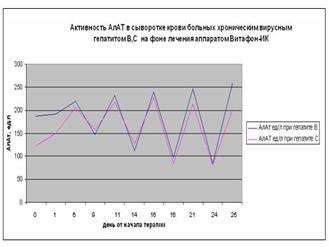
Рисунок 8. Активность аланинаминотрансферазы (АлАТ) в сыворотке крови больных хроническим вирусным гепатитом В и С на фоне лечения аппаратом «Витафон-ИК.