Хирургическое лечение пг и оперативные методы остановки кровотечения из варикозно расширенных вен пищевода

Главным недостатком портокавальных анастомозов является то, что они резко нарушают воротное кровообращение печени вплоть до его полного прекращения. Общий печеночный кровоток может снижаться до 40%-50% от исходного уровня. Причем, при анастомозе по типу «бок в бок» данный показатель снижается за счет ретроградного кровотока. Меньше нарушают печеночный кровоток мезентерикокавальные анастомозы… Читать ещё >
Хирургическое лечение пг и оперативные методы остановки кровотечения из варикозно расширенных вен пищевода (реферат, курсовая, диплом, контрольная)
При всем разнообразии оперативных вмешательств и методик, применяющихся для лечения ПГ, большинство авторов считает возможным разделить их на следующие основные группы.
- 1.Операции, направленные на снижение давления в портальной системе и создание новых путей оттока крови: портокавальные, мезентерикокавальные, спленоренальные, рекс-шунт и другие типы сосудистых анастомозов, различные варианты органопексий.
- 2. Операции, направленные на прекращение кровотока по ВРВП: операции разобщения и деваскуляризации.
- 3. Операции, направленные на улучшение печеночного кровотока и регенерацию печени: резекция печени, периартериальная неврэктомия общей печеночной артерии, артериальные анастомозы.
- 4. Операции, направленные на отведение асцитической жидкости из брюшной полости: лапароцентез, дренирование брюшной полости, дренирование грудного лимфатического протока, перитонеально-венозное шунтирование и другие.
- 5. Трансплантация печени.
В настоящее время практически оставлены, применяемые ранее различные способы органопексии. Одни из этих методов — оментогепатопексия, гастрогепатопексия, колоногепатопексия были рассчитаны на формирование анастамозов между сосудами воротной вены и печеночными венами при внепеченочной форме ПГ. Другие — гепатопневмопексия и спленопневмопексия, состоящие в перемещении части печени или селезенки в плевральную полость, рекомендовали для хирургического лечения декомпенсированного цирроза печени, осложненного асцитом и синдрома Бадда-Киари у взрослых. Данные операции довольно травматичны и, как показали последующие наблюдения, малоэффективны, поскольку достаточная сеть сосудистых анастомозов у этих детей не формируется.
Ведущими методами хирургического лечения ПГ, в настоящее время являются, различного вида шунтирующие операции. Эти операции не используются для экстренной остановки кровотечений, однако, могут эффективно снизить портальное давление и вероятность развития варикозных вен пищевода. Главными недостатками являются 1) печеночная энцефалопатия, вследствие отведения не прошедшей через печень крови из системы воротной вены в систему общей циркуляции и 2) возможное поражение печени из-за уменьшения или даже полного прекращения портального кровотока в печени. Шунтирующие операции нельзя применять у больных, которые являются кандидатами на пересадку печени. Кроме того, примерно у 30−50% детей эти операции нельзя выполнить из-за анатомических особенностей растущего организма или распространении тромбоза на селезеночную и верхнюю брыжеечную вены.
Для успешного шунтирования следует соблюдать несколько условий: 1) используемые вены должны быть без флебита; 2) шунт должен быть достаточного диаметра для декомпрессии системы воротной вены; 3) шунт должен расти вместе с ребенком, для чего используют отдельные узловые швы; 4) должна дренироваться вся системы воротной вены.
В настоящее время наиболее патогенетически обоснованной и радикальной операцией является рекс-шунт (королевский шунт), предложенный V. deGoyet (1998). Операция позволяет, в какой-то мере восстановить портальный печеночный кровоток. Она заключается в наложении шунта из аутовены между верхней брыжеечной и левой печеночной венами (Рис 1). Однако такой шунт можно наложить только у 10% больных внепеченочной формой ПГ, поскольку у большинства детей тромбоз воротной вены распространяется и на ее вены.
Довольно часто у детей применяются портокавальные анастомозы (конец-в-бок и бок-в-бок) или мезентерикокавальные (конец-в-бок или с использованием Н-шунта) Рис 2.
Главным недостатком портокавальных анастомозов является то, что они резко нарушают воротное кровообращение печени вплоть до его полного прекращения. Общий печеночный кровоток может снижаться до 40%-50% от исходного уровня. Причем, при анастомозе по типу «бок в бок» данный показатель снижается за счет ретроградного кровотока. Меньше нарушают печеночный кровоток мезентерикокавальные анастомозы. Перевязка нижней полой вены при мезентерикокавальном анастомозе конец-в-бок обычно хорошо переносится детьми. Однако, примерно у 10% взрослых отмечаются отеки нижних конечностей. Использование «H"-образных шунтов, в какой-то мере, позволяет преодолеть анатомические сложности при создании сосудистых анастомозов. Для этого целей можно использовать сосудистые протезы, однако, практически все они тромбируются в течение 2-х лет после операции. Более физиологично использовать в качестве трансплантата для «H" — образных анастомозов аутовены.
Для декомпрессии портальной системы при плановых операциях наиболее часто применяют центральные и дистальные спленоренальные анастомозы. Эти операции меньше нарушают общий печеночный кровоток У детей чаще всего используют центральный спленоренальный анастомоз «конец в бок». Это вмешательство особенно целесообразно при одновременном наличии показаний к спленэктомии, прежде всего вследствие гиперспленизма. Для выполнения анастомоза по типу «конец в бок» селезеночная вена должна быть длиной не менее 4−6 см. Выделение такого протяженного по длине участка вены сопряжено с определенными техническими трудностями и вероятностью травмы поджелудочной железы. Это может привести к развитию панкреатита в послеоперационном периоде. Менее травматично наложение спленоренального анастомоза по типу «бок в бок». Однако применение этой операции ограничивается техническими возможностями. У некоторых больных ПГ сосудистые анастомозы нельзя наложить по анатомическим причинам. По данным ряда авторов неудачи при наложении спленоренального анастомоза могут достигать 50%.
При выполнении центральных спленоренальных шунтов могут быть получены удовлетворительные результаты, однако летальность после таких вмешательств колеблется от 10% до 35%, энцефалопатия развивается у 3,5% - 28% больных, а рецидивы кровотечений отмечаются у 10% - 27% больных. Причинами рецидивов кровотечений являются тромбоз анастомоза и недостаточная декомпрессия.
В 19 г. W. Warren е.а., разработали операцию селективного шунтирования — дистальный спленоренальный анастомоз. Эта операция направлена на селективную декомпрессию селезенки, вен желудка и пищевода, при сохранении портального кровотока. Операция довольно широко применяется у взрослых. Однако данных об ее эффективности при ВПГ у детей в литературе недостаточно.
Главное преимущество дистального спленоренального анастомоза — это селективная декомпрессия пищеводно-желудочного бассейна портальной системы с сохранением притока мезентериальной крови к печени. При дистальном спленоренальном анастомозе энцефалопатия развивается в 4,5% наблюдений, однако послеоперационная летальность достигает 16%-25%, а рецидивы кровотечений наблюдаются в 13%-18% случаев.
Рассматривая сосудистые портокавальные анастомозы как метод борьбы с кровотечениями из ВРВП и желудка, следует отметить, что практически все они являются паллиативными и не решают проблему портальной гипертензии в целом. Эти операции могут быть выполнены ограниченному числу больных, а большое число неудовлетворительных результатов диктует необходимость поиска других методов.
Операции портосистемного разобщения направлены на снижение кровотока по портокавальным коллатералям в системе вен пищевода и желудка. В соответствии с видом основного оперативного приема различают операции пересечения и реанастомоза (транссекции) и деваскуляризации (деконгестии) пищевода или желудка. Этих операций много. Они могут выполняться из абдоминального, торакального и комбинированного доступов.
В 1950 г. Н. С. Таннер предложил две оперативные методики по лечению ВРВП: 1) поперечное пересечение и сшивание желудка в субкардиальном отделе; 2) пересечение с последующим сшиванием пищевода в наддиафрагмальном сегменте. Эти операции дают возможность разъединить венозные сети желудка и пищевода. Однако они не получили широкого применения из-за значительной травматичности и частой несостоятельности швов пищевода и развития перитонита или эмпиемы плевры.
В нашей стране получила распространение операция, разработанная М. Д. Пациорой (1974). Сущность ее состоит в прошивании и перевязке отдельными лигатурами кровоточащих и варикозных вен кардиального отдела желудка и пищевода со стороны слизистой оболочки, перевязке венечной вены желудка и левой желудочной артерии, иногда в комбинации со спленэктомией. Операцию выполняют из абдоминального доступа, она мало травматична, технически проста. Существенным недостатком данной методики является неполное разобщение интрамуральных вен желудка и пищевода. Мелкие вены гастроэзофагеальной сети анастомозов при этом остаются неперевязанными, сброс крови по ним продолжается и даже увеличивается, то есть сохраняются условия для рецидива варикозного расширения вен и пищеводных кровотечений.
Полное разъединение интрамуральных венозных сетей пищевода и желудка достигается при трансторакальной субмукозной транссекции пищевода по Walker (). Однако, и эта операция нередко дает рецидивы и осложнения.
М. Sugiura и S. Futagawa (1973), предложили операцию порто-системного разобщения для лечения СПГ у взрослых, которая сочетала в себе преимущества операций деваскуляризации и транссекции пищевода. Классическую операцию Sugiura выполняют в два этапа. На первом этапе производят торакатомию слева и перевязывают все коммуникантные ветви, идущие от расширенных венозных коллатералей, формирующих сплетение вокруг пищевода, сохраняя стволы блуждающего нерва и собственно параэзофагеальные коллатерали интактными. Затем пищевод пересекают на уровне диафрагмы и накладывают анастомоз «конец-в-конец». Второй этап выполняют из абдоминального доступа. Производят спленэктомию, полную деваскуляризацию абдоминальной части пищевода и кардиальной части желудка, ваготомию и пилоропластику. Операция Sugiura позволяет ликвидировать явления гиперспленизма; разобщить венозную систему пищевода и желудка с параэзофагеальными коллатералями; снизить объем интрамурального кровотока пищевода; сохранить параэзофагеальные коллатерали в качестве естественных шунтов.
В последующем, с целью упрощения операции, было предложено использовать механическое сшивающее устройство для наложения эзофагоанастомоза, накладывать циркулярный гемостатический шов через все слои стенки желудка, вместо пересечения пищевода, производить проксимальную селективную ваготомию, использовать фундопликацию по Toupet для профилактики несостоятельности анастомоза и предотвращения ГЭР. Наиболее частыми осложнениями после операции Sugiura являются транзиторная дисфагия, стеноз пищевода (2,5%-4%), несостоятельность анастомоза (6%-7%). Рефлюкс у оперированных больных развивается редко (4%) .
В нашей клинике используются следующие операции разобщения: лигирование на протезе, транссекция и транспозиция (реимплантация) пищевода, обычно в сочетании с деваскуляризацией.
Наиболее простой в исполнении и достаточно эффективной является операция лигирования брюшного отдела пищевода на протезе. При необходимости ее можно сочетать с деваскуляризацией желудка и спленэктомией. Эта операция может выполняться для экстренной остановки пищеводных кровотечений, когда другие методы безуспешны.
Протез изготовлен из фторопласта, представляет собой короткую трубку длиной от 2,5 до 4 см с наружным диаметром от 1,5 до 2 см. Диаметр протеза должен в 1,5 раза превышать диаметр пищевода для профилактики его рубцового сужения. Протез сборный, состоит из четырех сегментов. На протезе имеются два неглубоких желобка, в которых завязывают две тонкие кетгутовые нити, фиксирующие протез в собранном виде. Протез распадается на составные части после рассасывания лигатур.
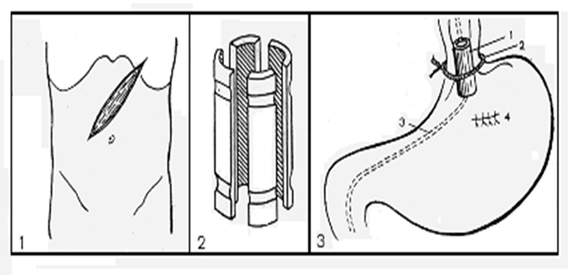
Схема операции лигирования пищевода на протезе Лапаратомия косым доступом с обнажением реберной дуги слева. 2. Сборный протез. 3. Схема операции: 1)-протез; 2)-завязанная на пищеводе кетгутовая лигатура; 3)-дуоденальный зонд, проведенный через носовой ход; 4) — швы на месте гастротомии Операция осуществляется следующим образом. Лапаротомия. Мобилизуют брюшной отдел пищевода. При необходимости перевязывают сосуды верхних отделов желудка и выполняют спленэктомию. Через канал позади пищевода проводят кетгутовую нить № 6. Выполняют гастротомию на передней стенке вблизи кардии. В рану выводят конец дуоденального зонда, проведенного через носовой ход. На зонд насаживают протез в собранном виде и устанавливают его в абдоминальном отделе пищевода. Заранее проведенная кетгутовая нить максимально туго завязывается на пищеводе. Зонд проводят из желудка, через двенадцатиперстную, в начальный отдел тонкой кишки, отверстие в желудке ушивают. Зону «лигирования» пищевода укрывают рядом узловых серозно-мышечных швов (рис. 4.3). В случае деваскуляризации (мобилизации) верхних отделов желудка считаем обязательным выполнение фундопликации по Ниссену. В этом случае можно не накладывать серозно-мышечные швы на пищевод. В послеоперационном периоде кетгутовые нити, удерживающие трубку в собранном виде, постепенно рассасываются, протез «рассыпается» на составные части и отходит по кишечнику на 18−20 день после операции.
Более радикальной, по нашим данным, является операция транспозиции (реимплантации) пищевода. Ключевым этапом, давшим общее название операции, является наложение нового соустья между пищеводом и желудком. Накладывая анастомоз пищевод со стенкой желудка в области дна, а не реанастомозируя его в зоне пересечения, мы перемещаем пищевод в зону наименьшей концентрации варикозно измененных вен (рис. 5). Показанием к операции являются декомпенсированная стадия ПГ, когда нельзя выполнить шунтирование. Это вмешательство показано при неэффективности проведенных раннее операций, спленэктомии и других, когда сохраняются ВРВП и эпизоды кровотечений.
Операция осуществляется через лапаротомный доступ. Выполняют спленэктомию, мобилизуют абдоминальный отдел пищевода и проксимальную половину желудка с перевязкой левой желудочной артерии. Производят отсечение пищевода от желудка после прошивания его аппаратом УКЛ-40 или 60 несколько ниже гастроэзофагеального соустья. Аппаратный шов со стороны желудка дополняют узловыми серо-серозными швами. Далее накладывают инвагинационный двухрядный анастомоз между пищеводом и желудком в области его дна. Первый ряд швов анастомоза накладывают аппаратом ПКС-18 или 20, второй ряд узловой, не ближе 0,5 см от первого ряда. В последние годы обязательно выполняем фундопликацию по Ниссену. Это связано с тем, что большинство детей с ПГ имеют ГЭР, который провоцирует кровотечения. С другой стороны, широкая мобилизация желудка и пищевода обязательно приведет к тяжелому ГЭР, даже если его не было до операции. Кроме того, фундопликационная манжетка укрывает зону анастомоза, что является профилактикой его несостоятельности. Через нос вводят двухпросветный зонд, один канал которого служит для декомпрессии желудка, а по второму, проведенному в двенадцатиперстную кишку, осуществляют зондовое энтеральное питание. При отсутствии послеоперационных осложнений зонд удаляют не менее чем через 14 дней после обязательного рентгенологического контроля, исключающего выход контраста за пределы анастомоза.
Операции, направленные на улучшение печеночного кровотока и регенерацию печени: резекция печени, периартериальная неврэктомия общей печеночной артерии, артериальные анастомозы и др. носят паллиативный характер, недостаточно эффективны и могут применяться только в сочетании с перечисленными выше методами.
Oперации, направленные на отведение асцитической жидкости из брюшной полости нередко требуются больным в терминальной стадии ПГ при неэффективности консервативного лечения асцита. Особенно часто эта проблема возникает при внутрипеченочной форме заболевания. Для отвода жидкости из брюшной полости используют лапароцентез, дренирование брюшной полости, дренирование грудного лимфатического протока, и др. При отсутствии инфицирования жидкости, коагулопатии и сердечной недостаточности возможно постоянное перитонеально-венозное шунтирование. Для этого проводят больному проводят подкожный шунт из брюшной полости в правое предсердие. Что бы исключить обратный заброс крови в брюшную полость, в шунт обязательно устанавливают клапан LeVeen. Эта операция эффективно снижает давление в брюшной полости и респираторные осложнения, улучшает лимфоток из брюшной полости в грудной проток.
Наиболее радикальным методом лечения ПГ является трансплантация печени. Современные медицинские технологии позволяют проводить ее даже у маленьких детей. Показания к трансплантации печени чаще возникают у детей с внутрипеченочной формой ПГ и синдромом Бадда-Киари. Наблюдения последних лет показали, что пересадка печени требуется 70% больных с билиарной атрезией. Однако, в связи со сложностью, эта операция в нашей стране в настоящее время еще не применяется.