Теория Бренстеда-Лоури.
Сопряженные кислоты и основания

В карбоксилат-ионе отрицательный заряд за счет р, р-сопряжения распределён поровну между двумя атомами кислорода, т. е. он делокализован и соответственно менее концентрирован, поэтому в карбоновых кислотах кислотный центр более сильный, чем в спиртах и фенолах. С увеличением углеводородного радикала, который выполняет роль Э.Д. кислотность монокарбоновых кислот снижается за счет уменьшения д… Читать ещё >
Теория Бренстеда-Лоури. Сопряженные кислоты и основания (реферат, курсовая, диплом, контрольная)
Кислоты и основания проявляют свои свойства только в присутствие друг друга, Ни одно вещесвто не будет отдавать протон, если в системе нет акцептора протона — основания, и наоборот.т.е. они образуют сопряжённую кислотно-основную пару в которой чем сильнее кислота, тем слабее сопряженное ей основание, и чем сильнее основание, тем слабее сопряженная ему кислота.
Кислота, отдавая протон, превращается в сопряженное основание, а основание приняв протон, превращается в сопряженную кислоту. Кислоту обычно обозначают АН, а основание — В.
Например: НС1- Н+ + С1-, НС1 — сильная кислота; С1- ион — сопряженное слабое основание;
СН3СООН — СН3СОО- + Н+, СН3СООН — слабая кислота, а СН3СОО- — ион сопряженное сильное основание.
Общий вид можно представить так:
Н+¦: А + В Н: В+ + А:;
к-та основ сопр. сопр.
к-та основ-е Мы уже сказали, что кислотные свойства соединений обнаруживаются только в присутствие основания, а основные свойства — в присутствие кислоты, т. е. в соединениях существует определённое кислотно — основное равновесие, для изучения которого в качестве растворителя используется Н2О. По отношению к Н2О как к кислоте или как основанию определяют кислотно-основные свойства соединений.
Для слабых электролитов кислотность количественно оценивается Крав реакции, которая заключается в переносе Н+ от кислоты к Н2О как основанию.
СН3СООН + Н2О — СН3СОО- + Н3О+
к-та основ-е основание кислота СН3СОО- — ацетат ион, сопряженное основание;
Н3О+ — ион гидроксония, сопряженная кислота.
Используя значение константы равновесия этой реакции и учитывая, что концентрация Н2О практически постоянна, можно определить произведение К ?[H2O] называемое константой кислотности К кислотности (Ка).
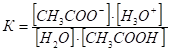
;
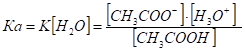
Чем больше Ка, тем сильнее кислота. Для СН3СООН Ка = 1,75 · 10-5. такие малые величины неудобны в практической работе, поэтому Ка выражают через рКа (рК = -?g Ка). Для СН3СООН рКа = 4,75. Чем меньше величина рКа, тем сильнее кислота.
Сила оснований определяется величиной рКВН+.
Кислотные свойства органических соединений с водородосодержащими функциональными группами (спирты, фенолы, тиолы, карбоновые кислоты, амины).
Органические кислоты В органических соединениях в зависимости от природы элемента, с которым связан Н+, различают следующие кислоты:
ОН — кислоты (карбоновые кислоты, фенолы, спирты).
СН — кислоты (углеводороды и их производные).
NH — кислоты (амины, амиды, имиды).
SH — кислоты (тиолы).
Кислотным центром называется элемент и связанный с ним атом водорода.
Сила кислоты будет зависеть от стабильности аниона, т. е. от сопряженного основания, которое образуется при отрыве Н+ от молекулы. Чем стабильнее анион, тем выше кислотность данного соединения.
Стабильность аниона зависит от ряда факторов, которые способствуют делокализации заряда. Чем выше делокализация заряда, тем устойчивее анион, тем сильнее кислотные свойства.
Факторы, оказывающие влияние на степень делокализации:
- 1. Природа гетероатома в кислотном центре
- 2. Электронные эффекты атомов углеводородных радикалов и их заместителей
- 3. Способность анионов к сольватации.
- 1. Зависимость кислотности от гетероатома.
Под природой гетероатома понимают его электроотрицательность (Э.О.) и поляризуемость. Чем больше (Э.О.) тем легче осуществляется гетеролитический разрыв в молекуле. В периодах слева направо с ростом заряда ядра растет (Э.О), т. е. способность элементов удерживать отрицательный заряд. В результате смещения электронной плотности связь между атомами поляризуется. Чем больше электронов и чем больше радиус атома, тем дальше электроны внешнего энергетического уровня расположены от ядра, тем выше поляризуемость и выше кислотность.
Пример: СНNHOHSH;
увеличение Э.О. и кислотности С, N, О — элементы одного периода. Э.О. по периоду растет, кислотность увеличивается. В этом случае поляризуемость влиять на кислотность не будет.
Поляризуемость атомов в периоде изменяется незначительно, поэтому главным фактором определяющим кислотность является Э.О.
Теперь рассмотрим ОНSH;
увел-е кислотности О, S — находятся в одной группе, радиус в группе сверху вниз увеличивается, следовательно растет и поляризуемость атома, что ведет к увеличению кислотности. У S радиус атома больше, чем у О, поэтому тиолы проявляют более сильные кислотные свойства по сравнению со спиртами.
Сравнить три соединения: этанол, этантиол и аминоаэтанол:
Н3С — СН2 — ОН, Н3С — СН2 — SH и Н3С — СН2 — NH2
- 1. Сравним по радикалу — они одинаковые;
- 2. По природе гетероатома в функциональной группе: S и О находятся в одной группе, но у S радиус атома больше, поляризуемость выше, следовательно этантиол обладает более сильными кислотными свойствами
- 3. Теперь сравним О и N. О обладает более высокой Э.О., следовательно кислотность у спиртов будет выше.
- 2. Влияние углеводородного радикала и присутствующих в нем заместителей
Необходимо обратить внимание студентов, что сравниваемые соединения должны иметь одинаковый кислотный центр и один растворитель.
Электроноакцепторные (Э.А.) заместители способствуют делокализации электронной плотности, что ведёт к стабильности аниона и соответственно увеличению кислотности.
Электронодонорные (Э.Д.) заместители наоборот способствуют концентрации электронной плотности в кислотном центре, что ведет к понижению кислотности и увеличению основности.
Например: одноатомные спирты проявляют более слабые кислотные свойства по сравнению с фенолами.
Пример: Н3С > СН2 > ОН.
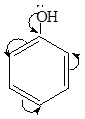
- 1. Кислотный центр один и тот же
- 2. Растворитель один и тот же
В одноатомных спиртах электронная плотность смещается от углеводородного радикала к группе ОН, т. е. радикал проявляет +I эффект, тогда на группе ОН сосредотачивается большое количество электронной плотности в результате чего Н+ более прочно связан с О и разрыв связи О-Н происходит трудно, поэтому одноатомные спирты проявляют слабые кислотные свойства.
У фенола наоборот бензольное кольцо является Э.А., а группа ОН- — Э.Д.
За счет того, что гидроксильная группа входит в общее р-р сопряжение с бензольным кольцом, в молекуле фенола происходит делокализация электронной плотности и кислотность увеличивается, т.к. сопряжение всегда сопровождается усилением кислотных свойств.
Увеличение углеводородного радикала в монокарбоновых кислотах также влияет на изменение кислотных свойств и при введении заместителей в углеводородный происходит изменение кислотных свойств.
Пример: в карбоновых кислотах при диссоциации образуются карбоксилат-ионы — самые стабильные органические анионы.
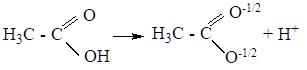
В карбоксилат-ионе отрицательный заряд за счет р, р-сопряжения распределён поровну между двумя атомами кислорода, т. е. он делокализован и соответственно менее концентрирован, поэтому в карбоновых кислотах кислотный центр более сильный, чем в спиртах и фенолах.
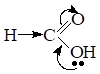
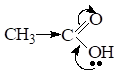
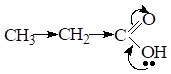
С увеличением углеводородного радикала, который выполняет роль Э.Д. кислотность монокарбоновых кислот снижается за счет уменьшения д+ на атоме углерода карбоксильной группы. Поэтому в гомологическом ряду кислот самой сильной является муравьиная кислота.
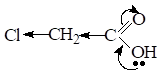
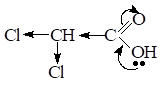
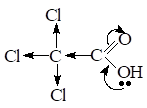
При введении Э.А. заместителя в углеводородный радикал, например хлора — кислотность соединения увеличивается, т.к. за счетI эффекта происходит делокализация электронной плотности и д+ на атоме С карбоксильной группы увеличивается, поэтому в данном примере трихлоруксусная кислота будет самой сильной.
3. Влияние растворителя.
Взаимодействие молекул или ионов растворенного вещества с растворителем называется процессом сольватации. Стабильность аниона существенно зависит от его сольватации в растворе: чем больше ион сольватирован, тем он устойчивее, а сольватация тем больше, чем меньше размер иона и чем меньше делокализация в нем отрицательного заряда.