Зависимость скорости реакции от концентрации реагентов.
Кинетическое уравнение реакции

Итак, кинетическое уравнение реакции содержит полезную информацию о ней, но оно непосредственно ничего не говорит о механизме реакции, хотя «правильный» механизм должен обязательно приводить к правильному кинетическому уравнению. Для выявления механизма реакции обычно используется вся совокупность сведений о возможных промежуточных соединениях и стадиях процесса, начиная с положения… Читать ещё >
Зависимость скорости реакции от концентрации реагентов. Кинетическое уравнение реакции (реферат, курсовая, диплом, контрольная)
Для того чтобы управлять скоростями химических процессов, ускоряя одни — нужные и замедляя или останавливая другие — ненужные, вредные, необходимо как можно более подробно знать влияние природы реагентов и других факторов на скорости реакций. Это возможно лишь тогда, когда мы понимаем, как протекает тот или иной процесс — в какой последовательности рвутся одни и образуются другие химические связи, каково при этом взаимное расположение и динамические характеристики отдельных взаимодействующих частиц и т. д. К сожалению, прямым экспериментальным путем, как правило, такие сведения получить не удается, так как в большинстве случаев мы можем исследовать структуры лишь исходных веществ и конечных продуктов реакций. Что же касается неустойчивых промежуточных соединений, то мы обычно не можем не только их детально изучить, но во многих случаях даже зафиксировать их наличие.
Химическая кинетика идет другим путем, строя на основе экспериментальных зависимостей скоростей реакций от природы реагентов, их концентраций и других условий предполагаемый механизм реакции и снова уточняя и проверяя его по косвенным экспериментальным данным. В итоге из нескольких возможных с точки зрения энергетики и стереохимии предполагаемых механизмов выбирают тот, который наилучшим образом согласуется со всеми без исключения экспериментальными данными, подобно тому, как в криминалистике отбирают версию, отвечающую всем обнаруженным при расследовании фактам.
При исследовании механизмов реакций методом проб и ошибок, пожалуй, наиболее информативной оказывается зависимость скорости реакций от концентраций (или парциальных давлений — для газов) реагирующих веществ. В некоторых случаях она очень проста; например, скорость реакции 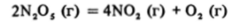
пропорциональна концентрации (парциальному давлению) оксида азоra (V): 
Коэффициент пропорциональности к — постоянная (при постоянной температуре) величина, называемая константой скорости химической реакции. Она имеет смысл скорости реакции при единичных концентрациях реагирующих веществ. Сама экспериментальная зависимость скорости реакции от концентрации реагентов носит название к инетического уравнения реакции, показатели степеней при концентрациях реагентов называются порядками реакции по этим реагентам, а их сумма — общим или суммарным порядком реакции. Так, приведенная выше реакция имеет первый порядок по оксиду азота (V) и общий первый порядок.
Порядки реакций не следует отождествлять со стехиометрическими коэффициентами. Эти понятия имеют совершенно разный физический смысл. Порядок реакции — это экспериментальная величина, существенно зависящая от механизма процесса, а стехиометрический коэффициент передает соотношение числа молей реагирующих веществ в итоговом уравнении реакции. В приведенном примере порядок реакции не совпадает с коэффициентом при исходном веществе, и это является общим случаем, хотя не исключены и случаи совпадения. Например, процессу синтеза иодоводорода из простых веществ.

отвечает кинетическое уравнение.
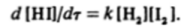
Реакция имеет первые порядки по водороду и иоду и общий второй порядок.
Следует отметить, что размерность константы скорости зависит от порядка реакции. Кинетическое уравнение реакции в общем виде требует следующего соотношения размерностей: 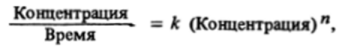
где п — порядок реакции. Следовательно, если выражать концентрацию в моль/л, то единицей измерения константы скорости будет моль О «я) • л (я» О • с-1. В частности, для реакции первого порядка константа скорости измеряется вс'1, второго — в моль'1 • л • с'1. Очевидно, что значение константы скорости реакции первого порядка нс зависит от выбора единиц измерения концентрации.
Реакции первого порядка не очень многочисленны. К ним, в частности, принадлежат некоторые реакции изомеризации и разложения; кроме упомянутого выше разложения оксида азота (V) можно назвать, например, разложение паров диметилового и других простых эфиров:
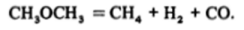
Одним из важнейших процессов первого порядка является также распад радиоактивных атомов, точнее, их ядер.
Очень похожие реакции с одинаковой стехиометрией могут иметь различные кинетические уравнения, так как механизм процесса часто зависит от специфических особенностей реагентов. Так, реакция образования бромоводорода, аналогичная приведенной выше реакции синтеза иодоводорода, описывается с точки зрения кинетики совершенно иначе. В начальный период, пока в системе практически отсутствует продукт реакции, ее скорость отвечает уравнению.
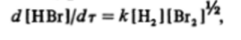
из которого мы видим, что порядок реакции может быть нецелочисленным По мере накопления в системе бромоводорода он начинает принимать участие в общем процессе, и механизм реакции усложняется. Соответственно этому этапу реакции отвечает другое, более сложное кинетическое уравнение, в котором отсутствует пропорциональность между скоростью реакции и концентрацией брома и бромоводорода в определенной степени, т. е. теряется понятие порядка реакции по этим компонентам. Сложность кинетического уравнения говорит о сложности механизма реакции, но само уравнение не дает прямой информации о нем.
Итак, кинетическое уравнение реакции содержит полезную информацию о ней, но оно непосредственно ничего не говорит о механизме реакции, хотя «правильный» механизм должен обязательно приводить к правильному кинетическому уравнению. Для выявления механизма реакции обычно используется вся совокупность сведений о возможных промежуточных соединениях и стадиях процесса, начиная с положения взаимодействующих элементов в периодической системе и кончая энергетическими характеристиками отдельных связей и процесса в целом.