Механизм действия реамберина

Участие в ресинтезе эндогенного ГАМК через б-кетоглутаровую кислоту (б-КГ) и янтарный полуальдегид (в нервной ткани). Здесь ЯК обеспечивает кругооборот ЦТК, выход б-КГ из митохондрий, при наличии которого возможен ресинтез ГАМК. Как холинореактивные системы эволюционно призваны защищать нейроны головного мозга от избытка катехоламинергических воздействий, так ГАМК противодействует… Читать ещё >
Механизм действия реамберина (реферат, курсовая, диплом, контрольная)
Биохимические основы действия реамберина
- — Входящий в состав реамберина сукцинат является естественным эндогенным субстратом клетки. Применение экзогенного сукцината сопровождается двумя основными изменениями, которые происходят в углеводном обмене веществ и окислительном фосфорилировании.
- — Янтарная кислота ускоряет оборот дикарбоновой части ЦТК (сукцинат — фумарат — малат) и снижает концентрации лактата, пирувата (в меньшей степени)1 и цитрата, которые накапливаются в клетках во время гипоксии. Таким образом, она повышает кругооборот ЦТК, следовательно, увеличивает объем энергии, необходимой для синтеза АТФ (и других химических синтезов, например ГАМК).
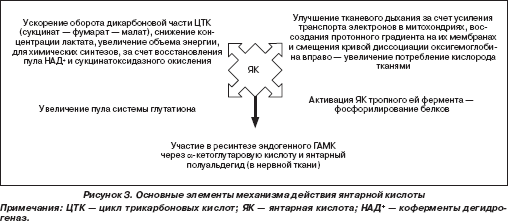
Увеличение количества субстрата (сукцината) позволяет осуществлять фосфорилирование белков, вследствие активации субстратом тропного ему фермента.
ЯК увеличивает потребление кислорода тканями и улучшает тканевое дыхание за счет усиления транспорта электронов в митохондриях, воссоздания протонного градиента на их мембранах и смещения кривой диссоциации оксигемоглобина вправо (А.Д. Розенфельд, 1983), т. е. усиливает отдачу кислорода тканям.
Интенсивность окисления сукцината зависит от его концентрации в клетке, а также от присутствия активаторов биотрансформации ЯК (Р.П. Нарциссов, 1997), т. е. от наличия предшествующих сукцинату и следующих после нее биохимических субстратов. Это очень важное положение для практического применения реамберина в сочетании с препаратами других фармакологических групп. При низких и средних концентрациях сукцината восстанавливается пул НАД+, при высоких возникает сукцинатоксидазное окисление, возрастает антиоксидантная функция системы глутатиона (Ю.Ю. Ивницкий, 1998).
В условиях гипоксии экзогенно вводимый сукцинат (входящий в состав реамберина) может поглощаться через альтернативный метаболический путь сукцинатоксидазной системы с последующим потреблением ЯК в дыхательной цепи митохондрий.
Участие в ресинтезе эндогенного ГАМК через б-кетоглутаровую кислоту (б-КГ) и янтарный полуальдегид (в нервной ткани). Здесь ЯК обеспечивает кругооборот ЦТК, выход б-КГ из митохондрий, при наличии которого возможен ресинтез ГАМК. Как холинореактивные системы эволюционно призваны защищать нейроны головного мозга от избытка катехоламинергических воздействий, так ГАМК противодействует НМДА-рецепторам, возбуждение которых сопровождается эксайтотоксичностью. Это свойство ЯК расширяет возможности применения реамберина, так как создает основу для его назначения в терапии хронических дегенеративно-дистрофических неврологических заболеваний, постабстинентных синдромов, в основе которых лежит эксайтотоксичность (таких как демиелинизирующие процессы, сирингомиелия, рассеянный склероз и т. д. или адренергический синдром при алкогольном абстинентном синдроме).
Системные эффекты реамберина
- 1. Улучшение микроциркуляции в органах и тканях, которое проявляется:
- — снижением зоны некроза в миокарде (Е.Н. Клигуленко, 2004);
- — редукцией зоны пенумбры при ЧМТ (А.Д. Цивинский, 2004);
- — сокращением зоны ишемической пенубры при инсульте (С.А. Румянцева, 2001);
- — восстановлением моторной функции кишечника; снижением интенсивности эндогеннойинтоксикации (Е.Н. Клигуленко, 2004); - снижением интенсивности ацидоза по метаболическим показателям кислотно-основного состояния (таким как ВВ и BE) (С.В. Оболенский, 2003).
- 2.
Введение
реамберина сопровождается незначительным ростом ЦВД (через 12 ч после начала лечения) без признаков гиперволемии (И.Г. Челнов, 2002). Среди других явлений отмечают: — положительную динамику воспаления, которая проявляется улучшением показателей «белой» крови (снижение лейкоцитоза с нормализацией палочкоядерного сдвига в среднем на 5-е сутки от момента введения препарата, нарастание числа лимфоцитов, снижение СОЭ и концентрации провоспалительных цитокинов) (О.Д. Куликова, 2002; И. Г. Челнов и соавт., 2002);
- — повышение антитоксической функции печени в виде снижения интенсивности гиперферментемии (АЛТ, ACT), билирубинемии; повышение уровня сульфгидрильных групп (С.В. Оболенский, 2003); - редукцию адренергических проявлений абстинентного синдрома (В.В. Афанасьев, 2002) — антистрессорное действие (М.Г. Романцов, 2002);
- — улучшение функциональной активности головного мозга (при лечении энцефалопатии) (С.А. Румянцева, 2001), положительная динамика спектрограмм ЭЭГ (С.В. Оболенский, 2003), ускоренное восстановление ВНД за счет снижения клинических проявлений астеновегетативного синдрома (Н.Н. Корнилова, 2002), инициацию и поддержание адаптогенных реакций организма (И.В. Высочина, 1997; Л.X. Гаркави, 1997);
- — диуретическое действие (максимально выраженное через 6−12 ч от начала лечения (у детей (И.Г. Челнов и соавт., 2002), сопровождающееся повышением рН мочи (С.В. Оболенский, 2003); - улучшение транспорта кислорода, сдвиг кривой диссоциации оксигемоглобина влево и повышение потребления кислорода различными тканями, включая кожный покров (А.Д. Розенфельд, 1983; О. Д. Куликова, 2002);
- — повышение пула естественных антиоксидантов и торможение процесса пероксидации собственных липидов, улучшение равновесия системы ПОЛ — АОС;
- — снижение уровня глюкозы крови в интервале от 48 до 72 ч от начала лечения.
Разнообразие системных эффектов реамберина обусловлено молекулярными механизмами его действия, обобщающими компонентами которого служат антигипоксический и антиоксидантный эффекты препарата. Перечисленные молекулярные и системные эффекты реамберина сопровождаются отчетливым положительным клиническим действием препарата: снижением летальности и сокращением сроков пребывания больных в ОРИТ, в т. ч. наиболее тяжелых пациентов с перитонитом и ПОН (С.В. Оболенский, 2003; Е. Н. Клигуненко, 2004). Эти благоприятные стороны действия реамберина открывают новые возможности интенсивной терапии тяжелых больных.
Мексидол, мексикор-оксиметилэтилпиридина сукцинат — представляет собой комплекс сукцината с антиоксидантом эмоксипином, обладающим относительно слабой антигипоксической активностью, но облегчает транспорт сукцината через мембраны, что проявляется антигипоксическим эффектом. Подобно эмоксипину, мексидол является ингибитором свободнорадикальных процессов, но оказывает более выраженное антигипоксическое действие. Клинические испытания подтвердили эффективность мексидола при расстройствах ишемического генеза: острых нарушениях мозгового кровообращения, дисциркуляторной энцефалопатии, вегетососудистой дистонии, атеросклеротических нарушениях функций мозга, абстинентном синдроме при алкоголизме и наркоманиях, при инфаркте миокарда, ИМТ, сепсисе и множестве других состояний, сопровождающихся гипоксией тканей.
Препаратом комплексного метаболического действия является цитофлавин (рибоксин 200 мг, янтарная кислота 1000 мг, рибофлавин 20 мг, никотинамид 100 мг). Он стимулирует процессы клеточного дыхания и образования энергии, улучшает утилизацию кислорода тканями головного мозга, восстанавливает антиоксидантную активность. Цитофлавин активирует внутриклеточный синтез белка, способствует утилизации глюкозы, жирных кислот и ресинтезу гамма-аминомасляной кислоты в нейронах через шунт Робертса. Препарат обладает оптимальным противогипоксическим эффектом. Наш клинический опыт свидетельствует о высокой клинической эффективности указанных препаратов при различных состояниях, связанных с гипоэргозом.
Со способностью превращаться в сукцинат в цикле Робертса связано, очевидно, и противогипоксическое действие оксибутирата натрия, хотя оно и не очень выражено. Трансаминирование ГАМК с альфа-кетоглутаровой кислотой является основным путем метаболической деградации ГАМК. Образующийся по ходу нейрохимической реакции полуальдегид янтарной кислоты с помощью семиальдегиддегидрогеназы при участии НАД окисляется в мозговой ткани в янтарную кислоту, которая включается в ЦТК. Такое дополнительное действие весьма полезно при использовании оксибутирата натрия в качестве общего анестетика. В условиях тяжелой циркуляторной гипоксии оксибутират в очень короткие сроки успевает запустить не только клеточные адаптационные механизмы, но и подкрепить их перестройкой энергетического обмена в жизненно важных органах. Поэтому не стоит ожидать сколько-нибудь заметного эффекта от введения малых доз анестетика. Средние дозы для натриевой соли оксибутирата составляют 70−120 мг/кг (до 250 мг/кг, в этом случае антигипоксическое действие будет выражено максимально). Мононаркоз оксибутиратом натрия представляет собой минимально токсичный вид общей анестезии и поэтому имеет наибольшую ценность у больных в состоянии гипоксии различной этиологии (тяжелая острая легочная недостаточность, кровопотеря, гипоксические и токсические повреждения миокарда), показан пациентам с различными вариантами эндогенной интоксикации (в состоянии оксидативного стресса).
Мафусол содержит один из компонентов цикла Кребса — фумарат, хорошо проникающий через мембраны и легко утилизируемый в митохондриях. При глубокой гипоксии терминальные реакции цикла Кребса начинают протекать в обратном направлении, и фумарат превращается в сукцинат с накоплением последнего. При этом обеспечивается сопряженная регенерация окисленного НАД из его восстановленной при гипоксии формы и, следовательно, возможность энергопродукции в НАД-зависимом звене митохондриального окисления. При уменьшении глубины гипоксии направление терминальных реакций цикла Кребса меняется на обычное, при этом накопившийся сукцинат активно окисляется в качестве эффективного источника энергии. Антигипоксическое действие мафусола при различных критических состояниях (кровопотеря, шок, травма, интоксикация, острые нарушения мозгового кровообращения по ишемическому и геморрагическому типу) подтверждено в ходе клинических испытаний. Мафусол вводится внутривенно и внутриартериально; вначале вводят струйно, а при нормализации гемодинамических показателей — капельно. При состоянии средней тяжести вводят 2−3 литра, при тяжелом состоянии препарат комбинируют с кровью или коллоидными кровезаменителями, при этом доза мафусола должна быть не менее 1 литра. В случаях кровопотери, не превышающей 15% ОЦК у взрослых и детей, может быть использован в качестве единственной инфузионной среды. Мафусол можно применять вместо других солевых инфузионных растворов.
Практическое применение в лечении критических состояний нашли и антигипоксанты, представляющие собой естественные для организма компоненты дыхательной цепи митохондрий, участвующие в переносе электронов, — цитохром С (цито-мак). Данный препарат, в сущности, выполняет функцию заместительной терапии, поскольку при гипоксии из-за структурных нарушений митохондрии теряют часть своих компонентов, включая переносчики электронов. В экспериментальных исследованиях доказано, что экзогенный цитохром С при гипоксии проникает в клетку и митохондрии, встраивается в дыхательную цепь и способствует нормализации энергопродуцирующего окислительного фосфорилирования. Цитохром С может быть полезным средством комбинированной терапии критических состояний. Показана высокая эффективность препарата при отравлении снотворными средствами, окисью углерода, токсических, инфекционных и ишемических повреждениях миокарда, пневмониях, нарушениях мозгового и периферического кровообращения.
Антигипоксантом, созданным на основе естественного для организма макроэргического соединения — креатинфосфата является препарат неотон. В миокарде и в скелетной мышце креатинфосфат выполняет роль резерва химической энергии и используется для ресинтеза АТФ. Действие как эндогенного, так и экзогенно вводимого креатинфосфата состоит в непосредственном фосфорилировании АДФ и увеличении тем самым количества АТФ в клетке. Кроме того, под влиянием препарата стабилизируется сарколеммальная мембрана ишемизированных кардиомиоцитов, снижается агрегация тромбоцитов и увеличивается пластичность мембран эритроцитов. Наиболее изучено нормализующее влияние неотона на метаболизм и функции миокарда. При повреждении миокарда существует тесная связь между содержанием в клетке высокоэнергетических фосфорилирующих соединений, выживаемостью клетки и способностью к восстановлению функции сокращения. Основными показаниями к применению креатинфосфата являются острый инфаркт миокарда, интраоперационная ишемия миокарда, хроническая сердечная недостаточность, острое нарушение мозгового кровообращения.
Таким образом, современная фармакология располагает достаточным арсеналом лекарственных препаратов метаболической направленности, способных обеспечить эффективную защиту организма и реализовать адаптогенные возможности систем жизнеобеспечения в критической ситуации.
Пути реализации:
- 1. Оксигенотерапия, неинвазивная и инвазивная вентиляция легких.
- 2. Стабилизация центральной гемодинамики и ликвидация микроциркуляторных нарушений.
- 3. Устранение анемии.
- 4. Коррекция кислотно-основного состояния и водно-электролитного баланса.
- 5. Дезинтоксикационная терапия.
В далеко зашедших случаях проводятся общеизвестные мероприятия сердечно-легочно-церебральной реанимации в соответствии с ее стадиями и этапами.
В настоящее время для лечения гипоксии критических состояний все чаще используют препараты метаболического действия, к которым относятся антиоксиданты и антигипоксанты. Адаптация клетки к изменяющимся вследствие патологии условиям существования заключается в перестройке обмена веществ и энергии. Улучшить энергоструктурный статус клетки в условиях гипоксии, обусловленной критическими нарушениями витальных функций, возможно следующим образом:
- 1. Ограничением процессов свободно радикального окисления.
- 2. Повышением эффективности использования митохондриями дефицитного кислорода вследствие предупреждения разобщения окисления и фосфорилирования, стабилизации мембран митохондрий.
- 3. Ослаблением ингибирования реакций цикла Кребса, особенно поддержанием активности сукцинатоксидазного звена.
- 4. Возмещением утраченных компонентов дыхательной цепи.
- 5. Формированием искусственных редокс-систем, шунтирующих перегруженную электронами дыхательную цепь.
- 6. Экономизацией использования кислорода и снижения кислородного запроса тканей, либо ослаблением дыхательного контроля в митохондриях, либо ингибированием путей его потребления, не являющихся необходимыми для экстренного поддержания жизнедеятельности в критических состояниях (нефосфорилирующее ферментативное окисление — терморегуляторное, микросомальное и др., неферментативное окисление липидов).
- 7. Увеличением образования АТФ в ходе гликолиза без увеличения продукции лактата.
- 8. Снижением расходования АТФ клеткой на процессы, не определяющие экстренное поддержание жизнедеятельности в критических ситуациях (различные синтетические восстановительные реакции, функционирование энергозависимых транспортных систем и т. д.).
- 9.
Введение
м извне высокоэнергетических соединений.
Представленные вашему вниманию различные препараты и патогенетические подходы для коррекции гипоэргоза позволят вам в той или иной ситуации протезировать некоторые обменные процессы, возникающие при «поломке», но нет универсального «спасателя». Поэтому прежде всего необходима адекватная оценка тех процессов, которые происходят в данный момент в организме, знание клинической фармакологии, и тогда вы сможете помочь.