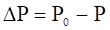При испарении жидкости над ее поверхностью образуется пар. Процесс испарения обратим, одновременно с ним идет и конденсация пара. При равенстве скоростей испарения и конденсации устанавливается динамическое равновесие, и насыщенный пар при данной температуре имеет постоянное давление. При растворении в данном растворителе нелетучего вещества, концентрация молекул растворителя на поверхности уменьшается, что приводит к уменьшению количества молекул растворителя, вылетающих с поверхности жидкости в единицу времени. В этом случае равновесие между жидкостью и насыщенным паром устанавливается при более низком давлении по сравнению с давлением пара над растворителем. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами называют понижением давления пара:
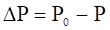
(4.5).
где P0 — давление пара растворителя над чистым растворителем, Р — давление пара растворителя над раствором, Р — понижение давления пара.
Отношение величины этого понижения к давлению насыщаемого пара над чистым растворителем называется относительным понижением давления пара над раствором. В 1887 году французский физик Рауль, изучая растворы различных нелетучих жидкостей и твердых веществ, установил закон: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Первое следствие закона Рауля. Понижение давления пара растворителя над раствором при постоянной температуре пропорционально мольной доле растворенного вещества.
Растворы, подчиняющиеся закону Рауля, называются идеальными. Концентрированные растворы и растворы электролитов не подчиняются закону Рауля.