Практикум.
Химия

Анализ связи проводится в следующей последовательности, результаты анализа заносятся в таблицу: а) укажите степень окисления атомов в предложенной молекуле; б) приведите графические формулы валентного слоя атомов; в) укажите валентность атомов в соединении; г) составьте графическую формулу молекулы с ковалентным типом связи, учитывая валентные возможности атомов; д) укажите тип гибридизации… Читать ещё >
Практикум. Химия (реферат, курсовая, диплом, контрольная)
Контрольные вопросы и задания
- 1. Дайте определение химической связи. Перечислите виды химической связи.
- 2. Охарактеризуйте такие свойства ковалентной связи, как длина, прочность, полярность, поляризуемость.
- 3. Чем объясняется направленность ковалентной связи? Изложите основные положения теории гибридизации атомных орбиталей Полинга.
- 4. Охарактеризуйте о-, я-, 5-связь и механизм образования кратных связей.
- 5. Охарактеризуйте обменный и донорно-акцепторный механизмы образования ковалентной связи.
- 6. Опишите свойства ионной связи.
- 7. В чем состоит принципиальное различие методов ВС и МО?
- 8. Опишите порядок заполнения молекулярных орбителей электронами. Дайте определение порядка связи. Охарактеризуйте связывающие и разрыхляющие молекулярные орбитали.
- 9. Объясните особенности металлической связи и строение кристаллической решетки металлов.
- 10. Охарактеризуйте силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса, водородную связь).
- 11. Охарактеризуйте особенности жидкого состояния. Дайте определения понятиям: поверхностное натяжение, испарение, конденсация, насыщенный пар, температура кипения.
- 12. Охарактеризуйте свойства веществ в твердом состоянии, исходя из строения их кристаллических решеток.
Примеры выполнения заданий
1. Укажите тип химической связи в соединениях: I2, Cs20, СН4.
Решение. Тип химической связи определяется степенью ее полярности, которая зависит от разности относительных элсктроотрицательностей атомов, образующих связь (ДОЭО).
12 — связь между атомами иода осуществляется перекрыванием р-облаков. Так как атомы, образующие связь, одинаковы, имеют одинаковую относительную электроотрицательность (ОЭО), общее электронное облако в равной степени принадлежит обоим атомам. Связь — ковалентная неполярная.
Cs20 — связь между атомом цезия и атомом кислорода ионная, так как ее образуют типичный металл и типичный неметалл. ДОЭО = 3,5 — 0,7 = = 2,8 (см. приложение 2). Электрон от атома металла переходит к атому кислорода, обладающему большим значением ОЭО.
СН4 — связи в молекуле ковалентные полярные, поскольку атомы углерода и водорода отличаются по электроотрицательности незначительно (ДОЭО = 2,5 — 2,1 = 0,4). Общее электронное облако связи С—Н смещено к углероду.
2. Расположите связи Cs—Н, Ва—Н, а также Ge—F, Si—F, С—F, Sn—F в порядке возрастания их длины (d), укажите, как изменяется в этих рядах прочность (?св), полярность (ДОЭО) и поляризуемость связи.
Связь. | Характеристика связи. | |||
Длина. | Энергия. | Полярность. | Поляризуемость. | |
Cs-H. Ва-Н. | t. | г. | ||
С—F Si—F Ge-F Sn-F. | т. | т. | i | |
3. Пользуясь методом валентных связей, проведите анализ химической связи в соединениях: а) Н3Р04; б) С2Н2.
Решение.
Предлагаем следующую последовательность выполнения задания.
- 1. Определите степень окисления атомов элементов по химической формуле соединения.
- 2. Постройте графические формулы валентного электронного уровня атомов, входящих в состав молекулы данного соединения, оцените их валентные возможности.
- 3. Постройте графическую формулу молекулы вещества и оцените ее достоверность с учетом валентных возможностей всех атомов, входящих в состав соединения. Обозначьте, а и л-связи.
- 4. Определите координационное число центрального атома по числу образованных им a-связей, укажите его ковалентность.
- 5. Укажите тип гибридизации орбиталей центрального атома (если она имеет место в данном соединении). Для этого в соответствии с числом a-связей атома отделите на графической формуле его валентного слоя необходимое число орбиталей, начиная с s-орбитали. Так, если атом образует две a-связи, то при этом происходит sp-гибридизация; три а-связи осуществляются тремя гибридными 5/?2-орбиталями, четыре — четырьмя
$р3-орбиталями и т. д. Каждому типу гибридизации атомных орбиталей соответствуют определенный валентный угол и пространственное строение частицы. Укажите их.
- 6. Определите орбитали центрального атома, идущие на образование л-связей. Это негибридизованные р- или ^/-орбитали с неснаренными электронами, оставшиеся после образования су-связей.
- 7. На графической формуле вещества обозначьте орбитали атомов, участвующие в образовании каждой связи.
- а) ПзР+3С>42
В соответствии со степенью окисления атома фосфора от него оттянуто пять электронов к атомам более электроотрицательного элемента (кислорода). Чтобы образовать пять химических связей, атом фосфора должен иметь пять неспаренных электронов. Это возможно при переходе одного s-электрона на свободную-орбиталь (возбужденное состояние атома, Р*).
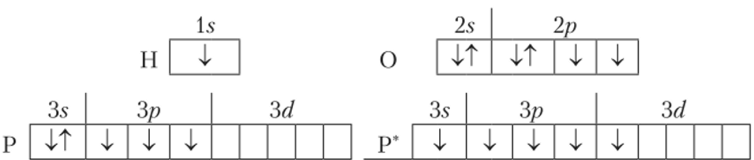
Составим графическую формулу фосфорной кислоты.
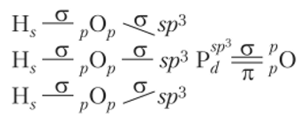
Из формулы следует, что координационное число атома фосфора равно четырем, так как он образует четыре a-связи. Для этого необходимы четыре орбитали. Близкие по энергии одна s- и три р-орбитали валентного слоя выравниваются по форме и энергии — гибридизуются, образуя четыре ^3-гибридныс орбитали, направленные в пространстве иод углом 109°28', в результате чего фосфат-ион имеет форму тетраэдра.
Негибридизованная одноэлектронная rf-орбиталь атома фосфора образует л-связь с р-орбиталью атома кислорода за счет бокового перекрывания.
Атомы кислорода и водорода образуют химические связи перекрыванием соответственно р и 5-облаков с орбиталями соседних атомов.
Итак, в молекуле Н3Р04 центральный атом фосфора имеет:
степень окисления +5;
валентность 5;
координационное число 4;
тин гибридизации sp3.
б)С~2Щ

Известно, что во всех органических соединениях углерод четырехвалентен.
Следовательно, графическая формула ацетилена имеет вид:
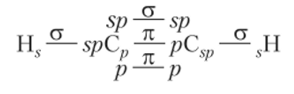
Из трех связей между атомами углерода — одна a-связь и две л-связи. Каждый атом углерода образует по две a-связи (одну с атомом углерода, другую — с атомом водорода). Координационное число атома углерода равно двум, тип гибридизации — sp, валентный угол (<�НСС) — 180°, молекула линейна.
Итак, в молекуле С2Н2 атомы углерода имеют:
степень окисления -1;
валентность 4;
координационное число 2;
тип гибридизации sp.
4. Предположите возможность существования частиц IJ2 и N0 с позиций метода молекулярных орбиталей. Приведите электронные формулы этих частиц, оцените их прочность.
Решение.
Li 2 — каждый атом лития содержит три электрона, катион Li2 должен содержать пять электронов, и его электронная формула в соответствии с порядком заполнения молекулярных орбиталей имеет следующий вид:
Для оценки прочности связи рассчитывают ее кратность (со). Она равна полуразности чисел электронов, находящихся на связывающих и на разрыхляющих орбиталях:
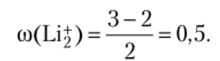
Кратность связи меньше единицы, прочность связи мала, невелика и вероятность существования катиона Li2.
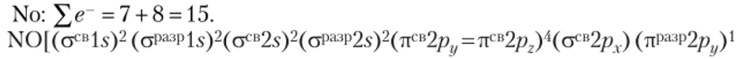
10−5.
co (NO) = —-— = 2,5, молекула NO достаточно прочная.
Задания для самостоятельного выполнения.
1. Укажите тип химической связи в соединениях.
Вариант. | Соединения. | Вариант. | Соединения. |
MgCl2, N2, РС15, НС1. | Csl, NH3, Cl2, CaO. | ||
Н20,12, ВаС12, A1F3 | Na20, HI, 02, KBr. | ||
ai2o3, h2s, со2, f2 | Nal, C02, Br2, BaO. | ||
S02, СаВг2, S2, BI3 | СН4, BBr3, CaCl2, P2 | ||
Rb20, PH:j, NO, Cl2 | NH3, K20, Si02, N2 |
Вариант. | Соединения. | Вариант. | Соединения. |
КС1, НВг, Р2, Na2S. | A1 °F.4, H2S, Cr203, 12 | ||
SiH4, KI, N2, BeO. | NaC.1, MgO, CC14, 02 | ||
BaF2, Br2, PC13, SrO. | |||
2. Расположите указанные химические связи в порядке возрастания указанных их свойств.
Вариант. | Свойства связи. | Химические связи. |
Прочность Полярность. | H-Se, Н—S, Н-Те, Н-О Bc-F, В—F, С—F. | |
Прочность Длина. | H-I, H-F, Н-С1, Н-Вг С=С, С-С, С=С. | |
Полярность Длина. | Н-С1, Н-Р, Н—Si, H-S H-S, Н-Тс, H-Se. | |
Поляризуемость Прочность. | H-Cl, H-F, Н-I, Н-Вг Р-Н, As-H, N-H, Sb-H. | |
Прочность Длина. | С=С, С-С, С^С В—F, Al-F, Ga-F, In-F. | |
Длина Полярность. | Na-H, Al-H, Mg-H, Si-H Be—Cl, Ca—Cl, Mg-Cl, Sr-Cl. | |
Длина Полярность. | P-H, As-H, N-H, Sb-H Mg-H, Al-H, Na-H, Si-H. | |
Длина Прочность. | Al-F, Ga-F, B-F, In-F N-H, O-H, F-H, C-H. | |
Длина Прочность. | H-Br, H-I, H-F, H-Cl S-H, Si-H, Р-Н, Cl-H. | |
Поляризуемость Прочность. | H-Se, H-S, H-O, H-Te Br-H, Ge-H, As-H, Se-H. | |
Прочность Полярность. | As-H, N-H, P-H, Sb-H H-Br, H-I, H-F, H-Cl. | |
Прочность Полярность. | Ca-F, Mg-F, Be-F, Sr-F C-H, F-H, O-H, N-H. | |
Длина Полярность. | Be-F, Mg-F, Ca-F, Sr-F H-Te, H-S, H-O, H-Se. | |
Прочности Полярности. | Li-H, B-H, Be-H, C-H Ba—I, Mg-I, Be—I, Sr—I. | |
Полярность Длина. | K-F, Li-F, Na-F, Rb-F O-H, N-H, F-H, C-H. |
3. В соединениях, формулы которых приведены в таблице: а) укажите степень окисления атомов; б) приведите графические формулы вален гного слоя атомов; в) составьте графическую формулу молекулы с учетом валентных возможностей атомов; г) обозначьте аи тт-связи; д) укажите, перекрыванием каких электронных облаков они образованы; с) укажите тип гибридизации орбиталей центрального атома (если таковая имеет место) и пространственную конфигурацию молекулы.
Вариант. | ||||||||
Вещества. | H2Se04 ВеС12 | Н2СО, ОеС14 | H2so4 ВС13 | НР03 ВеВг2 | SF6 SiH4 | H3As04 BeF2 | nh4 CS2 | SiCl4 co2 |
Вариант. | ||||||||
Вещества. | СН3ОН. N,. | Н4Р207 РН3 | H4Sio4 С2Н4 | неон. cf4 | сн4 Sn02 | GeCl4 BF3 | HCOOH. CC14 | |
4. Составьте энергетические диаграммы распределения электронов по молекулярным орбиталям реальных или гипотетических частиц, формулы кото зых указаны в таблице, оцените прочность этих частиц.
Вариант. | |||||||||||
Частицы. | *2> СО. | С2> н2 | Nej, Li 2 | о2,. П2+ | NO+,. В2 | *2, NaJ. | n2,. He2 | o2+,. H2 | |||
Вариант. | |||||||||||
Частицы. | о2,. Не2 | F2. N2. | F*. СО. | HeJ,. NO. | N2+2> Ne2 | Na2+,. or. | 02, Na2 | ||||
Тест для самоконтроля.
- 1. В какой строке приведены формулы веществ только с ковалентной полярной связью?
- 1) КС1, НС1, S02;
- 2) Вг2, С09, С1907;
- 3) НС1, СН4, Р205.
- 2. В какой строке связи расположены в порядке увеличения их прочности?
- 1) С-С, С=С, С=С;
- 2) С=С, С=С, С-С;
- 3) С=С, С-С, С=С.
- 3. Какова гибридизация центрального атома серы в молекуле H2S04? )sp;
- 2) sp*;
- 3) sp3.
- 4. В какой строке связи расположены в порядке увеличения поляризуемости?
- 1) Н—F, Н—I, Н—Br, Н-С1;
- 2) H-Br, H-F, Н-I, Н-С1;
- 3) H-F, H-Cl, H-Br, H-I.
- 5. В какой строке связи расположены в порядке увеличения их длины?
- 1) Н—F, Н—I, H-Br, Н-С1;
- 2) H-Br, Н—F, H-I, Н—Cl;
- 3) H-F, Н-С1, Н-Br, Н—I;
- 6. В какой строке связи расположены в порядке увеличения их прочности?
- 1) Н—I, Н—Br, H-Cl, H-F
- 2) Н-Br, Н—F, Н-I, Н-С1;
- 3) Н—F, H-Cl, H-Br, H-I.
- 7. В какой строке связи расположены в порядке увеличения их полярности?
- 1) H-I, H-Br, H-Cl, H-F;
- 2) Н-Вг, H-F, H-I, Н-С1;
- 3) H-F, H-Cl, H-Br, H-I.
- 8. В какой строке приведены соединения только с ионным типом связи?
- 1) КС1, СО, ВаО;
- 2) СаС12, NH3, НС1;
- 3) CaO, SrCl2, NaF.
- 9. Какая связь характеризуется наличием делокализованных электронов?
- 1) ковалентная неполярная;
- 2) ковалентная полярная;
- 3) металлическая.
- 10. Какая связь характеризуется ненасыщаемостью и ненаправленностью?
- 1) ковалентная неполярная;
- 2) ионная;
- 3) ковалентная полярная.
Ответы к тесту
Номер вопроса. | ||||||||||
Номер ответа. |
Лабораторная работа № 3 Расчет длины химической связи
Цель работы: рассчитать длину связей в соединениях с ковалентной и ионной связью.
Оборудование: калькулятор, справочные данные таблиц «Ковалентные радиусы элементов» (табл. 4.4) и «Ионные радиусы некоторых элементов» (табл. 4.5).
Расстояния между атомами в молекулах всегда меньше суммы радиусов атомов в свободном состоянии, поскольку перекрывание электронных облаков при образовании связи ведет к сближению ядер атомов.
Длины связей в молекулах определяются с помощью спектроскопических и дифракционных методов. Длина связи несет информацию о прочности связи: чем меньше длина, тем прочнее связь.
Одинаковые связи в молекулах различных соединений имеют близкие по значению длины. Постоянство длин связей позволяет определить радиус атомов, участвующих в образовании ковалентной связи. Рассматривая межъядерное расстояние как сумму двух радиусов, длину ковалентной связи между одинаковыми атомами делят пополам и находят ковалентный радиус атома, который меньше радиуса атома в свободном состоянии. Используя известные значения радиусов, можно определять радиусы других атомов исходя из полученных в опыте значений длин связей. По известным ковалентным радиусам можно рассчитать длины связей в молекуле. Получаемые таким образом значения согласуются с опытными с точностью до 5%.
Для ионных веществ описанный выше подход неприменим, так как в ионных кристаллах на концах связей находятся различные атомы. К тому же ионные эффекты обусловливают уменьшение длины связи по сравнению с ковалентной. Определение ионных радиусов проводят следующим способом: для изучения берутся ионные кристаллы однотипных соединений, в которых размеры отрицательных ионов больше размеров положительных, например, иодиды некоторых щелочных металлов или селениды щелочноземельных металлов. В ряду таких соединений расстояния между анионами (I—I, Se-Se) постоянны. Это указывает на то, что анионы в кристаллической решетке соприкасаются между собой. Поделив межъядерное расстояние пополам, можно найти ионный радиус аниона. Положительные ионы в кристаллах таких соединений находятся в дырках между анионами. Исследование множества ионных соединений позволило составить таблицы ионных радиусов.
Для расчета длины связей используйте данные таблиц «Ковалентные радиусы элементов» и «Ионные радиусы некоторых элементов».
Ход работы Для выполнения работы необходимо провести анализ химических связей предложенных молекул.
Анализ связи проводится в следующей последовательности, результаты анализа заносятся в таблицу: а) укажите степень окисления атомов в предложенной молекуле; б) приведите графические формулы валентного слоя атомов; в) укажите валентность атомов в соединении; г) составьте графическую формулу молекулы с ковалентным типом связи, учитывая валентные возможности атомов; д) укажите тип гибридизации орбиталей центрального атома (если таковая имеет место).
Во вторую таблицу занесите: а) все связи между атомами в молекуле;
б) укажите их тип; в) обозначьте ои тт-связи; г) укажите, перекрыванием каких электронных облаков они образованы; д) рассчитайте длину связей; е) укажите значения углов между связями.
Пример. Рассчитайте длину связей в молекулах Н2СОл и СаО.
Молекула. | Степень окисления атомов. | Валентный слой атома в основном, возбужденном или ионном состоянии. | Валентность атомов, заряд ионов. | Гибридизация. |
H2co3 | Н+ с°. С+4 0−2. | Н: Is*. С: 252р2 С*: 25^3 О: 24. |
|
Моле; | Степень. | Валентный слой атома. | Валентность. | Гибриди; |
кула. | окисления. | в основном, возбужденном. | атомов,. | зация. |
атомов. | или ионном состоянии. | заряд ионов. | ||
СаО. | Са+2 | Са: 4s2; Са2+: 4s°. | _. | |
О2 | 0: 2 $2рА О-2: 2s2p* | ; |
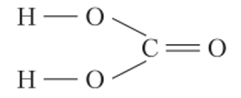
В возбужденном состоянии атом углерода имеет четыре неспаренных электрона, следовательно, он может проявить валентность, равную четырем. Учитывая степень окисления углерода в молекуле угольной кислоты, равную +4, можно сделать вывод о том, что он образует четыре связи с тремя более электроотрицательными атомами кислорода, которые оттягивают на себя электроны углерода. При этом два атома кислорода присоединяются к атому углерода одинарными a-связями, а третий — двойной связью (а и тт). Второй неспаренный электрон каждого из двух вышеуказанных атомов кислорода идет на образование а-связсй с атомами водорода, имеющими, но одному неспаренному электрону. Кислород оттягивает на себя общую с водородом электронную пару, поэтому степень окисления водорода +1.
Связь. | Тип связи по полярности. | Кратность. | Вид связи (по направлению перекрывания облаков). | Облака или ионы, образующие связь. | Длина связи, нм. | Угол между связями. |
Н-0. | Ковалентная полярная. | Одинарная. | а. | s-p | 0,111. | ZHOC = 90° ZOCO = 120°. |
О-С. | Ковалентная полярная. | Одинарная. | а. | p-sp2 | 0,151. | |
с=о. | Ковалентная полярная. | Двойная. | а, л. | sp2-p р-р | 0,119. | |
Са-О. | Ионная. | Ненасыщаемая. | Ненаправленная. | Са2+,. О2; | 0,239. | Электростатическое притяжение ионов по любым направлениям. |
Вариант | ||||||||
Фор мулы веществ | H2Sc RbCl | Н2С2 к2о. | h2so4 NaCl | h2so3 K2S | SF6 LiBr | C2H4 KC1 | HCOOH BaF2 | SiCl4 MgO |
Вариант | ||||||||
Фор мулы веществ | н3ро4 CaS | hno2 NaF | CH3OH BaS | HCHO A1F3 | SrO GeCl4 | NaBr BF3 | нею,. AICI3. | |
Таблица 4.4
Ковалентные радиусы некоторых хи p-элементов, нм, в одинарных, двойных и тройных связях (два последних даны в скобках)
H 0,037 | ||||||
Li 0,1519 | Be 0,1113 | В 0,0795 | C
| N
| О
| F 0,0709 |
Na 0,1858 | Mg 0,1599 | Al 0,1432 | Si 0,1176 | P
| S
| Cl 0,0994 |
К 0,2272 | Ca 0,1974 | Ga 0,1221. | Ge 0,0123 | As 0,125 | Se 0,1161 | Br 0,1142 |
Rb 0,248 | Sr 0,2152 | In 0,1626 | Sn 0,1405 | Sb 0,145 | Те 0,1432 | I 0,1333 |
Таблица 4.5
Ионные радиусы, нм, некоторых элементов
Li+ 0,06 | Mg2+ 0,065 | F 0,136 | O2 0,14 |
Na+ 0,095 | Ca2+ 0,099 | Cl 0,181 | s2; 0,184 |
Kf 0,133 | Sr2+ 0,113 | BiО. 195 | Se2 0,196 |
Rb- 0,148 | Ba2+ 0,135 | I 0,216 | Te2^ 0,221. |