Соединение серы в степени окисления 6+

При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 С, когда начинает перегоняться 98,3% H2SO4 (рис. 5). Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 С серной кислоты частично диссоциирован на H2O и SO3, которые вновь соединяются при охлаждении. Высокая… Читать ещё >
Соединение серы в степени окисления 6+ (реферат, курсовая, диплом, контрольная)
Серная кислота — H2SO4
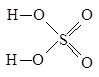
Образуется H2SO4 из SO3 и воды, это сопровождается большим выделением тепла:
H2O + SO3 = H2SO4 + 63 кДж Чистая 100%-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10,3 С [8]. Реактивная серная кислота имеет обычно плотность 1,84 г/см 3 и содержит около 95% H2SO4. Затвердевает она лишь ниже 20 С.
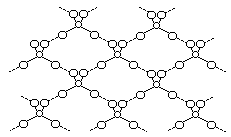
Рис. 1. Схема водородных связей в кристалле H2SO4
Моногидрат может быть получен кристаллизацией концентрированной серной кислоты при 10 С. Образующие его кристалл молекулы Н2SO4 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО)2SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d (SОН) = 154 пм, НОSОН = 104, d (S=O) = 143 пм, OSO = 119. В ионе HOSO3, d (SОН) = 161 и d (SO) = 145 пм, а при переходе к иону SO42 тетраэдр приобретает правильную форму и параметры выравниваются [d (SO) = 148 пм].
Температура плавления моногидрата равна 10,37 С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (=100 при 25 С). Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно по двум направлениям: [Н3SO4] [НSO4]= 2104 и [Н3О] [НS2О7]= 4105. Его молекулярно-ионный состав может быть приближенно охарактеризован следующими данными (в %):
H2SO4 | HSO4 | H3SO4 | H3O. | HS2O7 | H2S2O7 |
99,5. | 0,18. | 0,14. | 0,09. | 0,05. | 0,04. |
При добавлении даже малых количеств воды, преобладающей становится диссоциация по схеме:
Н2О + Н2SО4 Н3О + НSO4
Моногидрат является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в бисульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза (с переводом в бисульфаты). Азотная кислота ведет себя в моногидрате как слабое основание:
HNO3 + 2H2SO4 H3O+ + NO2+ + 2HSO4;
хлорная — как очень слабая кислота.
H2SO4 + HClO4 = H3SO4+ + ClO4;
Моногидрат хорошо растворяет многие органические вещества, имеющие в своём составе атомы с неподелёнными электронными парами (способными к присоединению протона). Некоторые из них могут быть затем выделены обратно в неизменённом состоянии путем простого разбавления раствора водой. Моногидрат обладает высоким значением криоскопической константы (6,12) и им иногда пользуются как средой для определения молекулярных весов [3].
Концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании (восстанавливается обычно до SO2). Например, она окисляет HI и частично HВr (но не HСl) до свободных галогенов. Окисляются ею и многие металлы — Cu, Hg и др. (тогда как золото и платина по отношению к H2SO4 устойчивы) [6]. Так взаимодействие с медью идёт по уравнению:
Cu + 2H2SO4 = CuSO4 + SO2 + H2O.
Практически важно то обстоятельство, что очень крепкая (выше 75%) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная H2SO4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны.
Действуя в качестве окислителя, серная кислота обычно восстанавливается до SO2. Однако наиболее сильными восстановителями она может быть восстановлена до S и даже H2S. С сероводородом концентрированная серная кислота реагирует по уравнению:
H2SO4 + H2S = 2H2O + SO2 + S [1].
Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой H2SO4) связано её разрушающее действие на растительные и животные ткани [6]. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой.
Растворение концентрированной серной кислоты в воде сопровождается значительным выделением тепла (и некоторым уменьшением общего объёма системы). Моногидрат почти не проводит электрического тока. Напротив, водные растворы серной кислоты являются хорошими проводниками. Как видно на рис. 2, максимальной электропроводностью обладает приблизительно 30%-ная кислота. Минимум кривой соответствует гидрату состава H2SO4H2O.
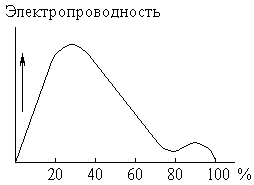
Рис. 2. Электропроводность растворов серной кислоты
Выделение тепла при растворении моногидрата в воде составляет (в зависимости от конечной концентрации раствора) до 84 кДж/моль H2SO4. Напротив, смешиванием 66%-ной серной кислоты, предварительно охлажденной до 0 С, со снегом (1:1 по массе) может быть достигнуто понижение температуры, до 37 С.
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 3. Из них наиболее бедный водой представляет собой соль оксония: H3O+HSO4-. Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
Изменение плотности водных растворов H2SO4 с её концентрацией (вес. %) дано ниже:
15 С. | 1,033. | 1,068. | 1,142. | 1,222. | 1,307. | 1,399. | 1,502. |
25 С. | 1,030. | 1,064. | 1,137. | 1,215. | 1,299. | 1,391. | 1,494. |
15 С. | 1,615. | 1,732. | 1,820. | 1,839. | 1,841. | 1,836. |
25 С. | 1,606. | 1,722. | 1,809. | 1,829. | 1,831. | 1,827. |
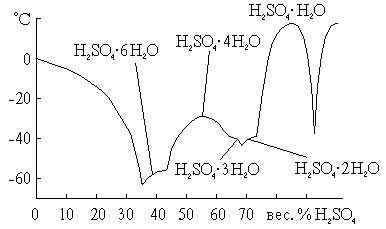
Рис. 3. Температуры плавления в системе H2OH2SO4
Как видно из этих данных, определение по плотности концентрации серной кислоты выше 90 вес. % становится весьма неточным.
Давление водяного пара над растворами H2SO4 различной концентрации при разных температурах показано на рис. 4. В качестве осушителя серная кислота может действовать лишь до тех пор, пока давление водяного пара над её раствором меньше, чем его парциальное давление в осушаемом газе.
При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 С, когда начинает перегоняться 98,3% H2SO4 (рис. 5). Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 С серной кислоты частично диссоциирован на H2O и SO3, которые вновь соединяются при охлаждении. Высокая температура кипения серной кислоты позволяет использовать её для выделения при нагревании легколетучих кислот из их солей (например, HCl из NaCl) [3].
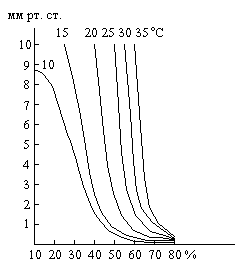
Рис. 4. Давление водяного пара над растворами H2SO4
Как сильная двухосновная кислота, H2SO4 даёт два ряда солей: средние (сульфаты) и кислые (гидросульфаты или бисульфаты), причём последние в твёрдом состоянии выделены лишь для немногих самых активных металлов (Na, K и др.) [6]. Большинство сернокислых солей бесцветно, хорошо кристаллизуется и легкорастворимо в воде. Из производных наиболее обычных металлов малорастворим CaSO4, ещё менее PbSO4 и практически нерастворим BaSO4.
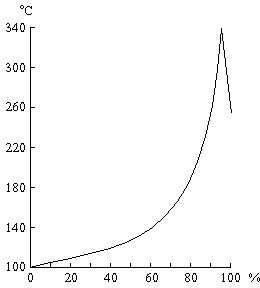
Рис. 5. Температуры кипения растворов H2SO4
По отношению к нагреванию сульфаты можно подразделить на две группы. Одни из них (например, соли Na, K, Ba) не разлагаются даже при 1000 С, другие (например, соли Cu, Al, Fe) разлагаются на оксид металла и SO3 при гораздо более низких температурах. Некоторые, содержащие кристаллизационную воду сульфаты, иногда называют купоросами, например, CuSO45H2O — медный купорос, FeSO47H2O — железный купорос.
Как кислота H2SO4 в водных растворах близка по силе к хлорноватой в отношении первой стадии ионизации (H2SO4 H+ + HSO4-), но вторая стадия (HSO4— H+ + SO42-) выражена гораздо слабее и характеризуется значением K2 = 1102.
На разложении некоторых сернокислых солей при нагревании был основан способ получения серной кислоты, применявшийся алхимиками и затем вплоть до середины XVIII века исходным материалом служили природные минералы, содержащие сернокислые соли железа. Последние образовывались за счёт медленно протекавшего во влажном воздухе окисления сульфидов, например, по схеме:
4FeS + 9O2 + 2H2O = 4Fe (OH)SO4.
При накаливании эта соль разлагалась с образованием монооксида железа, серной кислоты и серного ангидрида:
2Fe (OH)SO4 = Fe2O3 + H2SO4 + SO3.
Разбавляя продукт перегонки водой, получали серную кислоту желаемой концентрации.
Многие соли H2SO4 находят широкое техническое применение. Особенно велико оно для самой серной кислоты, громадные количества которой потребляются в промышленности — химической, нефтяной, металлургической и др. [6].
Для промышленного получения серной кислоты применяются два метода: нитрозный и контактный. Основным исходным продуктом в обоих случаях является сернистый газ, получаемый сжиганием на воздухе серы (в США) или пирита — FeS2 (в большинстве европейских стран, в том числе и России). Частично используется также SO2 отходящих газов, образующихся при выплавке металлов (Cu, Zn, Pb и др.) из их сернистых руд.
Горение пирита идет по уравнению:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3302 кДж Температура в печи достигает 800 С.
Обычный исходный газ сернокислотного производства содержит около 9% SO2, 10% O2 и 80% N2. При использовании для обжига пирита воздуха, обогащенного кислородом, концентрация SO2 возрастает.
Введение
более богатых диоксидом серы газов в сернокислотное производство позволяет резко повысить выход серной кислоты.
В качестве исходного сырья для производства серной кислоты может быть использован природный сульфат кальция. При сильном нагревании его в смеси с коксом протекает эндотермическая реакция:
CaSO4 + C + 392,92 кДж = CO + SO2 + CaO.
Процесс проводят в цилиндрических вращающихся печах, прогреваемых сжиганием угольной пыли. Температура в печи достигает 1500 С, отходящий газ содержит около 8% SO2. Если в состав исходной шихты дополнительно вводить нужные количества глины и песка, то одновременно с каждой тонной вырабатываемой серной кислоты можно получать более тонны цемента.
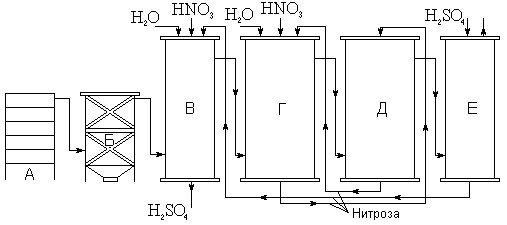
Рис. 6. Схема башенного метода получения серной кислоты
Нитрозный метод получения H2SO4 был впервые применён в середине XVIII века. Его химическая сущность может быть выражена следующими реакциями:
SO2 + H2O + NO2 = H2SO4 + NO.
2NO + O2 = 2NO2.
Из первого уравнения видно, что являющийся окислителем диоксид азота NO2 восстанавливается до монооксида NO, а последний при взаимодействии с кислородом воздуха по второму уравнению вновь даёт диоксид. Таким образом, NO играет роль переносчика кислорода, т. е. по существу катализатором реакции окисления SO2 кислородом воздуха.
До 20-х годов текущего века процесс получения серной кислоты нитрозным методом проводился в больших свинцовых камерах (камерный метод). Теперь он осуществляется в специальных башнях (башенный способ). Получаемая по башенному способу кислота, как правило, содержит 76% H2SO4 и несколько загрязнена различными примесями. Основным потребителем этой кислоты является промышленность минеральных удобрений.
Принципиальная схема башенного способа получения H2SO4 показана на рис. 6.
Другой современный метод получения серной кислоты — контактный — освоен промышленностью лишь в конце прошлого столетия. Основой его является упоминавшаяся выше реакция:
2SO2 + O2 2SO3 + 196 кДж.
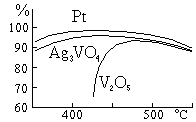
Рис. 7. Выход SO3 на катализаторах контактного метода
В присутствии платинового катализатора она около 400 С протекает слева направо практически полностью. Образующийся SO3 улавливают крепкой серной кислотой. Стоимость производства по контактному способу несколько выше, чем по нитрозному, зато серная кислота получается сколь угодно крепкой и очень чистой. Последнее обусловлено тщательной предварительной очисткой образующихся при сжигании пирита газов, что необходимо для обеспечения нормальной работы катализатора. Основными потребителями контактной серной кислоты являются различные химические производства и нефтепромышленность (для очистки нефтепродуктов). Для контактного метода в общей продукции серной кислоты с каждым годом всё более возрастает [1,7,8,10].
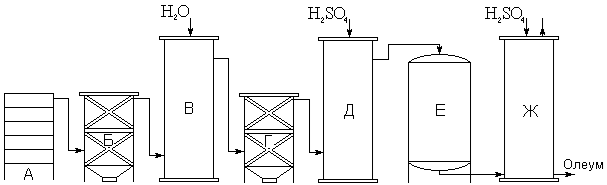
Рис. 8. Схема контактного метода получения серной кислоты
Серная кислота является важным продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей, минеральных удобрений и хлора. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, она используется для получения других кислот — соляной, плавиковой, фосфорной, уксусной и т. д. много ее идет для очистки нефтепродуктов — бензина, керосина и смазочных масел — от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрыванием (никелированием, хромированием и др.). Также применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и др. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками. Можно сказать, что серная кислота применяется почти во всех отраслях производства [5,8,11].
Полисерные кислоты — H2SO4•пSO3
При растворении SO3 в концентрированной серной кислоте образуется ряд полисерных кислот H2S2O7, Н2S3O10 и др. Смесь H2SO4, H2S2O7, H2S3O10, H2S4O13 и др. полисерных кислот — густая маслянистая жидкость, дымящая на воздухе (олеум), широко используется в промышленности. Под действием воды связи S? O?S политионовые кислоты превращаются в серную. Полисерной кислоте соответствует формула: H2SO4•пSO3.
Ди (пиро)серная кислота — H2S2O7
H2S2O7 — кристаллическое, бесцветное, гигроскопическое вещество. Температура плавления 350С. Является производной серной кислоты, она представлена формулой: H2S2O7 [4].
Нитрозилсерная кислота — [NO] [HSO4]
Это неустойчивое соединение, которое получается из оксида азота и H2SO4:
NO+NO2=N2O3.
N2O3+2H2SO4=2 [NO] [HSO4]+H2O.
Ее гидролиз дает азотистую кислоту:
[NO] [HSO4]+H2O=HNO2+H2SO4.