Подготовка и проведение испытаний

Эффективность и переносимость нового фармакологического средства сравнивают с таковыми плацебо или препарата аналогичного действия, являющегося одним из наиболее эффективных в данной группе. В зависимости от целей исследования, типа исследуемого препарата, характера заболевания применяют плацебо, стандартный препарат или и то и другое. Плацебо контролируемые испытания особенно важно проводить при… Читать ещё >
Подготовка и проведение испытаний (реферат, курсовая, диплом, контрольная)
антибиотик испытание лекарственный Не существует исследований, проведенных без ошибок, однако никогда нельзя нарушать правила проведения клинических испытаний:
- 1. Проводить исследование без тщательно разработанного протокола
- 2. Начинать исследования без одобрения его материалов независимым этическим комитетом
- 3. Включать пациента в исследование без получения письменного информированного согласия
- 4. Нарушать при проведении исследования требования протокола:
- — включать пациентов с нарушением критериев включения и исключения;
- — нарушать график посещений пациентов;
- — изменять схему приема исследуемых препаратов;
- — назначать запрещенные сопутствующие препараты;
- — проводить измерения (обследования) разными приборами, нарушать схему обследований
- — Не сообщать о нежелательных явлениях
При изучении нового лекарства всегда соблюдается последовательность проведения исследований: от клеток и тканей к животным, от животных к здоровым добровольцам, от небольшого числа здоровых добровольцев к больным.
Несмотря на несомненную ограниченность сведений, полученных при исследованиях на лабораторных животных, препарат исследуется на них, прежде чем будет впервые применен у человека (доклинические испытания). Основной их целью является получение информации о токсичности нового лекарства. Изучают острую токсичность при приеме одной дозы и подострую токсичность при многократном приеме препарата; исследуют мутагенность, влияние на репродуктивную и иммунную системы.
Далее проводятся клинические исследования, подразделяемые на четыре фазы.
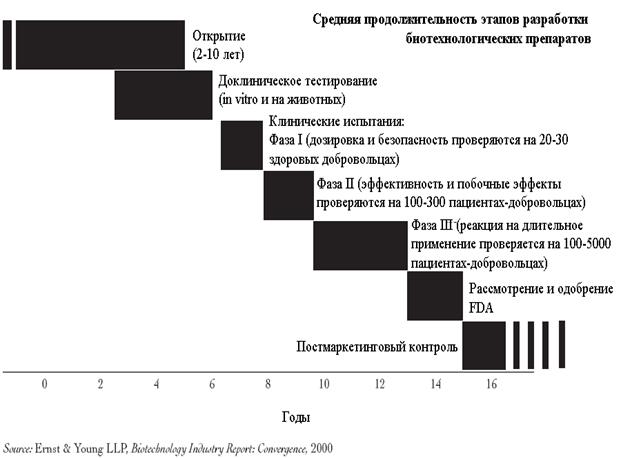
Как видно из таблицы, разделение на фазы позволяет проводить изучение нового лекарства у человека постепенно и последовательно. Вначале оно исследуется у небольшого числа здоровых добровольцев (I фаза) — (добровольцами могут быть только совершеннолетние), а далее на все большем и большем числе пациентов (II-III фазы). Недопустимо «перескакивать» через фазы клинических испытаний, изучение идет последовательно от I фазы к IV. Цели и задачи проводимых испытаний должны изменяться в зависимости от информации, полученной в ходе предыдущих исследований. Клинические исследования могут быть прекращены на любой фазе в случае появления данных о токсичности препарата.
Цель клинических испытаний — оценка терапевтической или профилактической эффективности и переносимости нового фармакологического средства, установление наиболее рациональных доз и схем его применения, а также сравнительная характеристика с уже существующими лекарственными средствами.
Программы клинических испытаний для разных групп препаратов могут значительно различаться. Однако некоторые основные положения должны быть всегда отражены. Четко следует сформулировать цели и задачи испытания; определить критерии выбора больных для испытания; указать метод распределения больных в основную и контрольную группы, число больных в каждой группе; метод установления эффективных доз препарата; длительность испытания; метод контролируемого испытания (открытый, «слепой», «двойной» и т. д.); препарат сравнения и плацебо; методы количественной оценки действия исследуемых препаратов (подлежащие регистрации показатели); методы статистической обработки полученных результатов.
Выбор пациентов для исследования в основном определяется его задачами и характером препарата. Обычно это больные, страдающие заболеваниями, для лечения которых предназначен новый препарат. С этической точки зрения, правильнее говорить не о выборе больного для испытания препарата, а о подборе исследуемого препарата для конкретного больного. На начальной стадии клинических испытаний новый препарат нельзя назначать больным, находящимся в тяжелом состоянии. На более поздних стадиях действие исследуемого средства должно быть изучено на больных различных возрастных групп, особенно в тех случаях, когда препарат предназначен для лечения заболеваний, часто встречающихся у пожилых людей.
Число больных для испытания различных препаратов определить довольно трудно. Оно во многом зависит от выраженности различий в действии исследуемого средства и препарата сравнения. Чем меньше это различие, тем большее число больных необходимо для получения достоверного результата.
Длительность применения исследуемого средства на людях не должна превышать периода, определенного на основании результатов токсикологических испытаний на животных Участвующие в испытании нового препарата больные должны находиться под постоянным наблюдением опытного персонала. Для уменьшения риска необходимо располагать высокочувствительными методами обнаружения фармакодинамических эффектов (ожидаемых и неожиданных).
Эффективность и переносимость нового фармакологического средства сравнивают с таковыми плацебо или препарата аналогичного действия, являющегося одним из наиболее эффективных в данной группе. В зависимости от целей исследования, типа исследуемого препарата, характера заболевания применяют плацебо, стандартный препарат или и то и другое. Плацебо контролируемые испытания особенно важно проводить при заболеваниях, течение которых во многом зависит от психологических факторов (вера в новый препарат и т. п.).
Результаты клинического испытания заносятся в индивидуальную стандартную карту для каждого больного, которая содержит минимум необходимых данных. В конце исследования полученные результаты суммируются, обрабатываются статистически и оформляются в виде отчета. Соответствующие показатели, полученные за один и тот же период времени в основной и контрольной группах, сопоставляются статистически. Для каждого показателя вычисляется средняя разность за изучаемый промежуток времени (по сравнению с исходным уровнем до лечения) и оценивается достоверность отмеченной динамики внутри каждой группы. Затем сравниваются средние разности величин конкретных показателей в основной и контрольных группах для оценки различия в действии исследуемого средства и плацебо или препарата сравнения.
Отчет о результатах клинических испытаний нового фармакологического средства оформляется в соответствии с требованиями Фармакологического комитета и представляется в комитет с конкретными рекомендациями.