Единицы измерения концентраций

Количество молекул углекислого газа в одном сантиметре кубическом воздуха при условии, что воздух и углекислый газ ведут себя как идеальные газы, можно определить, зная его объемную долю: Поскольку мольный объем газа меняется в зависимости от температуры и давления, при температуре Т и атмосферном давлении число молекул в кубическом сантиметре любого газа составит. Где р — парциальное давление… Читать ещё >
Единицы измерения концентраций (реферат, курсовая, диплом, контрольная)
В качестве единиц измерения концентраций используют следующие.
- 1. Объемные проценты показывают, сколько процентов общего объема смеси занимает данное вещество. Например, содержание кислорода в чистом воздухе составляет 20, 98%.
- 2. Млн-1 (ррm) и млрд-1 (ррb) — показывают количество объемов данной примеси в 1 млн (млрд) объемов газовой смеси.
- 3. Мг/м3, мкг/м3 — массовые концентрации, определяют массу примеси в единице объема газовой смеси.
- 4. Мол/см3 и мол/м3 — счетные концентрации, показывают число молекул в 1 см3 или 1 м3. Эти единицы могут также обозначаться следующим образом: см-3 и м-3.
- 5. Мольная концентрация измеряется в моль/л. Используется для жидких сред.
Для установления связи между единицами измерения концентрации приведем следующую задачу.
Задача В 80-х годах 20-го века среднегодовая концентрация углекислого газа (СО2) в атмосфере, приведенная к температуре 273 К и давлению воздуха 101,3 кПа, достигла 340 ррm. Определить значение концентрации СО2 в процентах, в см-3, в моль/л, в мг/м3 и парциальное давление углекислого газа в Па при средней температуре воздуха вблизи поверхности Земли.
Решение Концентрация СО2 в процентах С" ' = С" ?10-4,.
где С" - концентрация в ррm.
С" ' = 340 • 10-4 = 0,034% (об).
При нормальных условиях (н.у.) (t = 0 єC; р = 101,3 кПа) в каждом см3 газа содержится.
N0 = Na/Vм = 6,02• 1023/22,4 • 103 = 2,69 • 1019 (cм-3).
Число получается при делении числа Авогадро на объем, занимаемый одним молем газа, выраженный в см3.
Поскольку мольный объем газа меняется в зависимости от температуры и давления, при температуре Т и атмосферном давлении число молекул в кубическом сантиметре любого газа составит.
NТ = N0
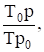
где NТ и N0 — число молекул в одном сантиметре кубическом данного газа при заданных и н. у соответственно; T0, р0, T, ртемпература и давление при н.у. и заданных условиях.
Средняя температура вблизи поверхности Земли равна 15 єС = 288 К. Тогда.
N15 =.
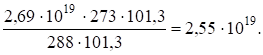
Количество молекул углекислого газа в одном сантиметре кубическом воздуха при условии, что воздух и углекислый газ ведут себя как идеальные газы, можно определить, зная его объемную долю:
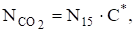
где С* — концентрация СО2 в ррm.
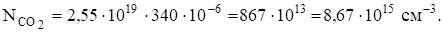
Определим парциальное давление СО2 в воздухе. Значения объемных концентраций примесей приводятся обычно в пересчете на сухой воздух, при определении парциального давления в реальных условиях следует учитывать парциальное давление паров воды, которые присутствуют в атмосферном воздухе. Поэтому рекомендуется пользоваться уравнением р = (рвозд.- рводы) • С'''/100,.
где р — парциальное давление примеси, кПа; рвозд — атмосферное давление, кПа; рводы — давление паров воды, кПа; С''' - концентрация примеси в %; 100 — коэфициент перевода % (об.) в доли.
Поскольку в условиях задачи отсутствуют данные о парциальном давлении паров воды в воздухе, проведем упрощенный расчет:
р = (рвозд•С''')/100;
р = (101,3•3,4•10-2)/100 = 35 (Па).
Количество молей СО2 в 1 л воздуха.
= n/V = m/мV = р/RT,.
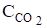
= 35/8,31•288•103 =1,46•10-5 моль/л.
Концентрация углекислого газа в мг/м3
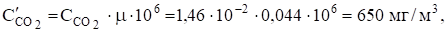
где м = 0,044 кг/м3 — молярная масса углекислого газа.