Взаимосвязь клинических признаков и патологоанатомических изменений.
Диагноз и дифференцированный диагноз

При выявлении антигена с его помощью используют противовирусные конъюгаты — конъюгаты, полученные из антител, выделенные из специфической сыворотки, и фермент. Например, культуру клеток, выращенную на покровных стеклах и инфицированную вирусом, или мазки-отпечатки фиксируют в течение 10 минут (например, охлажденным ацетоном), высушивают на воздухе и наносят иммунопероксидазный конъюгат в рабочем… Читать ещё >
Взаимосвязь клинических признаков и патологоанатомических изменений. Диагноз и дифференцированный диагноз (реферат, курсовая, диплом, контрольная)
Диагноз устанавливают на основании: эпизоотологических данных, клинических данных, патологоанатомических данных, результатов лабораторных исследований (обнаружение внутриядерных включений в мазках истечений изо рта, носа, глаз и выделение вируса в культуре клеток) Для уточнения диагноза ставят реакцию нейтрализации (РН) в культуре клеток почки или легкого котят, а также учитывают избирательную сохраняемость вируса при разных температурах.
При дифференциальной диагностике следует иметь в виду, что у кошек причиной респираторных поражений помимо вируса ринотрахеита могут быть: пикорнавирусы, реовирусы, микоплазмы, хламидии.
Дифференцируют болезнь от: калицивироза, хламидиоза.
При некотором сходстве этих инфекций для хламидиоза более типично проявление в виде лишь конъюнктивита, а для калицивироза — стоматита. Часто ринотрахеит кошек возникает в смешанной форме с калицивирусной инфекцией и панлейкопенией.
Лабораторная диагностика инфекционного ринотрахеита кошек:
1. Выделение вируса на культуре клеток.
В 1958 году Crandell and Maurer продемонстрировали, что вирус FHV-1 растет и вызывает цитопатический эффект в культуре клеток почки кошки, что позволило создать in vitro систему для выделения и изучения свойств FHV-1.
Для выделения вируса FHV-1 мазок берут с поверхности конъюнктивы или слизистой оболочки ротоглотки, обычно используют стерильные тампоны из хлопка или дакрона. Сразу после взятия пробы тампон помещают в пробирку с 1−1,5 мл вирусной транспортной среды с антибиотиками. При необходимости пробы замораживают и сохраняют при -70оС. Для выделения вируса обычно используют культуру клеток почки кошки CrFK, выращенную на плашках (рис. 2).
2. Полимеразная цепная реакция.
Важным этапом в совершенствовании методов диагностики инфекционных заболеваний явилась разработка методов, позволяющих обнаруживать гены или последовательности нуклеиновой кислоты, специфичные для определенного вида возбудителя инфекционного заболевания. Создание принципиально нового способа исследования, получившего название полимеразной цепной реакции (ПЦР), открыло новые возможности для эпидемиологического анализа инфекционных заболеваний.
Принцип ПЦР был описан в 1986 г. К. Мюллисом. В основе этого метода лежит многократное копирование с помощью фермента ДНК-полимеразы определенного фрагмента ДНК, являющегося маркерным для данного вида. Механизм копирования таков, что комплементарное достраивание нитей может начаться не в любой точке последовательности ДНК, а только в определенных стартовых блоках. Для создания стартовых блоков в заданных участках ДНК используют затравки — олигонуклеотиды длиной 20−30 нуклеотидных пар (праймеры). Они комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента и ориентированы таким образом, что синтез ДНК, осуществляемый ДНК-полимеразой, протекает только между ними. В результате происходит экспоненциальное увеличение количества копий специфического фрагмента по формуле 2n, где n — число циклов амплификации. Построение новых нитей ДНК из дезоксирибонуклеотидтрифосфатов осуществляет фермент термостабильная ДНК-полимераза. Процесс амплификации заключается в повторении циклов амплификации (состоящих из денатурации ДНК, отжига праймеров и построения фрагмента). В результате 30−35 циклов амплификации синтезируется 108 копий фрагментов, что делает возможным визуальный учет результатов после электрофореза в агарозном или акриламидном гелях. Использование термостабильной ДНК-полимеразы позволило автоматизировать процесс амплификации с помощью специального прибора, называемого термоциклером. Этот прибор автоматически осуществляет смену температур согласно заданной программе и числу циклов амплификации.
Метод ПЦР обладает высокой чувствительностью, дающей возможность обнаруживать единичные бактериальные клетки или вирусные частицы. Но это преимущество ПЦР уместно рассматривать при сравнении с другими молекулярно-генетическими или иммунологическими методами диагностики. Однако высочайшая чувствительность ПЦР обычно достигается при работе с чистой культурой микроба или, что еще лучше, с очищенной нуклеиновой кислотой. Эта чувствительность автоматически не трансформируется в чувствительность метода при работе с клиническим материалом. На успех определения при работе с этим материалом влияют такие факторы, как методика приготовления образца, возможное присутствие ингибитора фермента, осуществляющего амплификацию, объем образца при низких концентрациях тестируемых молекул.
Метод ПЦР превосходит метод выделения вируса на культурах клеток, особенно в случае бактериальной контаминации, которая мешает традиционной технике культивирования; более чувствителен и менее трудоемок.
Наличие вторичной бактериальной и грибковой инфекции может осложнять и маскировать первичную вирусную инфекцию, затрудняя клиническую диагностику. Таким образом, существенным является возможность определения вирусных протеинов или вирусной ДНК для подтверждения диагноза первичной вирусной инфекции. ПЦР может являться одним из методов подтверждения FHV-1 инфекции в гистологических образцах в подозрительных случаях.
К сожалению, диагностика FHV-1 инфекции с помощью ПЦР-амплификации имеет ограниченную клиническую ценность, поскольку могут выявляться латентные инфекции, широко распространенные у кошек, таким образом, невозможно будет определить, играет ли FHV-1 первичную роль в возникновении заболевания, или же он просто реактивировался из латентного состояния под действием стресса или сопутствующей инфекции. Немалую роль в ограничении использования ПЦР является дороговизна оборудования и реактивов, высокая требовательность к качеству реактивов, строжайшие требования к помещениям и организации работы в ПЦР-лаборатории для исключения контаминации образцов продуктами амплификации.
3. Реакция иммунофлуоресценции.
РИФ, предложенную Кунсом еще в 1942 году, трудно отнести к новым методам исследования. Но благодаря появлению гибридомных технологий, позволяющих получать моноклональные антитела, РИФ получила в настоящее время вторую жизнь, ее чувствительность и специфичность значительно увеличены.
Популярность РИФ объясняется экономичностью, наличием широкого спектра диагностических наборов, быстротой получения ответа. Чаще всего она используется для быстрого обнаружения возбудителя в патологическом материале. В этом случае из исследуемого материала как для обычной микроскопии готовят мазок на предметном стекле. Препарат фиксируют метиловым спиртом, ацетоном или другим химическим фиксатором, иногда входящим в состав диагностического набора. На поверхность фиксированного мазка наносят меченые ФИТЦ сыворотки или моноклональные антитела (в случае непрямой РИФ сначала препарат обрабатывают сывороткой против искомого антигена, а затем мечеными антителами к иммуноглобулинам, использованным на первом этапе (антивидовыми)). Поскольку РИФ является разновидностью гетерогенного анализа, один этап отделяется от другого промывкой.
Учет результатов реакции осуществляется с помощью люминесцентного микроскопа, в оптическую систему которого устанавливается набор светофильтров, обеспечивающих освещение препарата ультрафиолетовым или сине-фиолетовым светом с заданной длиной волны. Это заставляет флюорохром светиться в заданном диапазоне спектра. Исследователь оценивает характер свечения, форму, размер объектов и их взаимное расположение.
Если прямая РИФ может использоваться только для обнаружения антигена, то непрямой вариант этой реакции может быть использован помимо обнаружения антигена и для обнаружения антител. В этом случае готовят мазки из эталонного штамма возбудителя. Исследуемую сыворотку наносят на мазок. Если в ней присутствуют искомые антитела, то они связываются с антигенами микробных клеток. Промывка препарата буферным раствором позволяет удалить несвязанные антитела. Затем препарат обрабатывают меченой сывороткой против иммуноглобулинов (антивидовой). В случае положительного результата реакции при микроскопии мазка в люминесцентном микроскопе наблюдают специфическое свечение эталонной культуры.
В ветеринарной вирусологии РИФ активно используется для диагностики следующих вирусных заболеваний:
- — вирус бешенства (непрямая),
- — вирус иммунодефицита КРС (непрямая),
- — коронавирус собак (непрямая),
- — чума собак (непрямая),
- — инфекционный перитонит (коронавирус) кошек (прямая),
- — респираторный и репродуктивный синдром свиней (прямая).
РИФ является чрезвычайно ценным методом при диагностике FHV-1, при этом используют оба варианта РИФ. Для обнаружения вируса обычно берут эпителиальные клетки конъюнктивы (конъюнктивальную полость перед взятием пробы очищают от слизи и гнойных выделений), скарифицируют их под местной анестезией. При необходимости скарифицируют и эпителиальные клетки роговицы. Скарифицированные клетки помещают на предметное стекло, высушивают при комнатной температуре и фиксируют в ацетоне в течение 10 минут (рис. 4).
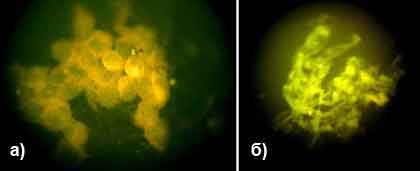
Рис. 3. РИФ при диагностике FHV-1:
- а). Клетки, инфицированные вирусом FHV-1;
- б). Скопление клеточных мембран инфицированных клеток.
- 4. Гистохимический вариант ИФА или иммунопериксидазная реакция.
Иммунопероксидазная реакция аналогична методу иммунофлуоресценции, но отличается тем, что для постановки реакции используют антитела, меченные не флуорохромом, а ферментом, и учет реакции проводят не под люминесцентным, а под обычным световым микроскопом. Обычно, в этом варианте ИФА используют антитела, меченые пероксидазой. Материалом для выявления вирус-специфических антигенов или вирусов с помощью иммунопероксидазной реакции могут служить: мазки-отпечатки различных органов, парафиновые срезы, культура клеток, мазки крови. Аналогично РИФ иммунопероксидазную реакцию ставят в прямом и непрямом вариантах.
Прямой пероскидазный тест.
При выявлении антигена с его помощью используют противовирусные конъюгаты — конъюгаты, полученные из антител, выделенные из специфической сыворотки, и фермент. Например, культуру клеток, выращенную на покровных стеклах и инфицированную вирусом, или мазки-отпечатки фиксируют в течение 10 минут (например, охлажденным ацетоном), высушивают на воздухе и наносят иммунопероксидазный конъюгат в рабочем разведении. Инкубируют 1−2 часа при 37оС во влажной камере, ополаскивают дистиллированной водой и высушивают на воздухе. Наносят несколько капель раствора субстрата — диаминобензидинтетрахлорида, инкубируют 5−10 минут и промывают 10−15 минут в физиологическом растворе и ополаскивают дистиллированной водой.
В положительных случаях, то есть при наличии антигена в исследуемом препарате после нанесения иммунопероксидазного конъюгата образуется комплекс антиген-антитело, помеченный ферментом. После нанесения на препарат раствора субстрата, последний под действием фермента разлагается, образуя цветной продукт ферментативной реакции, хорошо видный в световом микроскопе.
Результаты учитывают с помощью светового микроскопа. Диаминобензидинтетрахлорид под действием пероксидазы разлагается, образуя продукт реакции голубого цвета, который быстро приобретает коричневый окрас. В препарате видны или диффузное желто-коричневое окрашивание, или гранулы коричнево-черного цвета. Вирус-специфический антиген в мазках и гистосрезах обнаруживают тем же способом.
Непрямой пероскидазный тест.
Используют антивидовые иммунопероксидазные конъюгаты. Преимуществом непрямого метода является универсальность меченых антивидовых глобулинов, а также большая чувствительность его по сравнению с прямым тестом. Методика его постановки отличается двумя этапами: на исследуемый образец наносят специфическую для исследуемого антигена сыворотку, после инкубации и промывания наносят антивидовой пероксидазный конъюгат в рабочем разведении и инкубируют при 37оС 1 час. Далее следуют этапы, описанные в разделе о прямом методе. При наличии в исследуемом материале вирус-специфического антигена после внесения специфической сыворотки образуется комплекс антиген-антитело, для выявления которого используют антивидовые или вторичные антитела, меченые ферментом; образуется более сложный, чем в первом случае, комплекс «антиген-антитело-вторичное антитело-фермент». Полученный комплекс выявляют добавлением субстрата, который под действием фермента разлагается, образуя цветной продукт ферментативной реакции. Учет результатов, как и в первом случае, проводят под световым микроскопом.
Иммунопероксидазная реакция в прямом и непрямом вариантах используется для выявления вирусов бешенства, ящура, герпесвирусов, энтеровирусов и др. На сегодняшний день, вероятно, это наиболее ценный метод для экспресс-диагностики FHV-1. Он позволяет получить четкий и быстрый диагноз, дает возможность обнаруживать как FHV-1-антиген, так и антитела к нему в мазках, мазках-отпечатках, смывах, образцах тканей и т. д. Постановка иммунопероксидазных тестов требует минимального количества реактивов и оборудования, не требует стерильности, проста в исполнении, может проводиться в любой лаборатории при наличии обычного светового микроскопа.
5. Иммуноферментный анализ.
ИФА — специфичный и универсальный метод, отличающийся высокой чувствительностью, удобный для автоматизации и стандартизации реагентов. В ИФА первый известный компонент (антитело или антиген) сорбируют на твердую фазу. Следующие компоненты, включая исследуемые пробы, вносят последовательно в жидком растворенном виде. Сформировавшиеся после инкубации иммунные комплексы антиген-антитело отделяют от непрореагировавших компонентов реакции при отмывании планшет. В ИФА используют противовирусные или антивидовые антитела, меченые пероксидазой хрена (ПХ) или другими ферментами, которые затем выявляются различными субстратами (диаминобензидин, 5-аминосалициловая кислота, о-фенилендиамин). Изменение цвета регистрируется визуально или спектрофотометрически, что дает возможность проводить количественный учет результатов анализа.
Разработаны различные варианты ИФА: прямые, непрямые, методы блокирования и конкурентные. В прямых вариантах используют меченые ферментом противовирусные антитела, в непрямых — антивидовые конъюгаты. В конкурентном варианте и методе блокирования типирование и титрование исследуемых антигенов и антител обеспечивается за счет вытеснения с их помощью определенного количества меченого антигена или антитела.
Для обнаружения антител к FHV-1 ИФА ставят на многолуночных микротитровальных плашках, сенсибилизированных антигеном FHV-1 по стандартной методике. Используют как моноклональные антитела, так и поликлональные анти-кошачьи IgG, в качестве ферментной метки чаще всего используют пероксидазу хрена. Определения показателя абсорбции проводят на автоматическом ИФА-ридере с фильтром 492 нм.
ИФА — универсальный, и на сегодняшний день наиболее чувствительный и совершенный метод определения антител к FHV-1 у кошек. Он позволяет определять уровень антител как в сыворотке крови, так и во внутриглазной и спинномозговой жидкостях, что необходимо при проведении любых научных и научно-практических исследований. С помощью ИФА можно проводить контроль эффективности вакцин против FHV-1 и иммунных сывороток, определять напряженность иммунитета, что позволяет оценить степень защиты животных от заражения и заболевания и т. д.
Дифференциальный диагноз.
Название органа. | Инфекционный ринотрахеит. | Хламидиоз. | Панлейкопения. | |
Течение болезни. | Остро, подстро, хронический. | Чаще патологическое. | Острое, сверхострое и субклиническое. | |
Селезенка. | Увеличена, края заостренные, тёмнокрасного цвета. | Спленомегалия. | ||
Печень. | Без изменений. | Увеличена, рыхлой консистенции. | ||
Легкие. | неспавшиеся, края заострены. | |||
Сердце. | Сердце не увеличено, верхушка раздвоена. | |||
Желудок. | В объёме не увеличен, слизистая покрасневшая, набухшая, к изъязвлениями. | |||
Тонкий кишечник. | точечные кровоизлияния, несколько расширена местами, содержимое зловонное, водянистое, жел-товато-серого цвета. | |||
Толстый кишечник. | точечные кровоизлияния. | |||
Лимфати-ческие узлы. | увеличены. | Резко увеличегы, отечны. | Увеличенные, гиперемированы. | |