Альтернативная модель расчетов значений атомных радиусов

Вяткин В. Б. Информационно-синергетический анализ электронных систем атомов химических элементов. Часть 1. Структурная организация электронных систем в плоскости подоболочек / В. Б. Вяткин // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) — Краснодар: КубГАУ. 2009. — № 48 (4). С. 1−21. Примем допустимым значение… Читать ещё >
Альтернативная модель расчетов значений атомных радиусов (реферат, курсовая, диплом, контрольная)
Альтернативная модель расчетов значений атомных радиусов
В статье представлены результаты разработки альтернативной модели расчетов значений атомных радиусов. Была выведена формула для расчетов величин атомных радиусов элементов Периодической системы Д. И. Менделеева. Найдены оптимальные условия расчета по предложенной модели. Показано, что кривая зависимости значения поправочного коэффициента х от атомного номера элемента по форме совпадает с зависимостью энергии ионизации от зарядового числа В настоящее время существуют различные методы расчета атомных радиусов химических элементов Периодической системы Д. И. Менделеева. Для определения атомных радиусов используют рентгенографический и газокинетический методы [1]. В работе [2] рассматривается определение размеров атомов по их инфракрасным спектрам, излучаемым в газообразном состоянии. Также существуют и теоретические модели определения атомных радиусов [3−9]. В настоящей работе предложен новый метод расчета атомных радиусов.
В настоящей работе предложена альтернативная формула для расчетов величин атомных радиусов элементов Периодической системы Д. И. Менделеева.
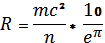
(1).
где: R — радиус атома, м;
m — масса атома, кг;
с — скорость света в вакууме, м/с;
n — порядковый номер элемента;
eр — постоянная Гельфонда из [10], в размерности [с2/кг*м].
Проверим применимость данной формулы для 103 элементов Периодической таблицы Расчет относительной погрешности проводился по методике, описанной в [11]. Данные приведены в таблице 1.
Таблица 1. Расчет атомных радиусов и оценка применимости модели расчетов
Порядковый номер | Символ элемента. | Атомная масса [12], а.е.м. | Значения атомного радиуса [4,5,13], 10-12 м. | Рассчитанные значения атомного радиуса, 10-12 м. | Относительная погрешность, д, %. | |
H. | ||||||
He. | ||||||
3*. | Li. | |||||
Be. | ||||||
B. | ||||||
C. | ||||||
N. | ||||||
O. | ||||||
F. | ||||||
Ne. | ||||||
Na. | ||||||
Mg. | ||||||
13*. | Al. | |||||
14*. | Si. | |||||
15*. | P. | |||||
16*. | S. | |||||
Cl. | ||||||
Ar. | ||||||
K. | ||||||
Ca. | ||||||
Sc. | ||||||
22*. | Ti. | |||||
23*. | V. | |||||
24*. | Cr. | |||||
25*. | Mn. | |||||
26*. | Fe. | |||||
27*. | Co. | |||||
28*. | Ni. | |||||
29*. | Cu. | |||||
30*. | Zn. | |||||
31*. | Ga. | |||||
Ge. | ||||||
33*. | As. | |||||
34*. | Se. | |||||
Br. | ||||||
Kr. | ||||||
Rb. | ||||||
Sr. | ||||||
Y. | ||||||
40*. | Zr. | |||||
41*. | Nb. | |||||
42*. | Mo. | |||||
43*. | Tc. | |||||
44*. | Ru. | |||||
45*. | Rh. | |||||
46*. | Pd. | |||||
47*. | Ag. | |||||
48*. | Cd. | |||||
In. | ||||||
50*. | Sn. | |||||
51*. | Sb. | |||||
52*. | Te. | |||||
53*. | I. | |||||
Xe. | ||||||
Cs. | ||||||
Ba. | ||||||
La. | ||||||
Ce. | ||||||
Pr. | ||||||
Nd. | ||||||
Pm. | ||||||
Sm. | ||||||
Eu. | ||||||
Gd. | ||||||
Tb. | ||||||
Dy. | ||||||
Ho. | ||||||
Er. | ||||||
Tm. | ||||||
Yb. | ||||||
Lu. | ||||||
72*. | Hf. | |||||
73*. | Ta. | |||||
74*. | W. | |||||
Re. | ||||||
Os. | ||||||
Ir. | ||||||
Pt. | ||||||
79*. | Au. | |||||
80*. | Hg. | |||||
81*. | Tl. | |||||
82*. | Pb. | |||||
83*. | Bi. | |||||
84*. | Po. | |||||
85*. | At. | |||||
Rn. | ||||||
Fr. | ||||||
Ra. | ||||||
Ac. | ||||||
Th. | ||||||
91*. | Pa. | |||||
U. | ||||||
Np. | ||||||
94*. | Pu. | |||||
95*. | Am. | |||||
Cm. | ||||||
Bk. | ||||||
Cf. | ||||||
Es. | ||||||
Fm. | ||||||
Md. | ||||||
No. | ||||||
Lr. | ||||||
* - элементы, входящие в область допустимых значений относительной погрешности (10 (±1)%).
Примем допустимым значение относительной погрешности равным 10 (±1)%. Тогда из данных, приведенных в таблице, можно наблюдать следующее: в область допустимых значений входят р-элементы III-VI периодов, за исключением 17 и 18 группы, а также d-элементы, исключая Sc, Ge, In, Re, Os, Ir. Их можно отнести к области условно-домустимых значений относительной погрешности (до 15%).
Для f-элементов (лантаноидов) значение относительной погрешности не превышает 20%, за исключением Eu и Yb. Для актиноидов в область допустимых значений входит Th, Pa, Pu, Am, в область условно-допустимых — Ac, U, Np. Элементы с порядковым номерами 96−103 имеют значения относительной погрешности 42−46%, что является недопустимым. Также показано, что использование формулы 1 для элементов 1, 2, 17, 18 групп не корректно (за исключением Li). В связи с этим становится актуальным подбор оптимальных условий расчета атомных радиусов. Данную задачу попробуем решить обратным методом.
Заменим степень постоянной Гельфонда с р на х и найдем значение х:
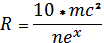
(2).
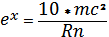
(3).
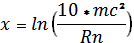
(4).
Используя формулы 2−4 рассчитаем значения коэффициента х для каждого элемента Периодической системы Д. И. Менделеева. Данные по расчету коэффициента х приведены в таблице 2.
Таблица 2. Расчет коэффициентов х для элементов Периодической таблицы Д.И. Менделеева
Порядк. номер | Символ элемента. | Атомн. масса [12], а.е.м. | Атомн. радиус [4,5,13], 10-12 м. | Значение коэф-та x. | Рассч. знач. атомн. рад., с использ. к-та х, 10-12 м. | Относит. погрешность. | |
H. | 3,35. | 0,010. | |||||
He. | 4,57. | 0,014. | |||||
Li. | 3,17. | 0,010. | |||||
Be. | 3,40. | 0,010. | |||||
B. | 3,49. | 0,011. | |||||
C. | 3,66. | 0,011. | |||||
N. | 3,48. | 0,010. | |||||
O. | 3,91. | 0,012. | |||||
F. | 3,76. | 0,011. | |||||
Ne. | 4,37. | 0,013. | |||||
Na. | 2,80. | 0,008. | |||||
Mg. | 2,94. | 0,009. | |||||
Al. | 3,08. | 0,009. | |||||
Si. | 3,12. | 0,009. | |||||
P. | 3,18. | 0,010. | |||||
S. | 3,16. | 0,010. | |||||
Cl. | 3,45. | 0,010. | |||||
Ar. | 3,84. | 0,012. | |||||
K. | 2,57. | 0,008. | |||||
Ca. | 2,72. | 0,008. | |||||
Sc. | 2,98. | 0,009. | |||||
Ti. | 3,09. | 0,009. | |||||
V. | 3,21. | 0,010. | |||||
Cr. | 3,21. | 0,010. | |||||
Mn. | 3,25. | 0,010. | |||||
Fe. | 3,24. | 0,010. | |||||
Co. | 3,26. | 0,010. | |||||
Ni. | 3,23. | 0,010. | |||||
Cu. | 3,24. | 0,010. | |||||
Zn. | 3,16. | 0,010. | |||||
Ga. | 3,17. | 0,010. | |||||
Ge. | 3,32. | 0,010. | |||||
As. | 3,19. | 0,010. | |||||
Se. | 3,21. | 0,010. | |||||
Br. | 3,59. | 0,011. | |||||
Kr. | 3,68. | 0,011. | |||||
Rb. | 2,63. | 0,008. | |||||
Sr. | 2,77. | 0,008. | |||||
Y. | 2,95. | 0,009. | |||||
Zr. | 3,06. | 0,009. | |||||
Nb. | 3,14. | 0,009. | |||||
Mo. | 3,20. | 0,010. | |||||
Tc. | 3,23. | 0,010. | |||||
Ru. | 3,24. | 0,010. | |||||
Rh. | 3,24. | 0,010. | |||||
Pd. | 3,23. | 0,010. | |||||
Ag. | 3,17. | 0,010. | |||||
Cd. | 3,12. | 0,009. | |||||
In. | 3,05. | 0,009. | |||||
Sn. | 3,08. | 0,009. | |||||
Sb. | 3,11. | 0,009. | |||||
Te. | 3,13. | 0,009. | |||||
I. | 3,27. | 0,010. | |||||
Xe. | 3,51. | 0,011. | |||||
Cs. | 2,60. | 0,008. | |||||
Ba. | 2,80. | 0,008. | |||||
La. | 2,97. | 0,009. | |||||
Ce. | 2,99. | 0,009. | |||||
Pr. | 2,97. | 0,009. | |||||
Nd. | 2,98. | 0,009. | |||||
Pm. | 2,98. | 0,009. | |||||
Sm. | 3,00. | 0,009. | |||||
Eu. | 2,90. | 0,009. | |||||
Gd. | 3,02. | 0,009. | |||||
Tb. | 3,01. | 0,009. | |||||
Dy. | 3,02. | 0,009. | |||||
Ho. | 3,02. | 0,009. | |||||
Er. | 3,03. | 0,009. | |||||
Tm. | 3,03. | 0,009. | |||||
Yb. | 2,94. | 0,009. | |||||
Lu. | 3,04. | 0,009. | |||||
Hf. | 3,10. | 0,009. | |||||
Ta. | 3,21. | 0,010. | |||||
W. | 3,27. | 0,010. | |||||
Re. | 3,30. | 0,010. | |||||
Os. | 3,32. | 0,010. | |||||
Ir. | 3,31. | 0,010. | |||||
Pt. | 3,29. | 0,010. | |||||
Au. | 3,25. | 0,010. | |||||
Hg. | 3,17. | 0,010. | |||||
Tl. | 3,09. | 0,009. | |||||
Pb. | 3,07. | 0,009. | |||||
Bi. | 3,10. | 0,009. | |||||
Po. | 3,05. | 0,009. | |||||
At. | 3,24. | 0,010. | |||||
Rn. | 2,89. | 0,009. | |||||
Fr. | 2,52. | 0,008. | |||||
Ra. | 2,68. | 0,008. | |||||
Ac. | 3,01. | 0,009. | |||||
Th. | 3,06. | 0,009. | |||||
Pa. | 3,16. | 0,010. | |||||
U. | 3,33. | 0,010. | |||||
Np. | 3,38. | 0,010. | |||||
Pu. | 3,17. | 0,010. | |||||
Am. | 3,09. | 0,009. | |||||
Cm. | 2,55. | 0,008. | |||||
Bk. | 2,55. | 0,008. | |||||
Cf. | 2,56. | 0,008. | |||||
Es. | 2,57. | 0,008. | |||||
Fm. | 2,58. | 0,008. | |||||
Md. | 2,59. | 0,008. | |||||
No. | 2,59. | 0,008. | |||||
Lr. | 2,61. | 0,008. | |||||
Таким образом, удалось снизить относительную погрешность расчетов, однако остается неизвестным зависимость коэффициента х и способы его выражения через другие характеристики атома, что требует дополнительных исследований данного вопроса.
Оценим изменение коэффициента х в Периодической таблице Д. И. Менделеева. Для этого построим график зависимости х=f (n). Данные приведены на рисунке 1.
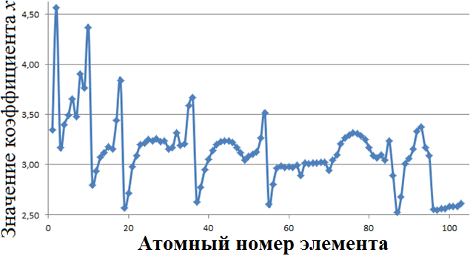
Рисунок 1 — Зависимость значения коэффициента х уравнения 2 от атомного номера элемента.
Зависимость, представленная на рисунке 1, по форме напоминает зависимость энергии ионизации (I) от атомного номера, представленная в работах [14, 15], а также, зависимость R-функции от заряда ядра [16, 17], что, вероятно, связано с тем, что коэффициент х связан с данными характеристиками атома.
Выводы
Предложен альтернативный метод расчета значений атомных радиусов, учитывающий массу атома и его атомный номер. Найдены оптимальные условия расчета по предложенной модели.
Показано, что кривая зависимости значения поправочного коэффициента х от атомного номера элемента по форме совпадает с зависимостью энергии ионизации от зарядового числа, а также, с зависимостью R-функции от заряда ядра.
- 1. Зефиров Ю. В., Зоркий П. М. Ван-дер-ваальсовы радиусы и их применение в химии // Успехи химии. 1989. Т.58, вып. 5. С.713−746.
- 2. Серков А. Т., Радишевский М. Б., Серков А. А. Гипотезы-2 / Москва: НИЦ «Углехимволокно», 2016. 363 с.
- 3. Нигматов Х., Турсунбаев Б. Х. Методика расчета радиуса атома водорода и других элементов Таблицы Менделеева // Инновации в науке: научный журнал. № 8(69). Новосибирск. Изд. АНС «СибАК», 2017. С. 17−19.
- 4. Clementi E. Atomic Screening Constants from SCF Functions. II. Atoms with 37 to 86 Electrons // Journal of Chemical Physics, 1967. V.47 (4). P.1300−1307.
- 5. Bagnall K.W. Recent advances in actinide and lanthanide chemistry, in Fields, PR & Moeller, T, Advances in chemistry, Lanthanide/Actinide chemistry // American Chemical Society, 1967. Vol. 71. P.1−12.
- 6. Казаченко А. С. Разработка новой модели расчетов значений атомных радиусов / Казаченко А. С., Шилов П. Н. // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) — Краснодар: КубГАУ, 2017. — № 07(131).
- 7. Pershina V. Electronic structure and chemical properties of superheavy elements // Russ. Chem. Rev. V.78. P.1153−1171
- 8. Johnson E., Fricke B., Jacob T., Dong C.Z., Fritzsche S., Pershina V. Ionization potentials and radii of neutral and ionized species of elements 107 «bohrium… and 108 «hassium… from extended multiconfiguration Dirac-Fock calculations // Journal of Chemical Physics. V.116. № 5. P. 1862−1868.
- 9. Desclaux J.P. Relativistic Dirac-Fock expectation values for atoms with Z = 1 to Z = 120 // Atomic data and nuclear data tables. 1973. V. 12, P. 311−406
- 10. Borwein J.M., Bailey D.H. Mathematics by Experiment: Plausible Reasoning in the 21st Century // Wellesley, MA: AK Peters, 2003. P. 137.
- 11. Ефимова М. Р. Общая теория статистики // М.: ИНФРА. 1996. 416 c.
- 12. Wieser M.E. Atomic weights of the elements 2011 (IUPAC Technical Report) // Pure and Applied Chemistry, 2013. V. 85 (5). P. 1047—1078.
- 13. Slater J.C. Atomic Radii in Crystals // Journal of Chemical Physics, 1964. V.41 (10). P.3199−3205.
- 14. Ахметов Н. С. Актуальные вопросы курса неорганической химии // М.:Просвещение, 1991. 224 с.
- 15. Martin W.C., Musgrove A., Kotochigova S., Sansonetti J.E. (2011), Ground Levels and Ionization Energies for the Neutral Atoms (version 1.3). National Institute of Standards and Technology, Gaithersburg, MD.
- 16. Луценко Е. В. Универсальный информационный вариационный принцип развития систем / Е. В. Луценко // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) — Краснодар: КубГАУ, 2008. — № 07(041). С. 117 — 193.
- 17. Вяткин В. Б. Информационно-синергетический анализ электронных систем атомов химических элементов. Часть 1. Структурная организация электронных систем в плоскости подоболочек / В. Б. Вяткин // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) — Краснодар: КубГАУ. 2009. — № 48 (4). С. 1−21.