Способы комплексонометрического титрования
Обратное титрование (по остатку) — менее удобно, чем прямое, однако к нему приходится прибегать, когда для прямого титрования нельзя подобрать соответствующий индикатор, или когда катионы металла очень медленно взаимодействуют с титрантом, или когда при благоприятных значениях рН определяемый ион металла осаждается в виде гидроксидов. Во всех этих случаях к титруемому раствору прибавляют точно… Читать ещё >
Способы комплексонометрического титрования (реферат, курсовая, диплом, контрольная)
Известны следующие четыре способа проведения комплексонометрического титрования — прямое титрование, обратное титрование (по остатку), титрование по способу вытеснения (замещения), косвенное титрование.
Прямое титрование — наиболее распространенный прием, когда к анализируемому раствору, содержащему ион определяемого металла, прибавляют рабочий раствор комплексона (титрант) до тех пор, пока не будет дотигнута точка эквивалентности, которую устанавливают с помощью индикатора. Прямое титрование удобно применять если есть возможность подобрать соответствующий индикатор и взаимодействие иона металла с комплексоном протекает достаточно быстро.
По результатам титрования рассчитывают содержание определяемого элемента. Расчеты в комплексонометрии можно проводить по закону эквивалентов, как это делается в других методах титрования. При этом следует учитывать, что при взаимодействии иона металла в любой степени окисления с комплексоном (ЭДТА) выделяется два иона водорода:
Mn++ H2Y2- MYn-4+ 2H+
Поэтому факторы эквивалентности ЭДТА и иона металла, независимо от его заряда, всегда равны Ѕ. Уравнение материального баланса в этом случае в соответствии с законом эквивалентов выглядит следующим образом:
n (½Mn+) = n (½H2Y2-) (7.1)
Поскольку по уравнению реакции на 1 моль металла всегда приходится 1 моль комплексона, то расчеты можно производить также исходя из равенства числа моль или миллимоль, учитывая при необходимости стехиометрические коэффициенты.
Пример 6. Какую навеску металлического цинка следует растворить в серной кислоте при определении точной концентрации 0,010 М раствора трилона Б с помощью макробюретки объёмом 25 мл: а) методом отдельных навесок; б) методом аликвотных частей (пипетирования), используя для этого мерную колбу и пипетку номинальным объёмом 100 и 10 мл соответственно? Рассчитать относительную погрешность взвешивания навески цинка на аналитических весах в обоих случаях.
Решение.
Zn2++ H2Y2- ZnY2-+ 2H+
Для расчета используем объём раствора комплексона равный 80% от объёма бюретки V (H2Y2-) = 0,8· 25 = 20 мл.
а) метод отдельных навесок:
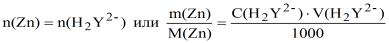
тогда m (Zn) = 0,010· 20·65,37·10-3= 0,013 г и.
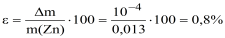
б) метод аликвотных частей:
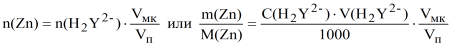
тогда m (Zn) = 0,010· 20·65,37·10-3·10 = 0,13 г и.
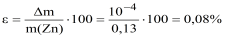
Пример 7. Рассчитать массовую долю (%) сульфата железа () в образце, если после растворения его навески массой 0,2862 г в кислой среде на титрование израсходовали 22,38 мл 0,05 М (К = 1,018) раствора трилона Б.
Решение.
Fe3++ H2Y2- FeY-+ 2H+
В одной молекуле Fe2(SO4)3 содержится два атома железа, тогда:
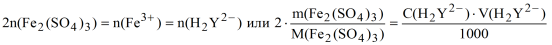
m (Fe2(SO4)3) = 0,05· 1,018·22,38·399,88·10-3/2 = 0,2278 г.
( Fe2(SO4)3) =
Задачу можно решить и по закону эквивалентов, тогда: n (¼Fe2(SO)4) = n (½H2Y2-).
Обратное титрование (по остатку) — менее удобно, чем прямое, однако к нему приходится прибегать, когда для прямого титрования нельзя подобрать соответствующий индикатор, или когда катионы металла очень медленно взаимодействуют с титрантом, или когда при благоприятных значениях рН определяемый ион металла осаждается в виде гидроксидов. Во всех этих случаях к титруемому раствору прибавляют точно известный избыток комплексона, раствор выдерживают некоторое время для завершения реакции или ускоряют процесс нагреванием. Затем избыток комплексона титруют рабочим раствором соли другого металла (M'), для которого реакция с комплексоном соответствует всем требованиям, предъявляемым к реакциям комплексонометрического титрования. При обратном титровании комплексонат определяемого металла на определение точки эквивалентности практически не влияет, так как он образуется медленно и также медленно разрушается.
При обратном титровании уравнение материального баланса имеет вид:
n (H2Y2-) = n (Mn+) + n (M'n+)
или через эквиваленты:
n (½H2Y2-) = n (½Mn+) + n (½M'n+)
Пример 8. Рассчитать массу алюминия в анализируемом растворе, если к этому раствору при рН=5 добавили 20,00 мл 0,4 520 М раствора трилона Б, затем после окончания реакции добавили аммиак до рН=9 (образовалась аммонийная буферная смесь) и остаток комплексона, не вступивший в реакцию с алюминием, оттитровали с металлохромным индикатором эриохромом черным Т, затратив 6,050 мл 0,5 000 М раствора сульфата цинка.
Решение.
Al3++ H2Y2-изб AlY-+ 2H++ (H2Y2-ост)
H2Y2-ост + Zn2+ ZnY2-+ 2H+
Составляем уравнение материального баланса.
n (H2Y2-) = n (Al) + n (ZnSO4)
тогда:
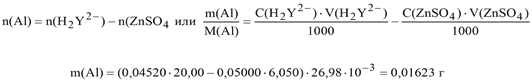
Титрование по способу вытеснения (замещения) — применяют в тех же случаях, что и обратное титрование. При вытеснительном (заместительном) титровании к анализируемому раствору, содержащему ион определяемого металла, прибавляют избыток комплексоната другого металла, условная константа устойчивости которого в данной среде меньше таковой для определяемого металла. Обычно применяют комплексонат магния, константа устойчивости которого lgK (MgY2-) = 8,7 (табл.1) значительно меньше, чем для большинства металлов. При этом протекает реакция замещения, после чего вытесненные ионы магния титруют при рН=9 раствором ЭДТА с металлохромным индикатором эриохромом черным Т:
Mn++ MgY2- MYn-4+ Mg2+
Mg2++ H2Y2- MgY2-+ 2H+
Чем больше разница в константах устойчивости MYn-4 и MgY2-, тем полнее идет реакция замещения. Если вытеснение магния происходит медленно, необходимо анализируемый раствор выдержать некоторое время до окончания реакции или ускорить её нагреванием.
Таким способом нельзя определить ионы бария, так как K (BaY2-) < K (MgY2-) (табл.1). Однако, если к раствору, содержащему ионы бария, добавить достаточное количество аммиака и комплексонат цинка, то произойдет реакция:
Ba2++ ZnY2-+ 4NH3 BaY2-+ [Zn (NH3)4]2+
После чего аммиакат цинка при рН=9 титруют комплексоном в присутствии металлохромного индикатора эриохрома черного Т. Такое течение реакции замещения становится возможным, так как в данных условиях K'(BaY2-) > K"(ZnY2-).
Уравнение материального баланса, связывающее количество определяемого вещества и титранта, в заместительном титровании аналогично прямому титрованию.
Пример 9. Навеску кристаллогидрата Al (NO3)3· xH2O массой 1,7030 г растворили в мерной колбе объёмом 200,0 мл и к аликвоте полученного раствора 20,00 мл прибавили избыток комплексоната Na2MgY. На титрование выделившихся ионов магния израсходовали 17,45 мл 0,2 507 М раствора трилона Б. Рассчитать массовую долю (%) Al (NO3)3 в исходном препарате.
Решение.
Al3++ MgY2- AlY-+ Mg2+
Mg2++ H2Y2- MgY2-+ 2H+
Из уравнения материального баланса имеем:
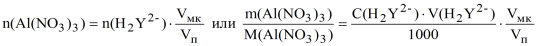
m (Al (NO3)3) = 0,2 507· 17,45·213,0·10-3·10 = 0,9318 г.
( Al (NO3)3) =
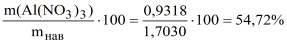
Косвенное титрование — применяется для определения ионов, не взаимодействующих с комплексоном непосредственно, например, катионов щелочных металлов и некоторых анионов, образующих малорастворимые соединения.
Таким образом определяют ионы натрия, осаждая их в виде натрийцинкуранилацетата — NaZn (UO2)3(CH3COO)9, который затем растворяют в кислоте и комплексонометрически определяют образовавшиеся ионы цинка. При этом.
n (Na+) = n (Zn2+) = n (H2Y2-)
Аналогично определяют и анионы. Например, фосфатный ион можно осадить в виде MgNH4PO4, а затем растворить его в кислоте и после ионообменного отделения фосфата определить магний с помощью трилона Б. При этом.
n (PO43—) = n (H2Y2-).
Косвенное определение можно проводить и обратным титрованием. Например, при определении сульфатов к анализируемому раствору прибавляют точно известный избыток нитрата свинца и остаток последнего определяют комплексонометрически. Уравнение материального баланса при этом следующее:
n (SO42-) = n (Pb2+) — n (H2Y2-)
Пример 10. Какая масса натрия содержалась в анализируемом растворе, если после осаждения его в виде натрийцинкуранилацетата полученный осадок отделили, растворили и на титрование образовавшихся ионов цинка затратили 20,85 мл 0,01 М (K = 0,9194) раствора трилона Б?
Решение.
Na++ Zn2++ 3UO22++ 9CH3COO- NaZn (UO2)3(CH3COO)9
NaZn (UO2)3(CH3COO)9+ 9H+ Na++ Zn2++ 3UO22++ 9CH3COOH
Zn2++ H2Y2- ZnY2-+ 2H+
Уравнение материального баланса имеет вид:
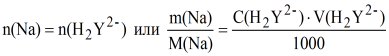
откуда m (Na) = 0,01· 0,9194·20,85·22,99·10-3 = 0,4407 г.