Тейхоевые кислоты и гликополимеры актиномицетов: разнообразие структур, таксономические и экологические аспекты

N. albus ВКМ Ас-805Т. Продукты кислотного гидролиза клеточных стенок и препарата ТК из них свидетельствовали о наличии ТК глицерофосфатной природы (табл. 1), имеющей заместители (обнаружены галактоза, глюкоза и пировиноградная кислота). Отсутствие среди них дифосфата глицерина и обнаружение в щелочных гидролизатах лишь монофосфорного эфира глицерина (Э1) указывало на поли… Читать ещё >
Тейхоевые кислоты и гликополимеры актиномицетов: разнообразие структур, таксономические и экологические аспекты (реферат, курсовая, диплом, контрольная)
Общая характеристика работы
Состояние вопроса и актуальность проблемы.
На поверхности бактериальной клетки экспонированы углеводные остатки, входящие в состав биополимеров клеточной стенки (Наумова и Шашков, 1997; Shibaev, 1987; Sutcliffe, 1994; Weidenmaier and Peschel, 2008). Эти полимеры часто имеют весьма сложную структуру и играют важную роль в жизнедеятельности микроорганизма. Нейтральные и кислые полисахариды, тейхуроновые кислоты, у которых углеводные остатки соединены между собой ковалентными связями, являются типичными представителями гликополимеров клеточных стенок. Моносахаридные остатки присутствуют в основном гликополимере бактериальной клеточной стенки — пептидогликане, а также в уникальных соединениях, характерных только для клеточных стенок грамположительных бактерий — тейхоевых кислотах и сахар-1-фосфатных полимерах, мономерные звенья которых объединены фосфодиэфирными связями.
Исследование структур тейхоевых кислот и гликополимеров клеточных стенок важно как в фундаментальном, так и научно-прикладном аспектах. Выявление и описание новых структур представляет интерес в связи с оценкой разнообразия биополимеров, пониманием их функций в микробной клетке и путей их биосинтеза, а также распространения у различных микроорганизмов в связи с вопросами эволюции. Исследование структур поверхностных полимеров способствует также пониманию механизмов взаимодействия бактерий внутри микробного сообщества и с внешней средой, в том числе с высшими организмами. Весьма актуальны исследования этих биополимеров микроорганизмов в медицинском аспекте. Их углеводная составляющая отвечает за биологическое распознавание поступающих извне веществ (например, лекарств), а также определяет самые разнообразные процессы клеточного узнавания, в том числе, имеющих ключевое значение при развитии многих заболеваний человека и животных, включая бактериальные и вирусные инфекции, рак, воспаления и др. (Дмитриева и др., 2007; Нифантьев, 2008; Weidenmaier and Peschel, 2008). Одним из направлений исследований тейхоевых кислот и гликополимеров клеточных стенок бактерий, получившим развитие в последние годы, является так называемое «хемотаксономическое» — изучение распространения и структур полимеров в связи с фундаментальными задачами развития естественной системы микроорганизмов и решения практичесих задач идентификации.
К началу наших исследований среди вышеупомянутых полимеров наиболее изученными были тейхоевые кислоты. С момента их открытия у лактобацилл в 50-е годы ХХ века в лаборатории профессора Джеймса Бэддили (Baddiley and Matias, 1954; Baddiley et al., 1956) проводились работы, связанные с изучением структурного разнообразия, путей биосинтеза и функций тейхоевых кислот у бактерий. Эти работы в основном были выполнены на представителях родов Bacillus*, Lactobacillus и Staphylococcus (Baddiley et al., 1962 a, b; 1972; Karamata et al., 1972; 1987; Archibald, 1974; Doyle et al., 1975; Hancock and Baddiley, 1976; Rodgers and Taylor, 1978; Yokoyama et al., 1987; Mauлl et al., 1989 и др.). Было также обнаружено, что организмы разных видов содержат различные по структуре тейхоевые кислоты, (Baddiley et al., 1961; Davison and Baddiley, 1964; Archibald et al., 1968; Baird-Parker, 1970), и была высказана идея о возможности использования данных полимеров в таксономических целях (Fiedler et al., 1981; Schleifer and Stackebrandt, 1983).
Огромный вклад в изучение разнообразия структур и распространения тейхоевых кислот у представителей различных таксонов порядка Actinomycetales внесли приоритетные работы Заслуженного деятеля науки Российской Федерации, профессора Ирины Борисовны Наумовой с сотрудниками (Наумова, 1964; 1973; 1979; Евтушенко и др., 1984; Наумова и Шашков, 1997; Naumova et al., 1980; Naumova, 1988; Naumova et al., 2001), ведущиеся в течение многих лет на кафедре микробиологии биологического факультета МГУ в сотрудничестве со специалистами Института органической химии им. Н. Д. Зелинского РАН и Института биохимии и физиологии им. Г. К. Скрябина РАН (отдел «Всероссийская коллекция микроорганизмов»).
Представители порядка Actinomycetales (актиномицеты) выделяются среди других прокариот размерами (до 9 млн. п.о.) и организацией генома, особенностями фенотипа, в т. ч., разнообразием морфологии и химических компонентов клетки и клеточной стенки. Актиномицеты также превосходят другие известные группы бактерий по способности синтезировать биологически активные соединения. Они являются продуцентами свыше половины из более 10 000 антибиотиков и других соединений, известных к настоящему времени (Грачева, 2003; Goodfellow et al., 1988; Anderson and Wellington, 2001; Watve et al., 2001). Все вышесказанное способствовало повышенному интересу к этой группе микроорганизмов со стороны различных специалистов, прежде всего биотехнологов, микробиологов-систематиков и молекулярных биологов, что, в свою очередь, определило более успешное развитие системы актинобактерий по сравнению с другими группами пркариот.
Создание филогенетической схемы прокариот, и актинобактерий в частности, стало возможным благодаря внедрению в микробиологию молекулярно-генетических методов и определению нуклеотидных последовательностей генов 16S рРНК. Филогенетические древа, однако, не могут быть использованы непосредственно для построения иерархической системы (Калакуцкий, 2006; Stackebrandt and Swings, 2005). Выделение новых и ревизия ранее описанных таксонов осуществляется с учетом разносторонних согласующихся данных филогенетического и фенотипического характера (принцип полифазной таксономии). Информация о фенотипе особенно важна для обоснования выделения новых таксонов родового и видового уровней и уточнения границ между таксонами.
Изучение хемотаксономических признаков (тип клеточной стенки, тип пептидогликана, состав менахинонов, жирных кислот фосфолипидов) сыграло ключевую роль в развитии системы классификации актиномицетов в «домолекулярную эру». Отличия организмов по хемотаксономическим признакам зачастую являются определяющими при обосновании выделения нового рода или вида актиномицетов и в настоящее время. Вместе с тем, многие полимеры и крупные молекулы клетки не изучены или слабо исследованы в таксономическом аспекте. В этой связи актуальны работы, направленные на поиск и оценку таксономической значимости новых биомолекул и их структурных компонентов — особенно в связи с выделением из природной среды массивов новых микроорганизмов, обособляющихся от изветсных таксонов на уровне генотипа, но неотличимых от них по традиционно используемым в систематике актиномицетов фенотипическим, в т. ч., хемотаксономическим, признакам.
К настоящему моменту определены структуры тейхоевых кислот и показана возможность использования этих полимеров и их структурных компонентов в качестве хемотаксономических маркеров видов ряда родов актиномицетов, например, Agromyces (Гнилозуб, 1994), Actinomadura, Nonomurea, Brevibacterium (Потехина, 2005). Эти и другие работы продемонстрировали также огромное структурное разнообразие тейхоевых кислот и гликополимеров в этой группе бактерий и перспективность дальнейших исследований в данном направлении.
Цель и задачи исследования
.
Цель настоящего исследования — изучение распространения и разнообразия тейхоевых кислот и гликополимеров клеточных стенок у представителей порядка Actinomycetales и оценка коррелятивных связей между наличием и структурой вышеназванных полимеров, с одной стороны, и таксономическим положением и свойствами организмов, с другой.
Среди основных задач исследования можно выделить следующие:
- 1. Изучение распространения тейхоевых кислот и других гликополимеров у представителей различных родов актиномицетов, относящихся к 12-ти семействам, 9-ти подпорядкам порядка Actinomycetales (более 100 штаммов).
- 2. Установление структур тейхоевых кислот и других гликополимеров клеточных стенок исследуемых актиномицетов — представителей некоторых видов родов Nocardiopsis (29 штаммов); Glycomyces (4 штамма); Nocardioides (15 штаммов); Streptomyces (14 штаммов), а также Kineosporia aurantiaca.
- 3. Анализ полученных результатов и имеющихся в литературе сведений и оценка возможности использования вышеназванных полимеров и их структурных компонентов в качестве химических маркеров таксонов.
- 4. Выяснение взаимосвязи между структурой тейхоевых кислот и гликополимеров клеточных стенок стрептомицетов-возбудителей парши обыкновенной картофеля и корнеплодов и их патогенностью.
Научная новизна работы.
Впервые изучено распространение тейхоевых кислот и других гликополимеров в клеточных стенках, а также моносахаридный состав последних у более 100 штаммов, представителей различных родов актиномицетов, относящихся к 12-ти семействам 9-ти подпорядкам порядка Actinomycetales. Впервые найдены тейхоевые кислоты и другие гликополимеры клеточных стенок и установлены структуры полимеров у 63 (из 100) штаммов актиномицетов, относящихся к 28 видам, 5-ти родам 5-ти семейств 5-ти подпорядков порядка Actinomycetales. Обнаружено и описано 15 новых структур упомянутых биополимеров, среди них 11 тейхоевых кислот, 2 кислых полисахарида — полимер и олигомер Kdn (3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновая кислота), тейхуроновая кислота и нейтральный полисахарид. Впервые показана специфичность состава и строения тейхоевых кислот для видов родов Nocardiopsis, Nocardioides, Glycomyces и Streptomyces, что имеет важное значение для усовершенствования системы классификации исследованных групп бактерий. Предложен новый перспективный подход к ревизии таксономической структуры наиболее многочисленного по видовому составу рода Streptomyces, а именно, использование признака «набор и структура тейхоевых кислот и других гликополимеров клеточной стенки» как критерия границ близких видов. В соответствии с отличиями по составу тейхоевых кислот клеточной стенки и с другими фенотипическими признаками, а также с обособленностью на филогенетическом уровне (анализ 16S рРНК), предложен новый вид Nocardioides prauseri sp. nov. и переописаны виды Nocardioides luteus и Nocardioides albus. Впервые показано, что клеточные стенки стрептомицетов, вызывающих паршу обыкновенную у картофеля и корнеплодов, содержат в клеточных стенках более двух анионных полимеров различных по структуре, среди которых — полимер/олигомер Kdn. Эти полимеры, наряду с фитотоксином такстомином и гидролитическими ферментами, по всей вероятности, могут считаться факторами патогенности, обусловливая специфическую адгезию фитопатогена к растению-хозяину на первых этапах развития инфекции. Выявлен ряд новых фитопатогенных актиномицетов рода Streptomyces, филогенетически и фенотипически отличных от ранее известных возбудителей парши обыкновенной картофеля и корнеплодов.
Практическое значение работы.
Полученные в результате проведенных исследований данные о химическом составе и структурных особенностях тейхоевых кислот и других гликополимеров клеточных стенок фитопатогенных стрептомицетов могут служить основой для будущих исследований молекулярных механизмов взаимодействия фитопатогенов и растения-хозяина и разработки новых методов борьбы с возбудителями заболеваний растений. Полученные данные могут быть использованы для создания более совершенной системы идентификации фитопатогенов. На большом фактическом материале убедительно показано, что признак «наличие/отсутствие тейхоевых кислот и других гликополимеров клеточной стенки», а также таксономическая специфичность ряда структурных компонентов, выявляемых методами хроматографии, могут быть успешно применены в повседневной микробиологической практике при идентификации микроорганизмов исследованных групп и решении вопроса о границах таксонов. Подкомитетом по систематике подпорядка Micrococcineae Международного комитета по систематике прокариот рекомендовано определять вышеназванные характеристики при описании новых родов и видов соответствующих групп актинобактерий (Shumann et al., 2009).
Значительно пополнены базы данных спектров ЯМР тейхоевых кислот и других гликополимеров бактериальных клеточных стенок, что внесло определённый вклад в гликологию, химическую микробиологию и может быть использовано при анализе структур близких полимеров в биохимической практике.
Полученные данные о структуре, разнообразии и распространении тейхоевых кислот и других гликополимеров в клеточных стенках представителей порядка Actinomycetales востребованы и цитируются в ведущих современных обзорах и монографиях (Lazarevic et al., 2002; Seltmann and Holst, 2002; Neuhaus and Baddiley, 2003; Weidenmaier and Peschel, 2008) и авторитетном международном руководстве по микробиологии — «The Procaryotes» (Kroppenstedt and Evtushenko, 2006). Кроме того, эти данные могут быть включены в курсы по биохимии и микробиологии на биологических факультетах высших учебных заведений.
Основные защищаемые положения диссертации.
- ? тейхоевые кислоты и гликополимеры широко распространены в клеточных стенках представителей прядка Actinomycetales, однако доминируют тейхоевые кислоты;
- ? тейхоевые кислоты и гликополимеры клеточных стенок представителей порядка Actinomycetales проявляют чрезвычайно широкое структурное разнообразие;
- ? набор и структура тейхоевых кислот и гликополимеров клеточных стенок представителей порядка Actinomycetales являются таксономически значимой фенотипической характеристикой таксонов разных уровней (от подпорядка до вида);
- ? клеточные стенки фитопатогенных стрептомицетов характеризуются ярко выраженными анионными свойствами, которые обеспечены наличием в них комплекса кислых полимеров гетерогенного состава: тейхоевыми и тейхуроновыми кислотами с пировиноградной или глутаминовой кислотой в качестве дополнительного кислого компонента, кислыми поли/олигосахаридами;
- ? выявление новых структур гликополимеров клеточной стенки может служить не только маркером новых видов или подвидов актиномицетов, но и указывать на неизвестные до сего времени экологические функции изучаемых организмов.
Апробация работы. Материалы диссертации были представлены на Всесоюзной конференция «Регуляция микробного метаболизма» (Пущино, 1989); Международных симпозиумах по биологии актиномицетов (Madison, 1991; Москва, 1994); Всероссийской конференции «Биосинтез и деградация микробных полимеров. Фундаментальные и прикладные аспекты» (Пущино, 1995); Международной конференции «Микробное разнообразие» (Пермь, 1996); Втором съезде Биохимического общества Российской АН, Москва, 1997); Международном симпозиуме «Современные проблемы биохимии микроорганизмов и биотехнологии» (Пущино, 2000); Втором Германо-Польско-Российском съезде по углеводам бактерий (Москва, 2002); Первой Всероссийской конференции по иммунитету растений к болезням и вредителям (Санкт-Петербург, 2002); Первом конгрессе FEMS Европейских микробиологов (Ljubljana, 2003); II Московском международном конгрессе по биотехнологии (Москва, 2003); III Всероссийской школе-конференции «Химия и биохимия углеводов» (Саратов, 2004); Всероссийском симпозиуме «Биотехнология микробов», (Москва, 2004); Всероссийском симпозиуме с международным участием «Автотрофные микроорганизмы» (Москва, 2005); Международном конгрессе коллекций культур микроорганизмов (Gцslar, 2007); IV съезде Российского общества биохимиков и молекулярных биологов (Новосибирск, 2008).
Публикации. По материалам диссертации опубликовано 45 работ, из них обзор и 24 экспериментальные статьи в рекомендуемых ВАК’ом изданиях; тезисы 20 докладов.
Структура и объем работы. Диссертация изложена на 350 страницах машинописного текста и состоит из введения, 9-ти глав, включающих материалы литературных источников, касающиеся темы данной работы (3 главы обзора литературы), краткой характеристики объектов и методов исследований (одна глава), изложения результатов собственных исследований (4 главы), а также главы, посвященной обсуждению полученных результатов. Кроме того, имеется общее заключение и выводы. Работа содержит 64 таблицы, 54 рисунка. Список цитируемой литературы содержит 720 ссылок. В Приложении приведён полный список исследованных штаммов актиномицетов с указанием обнаруженных моносахаридов, а также наличия (отсутствия) тейхоевых кислот в их клеточных стенках; таблицы баз данных по ЯМР-спектрам найденных тейхоевых кислот и других гликополимеров.
Содержание работы
Обзор литературы Тейхоевые кислоты и другие гликополимеры клеточных стенок грамположительных бактерий: структурное разнообразие, распространение и некоторые функции, экологические аспекты.
Главы I, II, III. В литературном обзоре представлены сведения, касающиеся строения бактериальной клеточной стенки; разнообразия структурных вариаций, распространения и некоторых функций тейхоевых кислот и других гликополимеров клеточных стенок грамположительных бактерий. Особое внимание уделено названным полимерам клеточных стенок представителей порядка Actinomycetales. Приведены сведения, касающиеся современной классификации актиномицетов. Отмечена особая значимость хемотаксономических признаков, отражающих химический состав и строение клетки и клеточной стенки и являющихся одной из наиболее значимых групп фенотипических признаков в систематике актиномицетов. Обоснована актуальность и перспективность изучения тейхоевых кислот и других гликополимеров клеточной стенки с целью использования для развития системы классификации актиномицетов. Представлены сведения о фитопатогенных стрептомицетах, их видовом составе, а также данные об известных к настоящему времени возможных факторах патогенности, в числе которых некоторые биополимеры клеточных стенок.
Экспериментальная часть Глава IV. Материалы и методы, использованные в работе. В работе использован ряд микробиологических, химических, биохимических, инструментальных методов исследования. Методики, как правило, были описаны в литературе ранее и модифицированы для решения поставленных в работе задач. Исследовано более 100 штаммов актиномицетов, относящихся к различным родам актиномицетов из 12-ти семейств 9-ти подпорядков порядка Actinomycetales (http://www.bacterio.cict.fr) из различных коллекций микроорганизмов, в том числе ИНА, ВКМ и НИИ картофелеводства БелНАН. Морфологические и культуральные признаки определяли как описано Гаузе и др. (1983). Биомассу, собранную на логарифмической фазе роста, использовали для получения клеточных стенок (Стрешинская и др., 1979). Пептидогликан получали по модифицированному методу (Elliott et al., 1975). Анализ сахаров в кислотных гидролизатах клеточных стенок изучаемых актиномицетов, а также изомеров диаминопимелиновой кислоты в пептидогликане после его кислотного гидролиза, осуществляли методом хроматографии на бумаге сравнением со стандартными образцами (Стрешинская и др., 1989). Фосфолипиды определяли по методу, описанному ранее (Minnikin et al., 1984; O’Donnel et al., 1985). Тейхоевые кислоты (ТК) и гликополимеры экстрагировали 10%-ной трихлоруксусной кислотой (ТХУ) из клеточных стенок и обезжиренного мицелия. Очистку проводили на DEAE-Toyopearl 650M в линейном градиенте NaCl (0−0,5 М), методом препаративного высоковольтного электрофореза, а также фракционировали с помощью дробного осаждения этанолом (Tul'skaya et al., 1991).
Таблица 1. Основные продукты кислотного (2 М HCl, 100°, 3 ч) и щелочного (1 М NaOH, 100°, 3 ч) гидролизов изученных ТК.
Тейхоевая кислота. | Основные продукты гидролиза. | |||
Тип ТК. | Структура ТК. | Кислотный гидролиз. | Щелочной гидролиз. | |
I G, 1,3. | 1,3-поли (глицерофосфат). | GroP; GroP2; Gro; Pi; С/З*. | GroP; GroP2; Gro2P3; Pi; ФЭ**. | |
I G, 2,3. | 2,3-поли (глицерофосфат). | GroP; GroP2; Gro; Pi; С/З. | GroP; GroP2; Pi; ФЭ*. | |
I R, 1,5. | 1,5-поли (рибитфосфат). | RboP; AhRboP; RboP2; Rbo; AhRbo; Pi; С/З. | RboP; RboP2; Pi; ФЭ*. | |
I R, 3,5. | 3,5-поли (рибитфосфат). | RboP; RboP2; Rbo; AhRbo; Pi. | RboP; RboP2; Rbo; AhRbo; Pi. | |
II GS, 3,3. | Поли (гликозилглицерофосфат). | GroP; Gro; Pi; С/З. | Gro; ФЭ. | |
IV GS. | Поли (глицерофосфат-гликозилглицерофосфат). | GroP; GroP2; Gro; Pi; С/З. | GroP; GroP2; Pi; ФЭ; Э3. | |
Gro-глицерин; GroP-глицерофосфат; GroP2-бисфосфат глицерина; Gro2P3-диглицеринтрифосфат; Rbo-рибит; AhRbo-ангидрорибит; RboP-рибитфосфат; AhRboP-ангидрорибитфосфат; RboP2-бисфосфат рибита; Pi минеральный фосфат; ФЭ — фосфорные эфиры; Э3 — см. раздел 5.1.;
- * боковой заместитель на остатке полиола или сахарид в коре полимера;
- ** фосфорные эфиры образуются при наличии заместителей на остатках полиола.
Первичную структуру ТК и гликополимеров, а именно: качественный состав (вид полиола, наличие и природа заместителей, моносахаридный состав), строение мономерных единиц, локализацию фосфодиэфирной связи, изучали химическими методами. Последние основаны на расщеплении молекулы полимера (кислотный, щелочной, ферментативный гидролизы) и изучении качественного и количественного состава полученных фрагментов, подвижности последних в электрическом поле (высоковольтный электрофорез) и в различных хроматографических системах относительно стандартных образцов, способности окрашиваться различными проявителями. Анализируя фосфорные эфиры полиолов, можно предварительно говорить о типе ТК (табл. 1). Абсолютную конфигурацию некоторых заместителей определяли, как описано (Gerwig et al., 1979; Gorshkova et al., 1997; Shashkov et al., 2006). Данные о строении фрагментов анализировали, что позволяло реконструировать структуру полимера (Kelemen and Baddiley, 1961). Молекулярные массы ТК определяли с помощью гельфильтрации на сефадексе G-50 (Tul'skaya et al., 1991). Результаты химических исследований подтверждали методами ЯМР-спектроскопии (Shashkov et al., 2001). Применялись также методы MALDI TOF масс-спектроскопии для определения структуры и молекулярной массы олигомера Kdn (Shashkov et al., 2002 а). Определение патогенности на картофеле и проростках редиса осуществляли по описанному методу (Goyer et al., 1998). Наличие такстомина в культуральной жидкости исследуемого стрептомицета проводили методом тонкослойной хроматографии.
Для определения нуклеотидной последовательности гена 16S рРНК использовали универсальные бактериальные праймеры 27f (5'-AGAGTTTGATCCTGGCTCAG), 530f (5'-GTGCCAGCAGCCGCGC) и 1492r (5'-TACGGYTACCTTGTTACGACTT). Определение нуклеотидной последовательности 16S рРНК проводили на автоматическом секвенаторе CEQ2000 XL (Beckman Coulter, США) в соответствии с предлагаемым фирмой протоколом. Для филогенетического анализа полученную нуклеотидную последовательность гена 16S рРНК изучаемого организма выравнивали с последовательностями типовых и референтных штаммов с помощью программы CLUSTAL W. Эволюционное расстояние рассчитывали по алгоритму (Ohta and Kimura, 1971; Kimura and Ohta 1973). Для ДНК-ДНК гибридизации Н3-меченную ДНК получали с использованием (1', 2', 5'-3H) дезоксицитидин-трифосфата и ферментов для ник-трансляци N 5500 (Amersham). ДНК-ДНК гибридизацию проводили на мембранных фильтрах («Hiiu Kalur», Таллин, Эстония) в оптимальных условиях (раствор Денхарда с 50% формамида (об/об), 50° С, 24 ч), как описано (Tijssen, 1993).
Результаты исследований Глава V. Разнообразие структур тейхоевых кислот и других гликополимеров клеточных стенок актиномицетов.
Материальной основой выявления разнообразия, различных функций в жизни микроорганизма и возможности применения ТК и гликополимеров клеточных стенок в таксономии актиномицетов является знание структур этих соединений. В настоящей главе приведены сведения, касающиеся установления структур полимеров клеточных стенок актиномицетов, изученных в работе.
5.1. Структуры тейхоевых кислот клеточных стенок видов и подвидов рода Nocardiopsis
В данном разделе приведены структуры ТК клеточных стенок 29 штаммов, принадлежащих 9 видам и подвидам актиномицетов рода Nocardiopsis, установленные нами.
N. dassonvillei ssp. dassonvillei и N. dassonvillei ssp. antarctica. Подробное изучение структуры ТК клеточных стенок с получением и исследованием фосфорных эфиров и гликозида различными химическими методами, определение соотношений компонентов их составляющих, определение молекулярной массы ТК, а также ЯМР-спектроскопические исследования проводили на трех штаммах N. dassonvillei ssp. dassonvillei (ВКМ Ас-797Т, ВКМ Ас-773, IMRU 504), а также N. dassonvillei ssp. antarcticus ВКМ Ас-836T. Позднее аналогичным образом были исследованы ТК 15-ти изолятов из почв Сейшельских островов.
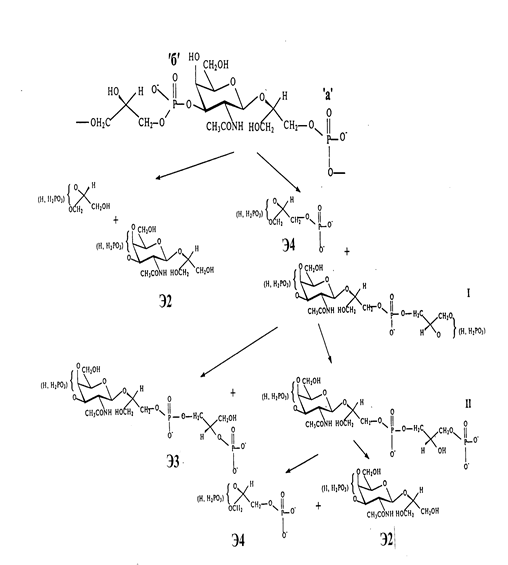
Рис. 1. Повторяющееся звено и схема щелочного гидролиза ТК клеточных стенок N. dassonvillei ssp. dassonvillei и N. dassonvillei ssp. аntarcticа. Возможные пути щелочного гидролиза обозначены? a? и? б?
Кислотный гидролиз ТК привел к образованию монои бисфосфатов глицерина, галактозамина, глицерина, неорганического фосфора и фосфорного эфира 1 (Э1). Последний был идентифицирован как монофосфорный эфир галактозамина. Основным продуктом HF-деградации полимера был гликозид 1 (Г1), который оказалсяGalpNAc-(1>2)-snGro. Наибольшая информация о структуре исследуемого полимера была получена при исследовании продуктов его щелочного гидролиза (рис. 1). При этом образовался ряд эфиров, основными среди которых были: Э2, идентифицированный какGalpNAc-(1>2)-snGro-(3-P; быстро движущийся к аноду эфир Э3, который содержал два остатка глицерина, один N-ацетилгалактозаминильный остаток и три фосфатных группы [P-¾)-GalpNAc-(1>2) — snGro-(3-P-1)-snGro-(2-P], а также монои бисфосфат глицерина (Э4). В работе рассмотрены пути щелочного гидролиза, имеющие место при небычной структуре полимера, что подтверждает вновь обнаруженную структуру (рис.1).
Независимо было проведено ЯМР спектроскопическое изучение препаратов ТК изучаемых организмов. В составе повторяющегося звена полимера найдены 2-ацетамидо-2-дезокси-в-D-галактопираноза с фосфатным остатком по гидроксилу при С3 и незамещенный остаток глицерина с неэквивалентными фосфатными группами и идентифицированы все сигналы этих остатков в спектре 13С-ЯМР (рис. 1). Оставшиеся три сигнала, несомненно, принадлежали еще одному остатку глицерина, алкилированному по гидроксилу при С2 и фосфорилированному по гидроксилу при С3. Об этом свидетельствовал слабопольный сдвиг сигнала при 80,20 м.д. (СН-группа согласно АРТ-спектру) и его расщепление в дублет, а также уширение пика при 65,55 м.д. и отсутствие расщепления или уширения пика при 62,15 м.д. (СН2-группы). В результате всех экспериментов была реконструирована структура ТК (рис. 1, 6 а). Все 19 изученных штаммов, принадлежащих виду N. dassonvillei ssp. dassonvillei (впоследствии N. antarcticus был переведен в N. dassonvillei ssp. аntarcticа) содержали в клеточной стенке около 20% ТК идентичной уникальной структуры, относящейся к новому IV типу (смешанная структура, Naumova et al., 2001). Молекулярная масса полимера около 6,4 кДа, что соответствует 11−13 повторяющимся поли (глицерофосфат-в-N-ацетилгалактозаминилглицерофосфатным) звеньям. ТК такой структуры дает необычные продукты щелочного гидролиза (рис. 1), включая так называемый фосфодиэфир Э3 (Тульская и др., 1992; Tul’skaya et al., 1993).
N. synnemataformans Ас-2518Т. Продукты кислотного и щелочного гидролизов клеточных стенок и препаратов ТК были аналогичны таковым для N. dassonvillei ssp. dassonvillei. Среди них был и характерный эфир Э3. Это позволило предположить, что препарат из клеточной стенки N. synnemataformans Ас-2518Т содержит ТК идентичную таковой из N. dassonvillei ssp. dassonvillei. Предположение было подтверждено ЯМР-спектроскопическими методами анализа. Однако анализ одномерного 31Р ЯМР-спектра и корреляционных пиков в двумерном 1Н, 31Р HМQC спектре обнаружили отличия в структурных фрагментах, содержащих фосфор: -1)-snGro-(3-P-3)—GalpNAc-(1 и -1)-snGro-(3-P-4)—GalpNAc-(1.
Таким образом, в клеточной стенке N. synnemataformans Ас-2518Т обнаружены две ТК: основная — поли (глицерофосфат—N-ацетилгалактозаминилглицерофосфат), такая же как у N. dassonvillei ssp. dassonvillei и минорная — поли (глицерофосфат—N-ацетилгалактозаминилглицерофосфат), в которой фосфодиэфирная связь осуществляется по гидроксилам при С3 глицерина и С4 -N-ацетилгалактозамина, причём цепь не несёт никаких заместителей; ТК такой структуры (рис. 6 б) обнаружена впервые (Tul'skaya et al., 2007).
N. halotolerans Ас-2519Т. Профили кислотного и щелочного гидролизов клеточной стенки и препарата ТК из нее соответствовали таковым для N. synnemataformans Ас-2518Т. Кроме того, была идентифицирована пировиноградная кислота. Таким образом, можно было предположить, что и в данном случае имеем дело с ТК, подобной таковой из N. dassonvillei ssp. dassonvillei. Некоторую неясность вносило наличие пировиноградной кислоты. Локализовать фосфодиэфирные связи, а также место присоединения пировиноградной кислоты удалось лишь с помощью ЯМР-спектроскопических методов.
Характерной особенностью спектра ЯМР 13С препарата было наличие в нем пиков с химическими сдвигами 26,2 м.д. (СН3 группа согласно АРТ) и 174,2 м.д. (С=О), что с учетом сигнала при 100,2 м.д., принадлежащего четвертичному атому углерода (тест на число присоединенных протонов, АРТ, Patt and Shoolery, 1982), позволяло предположить наличие пируватных остатков в полимере. В спектре ЯМР 13С сигналы одного из остатковGalpNAc имели химические сдвиги С4 и С6 отличные от соответствующего остатка со свободными гидроксилами при С4 и С6. Эти отличия были характерными для замещения остатка пируватом по С4 и С6 (Jansson et al, 1993), что позволяло локализовать пируватную группировку при соответствующих атомах углерода в части остатковGalpNAc полимерной цепи препарата. Химический сдвиг 13С метильной группы пируватного остатка (26,2 м.д.) свидетельствовал об экваториальной ориентации метильной группы в шестичленном 4,6-ацетальном цикле (R-конфигурация ацетального центра). Анализ двумерных спектров ЯМР, включая спектр 1Н, 31Р HМQC показал, что большая часть (90%) остатковGalpNAc-4,6-R-Pyr имеют фосфатную группу по гидроксилу при С3, остальные остатки, находящиеся, по-видимому, на растущем конце цепи, несут при С3 свободный гидроксил. Помимо перечисленных структурных фрагментов в препарате обнаружены фрагменты сGalpNAc, несущей фосфатные группы по гидроксилам при С4 и С3, но без пируватной группировки в последней. Приблизительное соотношение остатков с пируватомР-3)—GalpNAc-4,6-R-Pyr и без пируватаР-3)—GalpNAc, найденное по интегральным интенсивностям соответствующих сигналов в спектре ЯМР 13С, составляло 3,5: 1. Соотношение остатков с фосфатной группировкой по гидроксилам при С3 и С4 -N-ацетилгалактозамина определено как 10,5: 1.
Таким образом, в клеточной стенке N. halotolerans Ас-2519Т обнаружены две ТК. Основная поли (глицерофосфат—N-ацетилгалактозаминилглицерофосфат), с пировиноградной кислотой по гидроксилам при С4,6 галактозамина. ТК такой структуры найдена впервые. Минорная — соответствовала таковой из N. synnemataformans Ас-2518Т (рис. 6 в, Tul’skaya et al., 2007).
N. alba ВКМ Ас-1883Т, ВКМ Ас-1879 и ВКМ Ас-1884. Результаты изучения структур ТК трех штаммов актиномицетов вида N. alba были идентичны для всех трех штаммов за исключением некоторых количественных отличий. Кислотные гидролизаты препаратов содержали глицерин, рибит, фосфорные эфиры этих полиолов и глюкозамин, что позволило предположить присутствие нескольких ТК. На это указывали данные электрофоретического исследования препаратов: были обнаружены три фосфорсодержащие зоны с подвижностью: фракция I — mGroP 1,4; фракция II — mGroP 1,57; фракция III — mGroP 1,96. Очистку и разделение ТК, выделенных из обезжиренного мицелия, осуществляли методом ионообменной хроматографии на DEAE-Toyopearl 650M. Были получены три фракции, содержащие фосфор (рис. 2).
Рис. 2. Ионообменная хроматография препарата ТК клеточной стенки N. alba Ас-1879 на DEAE Toyopearl 650M в линейном градиенте NaCl (00,5 М) в 50 мМ Tris-HCl-буфере, рН 7,2 (колонка 16.5×500 мм; скорость протока 2 мл/мин; объем фракции 4 мл); I, II, III фракции тейхоевых кислот
Фракция I, элюирована при 0,16−0,19 М NaCl. Продукты кислотной и щелочной деградации указывали на поли (рибитфосфатную) природу ТК1 без заместителей (табл. 1). При периодатном окислении ТК1 образовался формальдегид в эквимольном.

Рис. 3. Определение молекулярной массы ТК клеточной стенки N. alba (сефадекс G-50, колонка 9909,5 мм; объем фракции 2 мл).
Стандартные вещества: (1) -ТК Streptomyces antibioticus, 7,0 кДа (Shashkov et al., 1979); (2) — ТК S. violaceus, 4,0 кДа (Наумова и др., 1969); (3) — ТК S. azureus, 3,3 кДа (Стрешинская и др., 1981); (4) — монофосфат глицерина; _ - ТК1; ДТК2;? — ТК3 отношении к фосфору, что указывало на необычное положение фосфодиэфирной связи. Исходя из имеющихся данных о биосинтезе ТК [от соответствующего нуклеотида к растущей цепи переносится D-рибит-5-фосфат (Baddiley, 1972)], в образовании фосфодиэфирной связи должна участвовать гидроксильная группа при С5 рибита. Тогда вторая гидроксильная группа, участвующая в образовании фосфодиэфирной связи, находится при С3 рибита. Молекулярная масса полимера составила 5,6 кДа (рис. 3), соответственно, цепь полимера состояла из 26−27 рибитфосфатных звеньев. Предполагаемая структура подтверждена методами ЯМР-спектроскопии. Таким образом, ТК 1 представляла собой незамещенный 3,5-поли (рибитфосфат) и являлась новой структурой, рис. 6 ж, (Tul'skaya et al., 1995).
Фракция II, элюирована при 0,22 М NaCl. Профили кислотного и щелочного гидролизов фракции указывали на поли (глицерофосфатную) природу ТК2 (табл. 1), в состав которой в качестве заместителя входит глюкозамин. В HF-гидролизатах ТК2 обнаружен гликозид, идентифицированный как GlcpNAc-(1>2)-snGro. Учитывая структуру гликозида, а также факт образования при щелочном гидролизе полимера щелочестабильных фосфодиэфиров глицерина, был сделан вывод, что ТК2 является 1,3-поли (глицерофосфатом), в котором часть глицериновых остатков замещена N-ацетилглюкозамином. Молекулярная масса ТК2 составляла 7,6 кДа, что соответствует, исходя из мольного содержания компонентов полимера, 40−41 глицерофосфатному звену (рис. 3). Спектр 13С-ЯМР ТК2 был типичным для замещенного на 10% б-N-ацетилглюкозамином 1,3-поли (глицерофосфата), рис. 6 з, (Tul'skaya et al., 1995).
Фракция III, элюирована при высокой концентрации NaCl (~ 0,3 М). Это указывало на бьльший отрицательный заряд ТК3 из этой фракции, чем у ТК1 и ТК2 (рис. 2), что подтверждадено высокой подвижностью ТК3 в электрическом поле (mGroP 1,96). Продукты кислотного гидролиза свидетельствовали о поли (рибитфосфатной) природе ТК3 (табл. 1), а идентифицированная при этом пировиноградная кислота, видимо, являлась заместителем в молекуле изучаемой ТК. Устойчивость ТК3 к действию щелочи свидетельствовала об отсутствии свободных гидроксильных групп, соседних с фосфодиэфирными группами (Kelemen and Baddiley, 1961), а устойчивость к периодатному окислению указывала на отсутствие в полимере незамещенных гликольных группировок. Можно было предположить, что рибитные остатки замещены пировиноградной кислотой, связанной кетальной связью, которая стабильна в щелочных условиях (Thurow et al., 1975). Молекулярная масса ТК3 составляла 5,4 кДа, что соответствует примерно 18 повторяющимся звеньям (рис. 3).
ЯМР-спектроскопическое исследование подтвердило предполагаемую структуру: 1,5-поли (рибитфосфат) полностью замещенный по гидроксилам при С2,4 рибита кетально связанной пировиноградной кислотой (рис. 6 и). ТК такой структуры выявлена впервые (Tul'skaya et al., 1995).
Соотношения найденных ТК в клеточных стенках трех изучаемых штаммов, установленные при количественном определении глицерина и рибита в них с учетом полного замещения рибитных остатков пировиноградной кислотой в ТК3, разные. Является ли этот факт штаммовым признаком — предмет дальнейших исследований на большей выборке штаммов одного вида.
N. prasina ВКМ Ас-1880Т. В кислотных гидролизатах клеточной стенки и ТХУ-препарата обнаружены фосфорные эфиры глицерина и рибита, что могло свидетельствовать о присутствии нескольких ТК. Разделение и очистку ТК, выделенной из целого обезжиренного мицелия, осуществляли с помощью метода ионообменной хроматографии на DEAE-Toyopearl 650M. Были получены две фосфорсодержащие фракции.
ТК из фракции I (элюирована при 0,17 М NaCl) и фракции II (элюирована при 0,22 М NaCl) соответствовали таковым из клеточных стенок N. alba, что было подтверждено химическими и ЯМР-спектроскопическими методами исследования (рис. 6 ж, з). ТК1 представляла собой незамещенный 3,5-поли (рибитфосфат), но с бульшей молекулярной массой? 9,4 кДа, что соответствует 41 рибитфосфатной единице. ТК2 являлась 1,3-поли (глицерофосфатом), на 10% замещенным б-N-ацетилглюкозамином и на 5% О-ацетильными остатками, последнее, также как и несколько мйньшая молекулярная масса (6,0 кДа, что соответствовало 33 глицерофосфатным единицам), отличало эту ТК от ТК2 из N. alba (Тульская и др., 2000).
N. composta ВКМ Ас-2520 и N. composta ВКМ Ас-2521T. Продукты кислотного и щелочного гидролизов клеточных стенок этих организмов, также как и препаратов ТК из них свидетельствовали о глицерофосфатной природе ТК (табл. 1), замещенной глюкозамином. Образовавшиеся при HF-гидролизе гликозид, идентифицированный как GlcpNAc-(1>2)-snGro, а при щелочном гидролизе фосфодиэфир глицерина с N-ацетилглюкозамином, указывали, что данные ТК являются 1,3-поли (глицерофосфатами), замещёнными глюкозамином, что было подтверждено ЯМР-спектроскопическими методами. По интегральной интенсивности сигналов концевых и срединных остатков длина 1,3-поли (глицерофосфатной) цепи была оценена в 10 единиц.
Итак, клеточные стенки N. compostа ВКМ Ас-2520 и N. compostа ВКМ Ас-2521T содержали единственную ТК — 1,3-поли (глицерофосфат), на 10% замещённыйN-ацетилглюкозамином (Tul'skaya et al., 2007).
N. metallica ВКМ Ас-2522T. В кислотных гидролизатах клеточных стенок и препарата ТК найдены фосфорные эфиры рибита, пировиноградная кислота, а также в небольшом количестве фосфорные эфиры глицерина. Это указывало на возможное присутствие нескольких ТК, что подтверждали данные электрофоретического исследования: обнаружены две фосфорсодержащие зоны с подвижностью I mGroP 0,93 и II mGroP 1,27. Препарат из клеточной стенки был подвергнут ЯМР-спектроскопическим исследованиям.
Основные сигналы спектра ЯМР 13С препарата были идентифицированы как принадлежащие 1,5-поли (рибитфосфату) с 2,4-пируват-кетальными заместителями. Минорные сигналы в спектре принадлежали полимеру с 1,3-поли (глицерофосфатными) цепями, где часть (30%) глицериновых остатков замещена по гидроксилу у С-2 остаткамиGlcpNAc. Мольное соотношение основного и минорного полимеров оценено как 7,5: 1.
Итак, клеточная стенка N. metallica ВКМ Ас-2522T содержала две ТК. Основная — 1,5-поли (рибитфосфат), каждая рибитфосфатная единица которого несёт 2,4-кетально связанную пировиноградную кислоту и минорная — 1,3-поли (глицерофосфат) на 30% замещённыйN-ацетилглюкозамином, рис. 6 з, и (Tul'skaya et al., 2007).
N. trehalosi ВКМ Ас-942. В продуктах кислотного гидролиза клеточной стенки и ТК из нее кроме фосфорных эфиров глицерина была обнаружена глюкоза. Полимер частично гидролизовался щелочью с образованием небольшого количества монои бисфосфатов глицерина. Молекулярная масса полимера составила около 8,0 кДа, что соответствует приблизительно 40 глицерофосфатным звеньям.
В 13С ЯМР-спектрах ТК идентифицированы все сигналы, характерные для 1,3-поли (глицерофосфата) на 60% замещенного в-глюкозильными остатками, рис. 6 д, (Стрешинская и др., 1998).
5.2. Структуры тейхоевых кислот клеточных стенок видов рода Glycomyces
В настоящем разделе приведены структуры ТК клеточных стенок 4-х штаммов, принадлежащих двум валидно описанным видам (Labeda et al., 1985) рода Glycomyces, установленные нами.
G. rutgersensis ВКМ Ас-1248. Профиль кислотного гидролиза клеточной стенки и ТК (табл. 1) соответствовал наличию поли (глицерофосфата), а обнаружение в гидролизатах глюкозы предполагало замещение остатков глицерина этим сахаром. ТК была полностью устойчива к щелочному гидролизу, что указывало на полное замещение полимера глюкозой. В продуктах HF-гидролиза идентифицирован гликозид Г1, определенный как б-глюкозилглицерин, с гликозидной связью по гидроксилу при С2 глицерина и С1 глюкозы. Молекулярная масса ТК составила около 6,0 кДа, что, учитывая структуру полимера, составляет 19−20 повторяющихся звеньев. Таким образом, предположительно ТК была 1,3-поли (глицерофосфатом) полностью замещенным б-глюкозой (такая конфигурация гликозидного центра глюкозы найдена впервые у актиномицетов) по гидроксилу при С2 глицерина, что было подтверждено методами ЯМР-спектроскопии (Тульская и др., 1993).
G. harbinensis ВКМ Ас-1247Т, G. harbinensis NRRL 16 897 и G. harbinensis IFO 14487T. Качественный состав компонентов клеточных стенок всех трех штаммов был одинаков. В кислотных гидролизатах клеточных стенок и выделенных из них ТК были обнаружены фосфорные эфиры глицерина и глюкоза. В продуктах HF-гидролизе ТК всех трех штаммов обнаружено по два гликозида: Г1 — б-глюкопиранозил-(1>2)-глицерин и Г2 — б-глюкопиранозил-(1>1)-глицерин. Обнаружение двух гликозидов свидетельствовало о присутствии в клеточных стенках двух ТК (ТК1 и ТК2), имеющих одинаковый поли (глицерофосфатный) кор и одинаковые заместители — б-глюкопиранозу, которая присоединена к глицериновым остаткам по-разному. Фосфодиэфирную связь в полимерах локализовали с помощью ЯМР-спектроскопии. Таким образом, в трех штаммах G. harbinensis обнаружено по две ТК: ТК1 — 1,3-поли (глицерофосфат), полностью замещенный по гидроксилу при С2 глицерина остатками б-глюкозы; а также ТК2 — 2,3-поли (глицерофосфат) с остатками б-глюкозы по гидроксилу при С1 глицерина (Тульская и др., 1993; Потехина и др., 1998).
5.3. Структуры тейхоевых кислот клеточных стенок видов рода Nocardioides
В этом разделе представлены сведения о структурах ТК, обнаруженных нами у изученных представителей рода Nocardioides (Prauser, 1976).
N. albus ВКМ Ас-805Т. Продукты кислотного гидролиза клеточных стенок и препарата ТК из них свидетельствовали о наличии ТК глицерофосфатной природы (табл. 1), имеющей заместители (обнаружены галактоза, глюкоза и пировиноградная кислота). Отсутствие среди них дифосфата глицерина и обнаружение в щелочных гидролизатах лишь монофосфорного эфира глицерина (Э1) указывало на поли (гликозилглицерофосфатную) природу ТК (табл.1). Эфир Э1 состоял из монофосфата глицерина, галактозы, глюкозы и пировиноградной кислоты в эквимолярном количестве. Вероятно, Э1 являлся основным повторяющимся звеном ТК. Полная структура полимера была установлена ЯМР-спектроскопическими методами. Сигналы при 70,6−72,2 и 67,85 м.д. были типичными для резонанса С1 и С3 глицериновых остатков в спектре поли (гликозилглицерофосфатной) цепи с гликозильными заместителями при С1 глицерина (Naumova et al., 1990). Сигналы при 25,9 (СН3-С), 101,9 (О-С-О) и 174,7 м.д. (С=О) были идентифицированы как принадлежащие остатку пировиноградной кислоты, локализованному в положениях 4,6 пиранозы (Шашков и др., 1992). Сигналы при 22,0 и 176,7 м.д. принадлежали О-ацетильным группам. Сигнал малой интенсивности при 109,1 м.д. обнаруживал присутствиегалактозы в фуранозной конфигурации (Bock and Pedersen, 1983). Спектры выявили присутствиегалактоиглюкопираноз как главных углеводных компонентов полимера. Было определено также, чтогалактофураноза является минорным сахарным компонентом полимера, соотношениеGalp иGalf составляет 7:1 (рассчитано по интенсивности сигналов при 104,2 + 102,5 м.д. и 109,1 м.д.). Таким образом, основная повторяющаяся единица полимера имеет следующую структуру:
OAc (0,5).
- 2
- -3)—D-Galp-(11)-snGro-(3-P-
- 4
- -D-Glcp (4,6Pyr)-1
- -галактопиранозильные остатки О-ацетилированы по гидроксилу при С2 примерно на 50%. Остатокгалактофуранозы, вероятно, является терминальным на растущем конце цепи полимера и служит сигналом для прекращения его роста. Возможность существования галактофуранозного -1,6-связанного олигомера на конце цепи подтверждается анализом ТК из клеточной стенки N. luteus другого вида этого рода. ТК указанной структуры обнаружена впервые (Шашков и др., 1999; Tul’skaya et al., 2003).
N. luteus ВКМ Ас-1246Т и 12 других штаммов с идентичной ТК. Профиль продуктов кислотного гидролиза клеточной стенки и ТК из неё указывал на наличие ТК поли (рибитфосфатной) природы с галактозой и пировиноградной кислотой в качестве заместителей (табл. 1). Среди продуктов HF-гидролиза ТК был выявлен гликозид Г1 и идентифицирован как галактозилглицерин. При щелочном гидролизе, кроме фосфорных эфиров рибита (табл.1), найдены эфиры Э1 (основной) и Э2 (минорный, подробно не изучен), имеющие одинаковый качественный состав. Э1 был монофосфатом галактозилрибита с пировиноградной кислотой. Локализация фосфодиэфирных связей и пировиноградной кислоты, наличие О-ацетильных групп (?20%) при гидроксилах по С3 рибита, конфигурация гликозидной связи и ее положение установлены с помощью ЯМР-спектроскопии, кроме того, было показано наличие -1,6-связанного олигомера, состоящего? из 6 остатков галактофуранозы (соотношение Galp: Galf составляло 3(5): 1). Молекулярная масса ТК составила 8,6−8,9 кДа, что соответствовало 18-ти повторяющимся звеньям.
- -1-Rbo-5-P-
- 4
- -D-Galp (4,6 Pyr)-1
ТК данной структуры обнаружена впервые (Шашков и др., 2000; Tul’skaya et al., 2003):
«N. albus». ВКМ Ас-806. В клеточных стенках этого штамма с использованием химических и ЯМР-спектроскопических методов были обнаружены как минимум две ТК. ТК1 — такая же по структуре как и в N. luteus, однако соотношение Galp: Galf составляло 1: 1, и ТК2 — полимер поли (рибитфосфатной) природы с рамнозой в качестве заместителя (Tul'skaya et al., 2003).
5.4. Структуры анионных полимеров клеточных стенок некоторых видов рода Streptomyces
К началу наших исследований наибольшее количество ТК было изучено именно у представителей рода Streptomyces (Наумова, Шашков, 1997), относящихся к различным филогенетическим и фенотипическим группам. В настоящей работе были исследованы представители близких видов этого рода.
S. castelarensis ВКМ Ас-832Т (ранее S. rutgersensis ssp. сastelarensis). В кислотных гидролизатах клеточной стенки и препарата анионных полимеров из нее обнаружен глицерин и его фосфорные эфиры, глюкозамин, лизин, галактоза. Разделение в электрическом поле препарата полимеров, выделенном из клеточной стенки, выявило две фосфорсодержащие зоны, что свидетельствовало о наличии как минимум двух ТК поли (глицерофосфатной) природы. Было предпринято дробное выделение полимеров из целого обезжиренного мицелия с последующим дробным осаждением 96%-ным этанолом и очисткой методом переосаждения в ледяной воде. Это позволило получить препараты, преимущественно содержащие ту или другую ТК. Дополнительную очистку ТК осуществляли методом ионообменной хроматографии на DEAE-Toyopearl 650M в линейном градиенте NaCl.
Препарат 1, имеющий электрофоретическую подвижность mGroP 1,2−1,3, при кислотном и щелочном гидролизах дал продукты, характерные для незамещенной глицеринтейхоевой кислоты 1,3-типа (табл. 1). Мольное соотношение фосфор — глицерин было 1: 1. Следовало иметь ввиду присутствие в этом препарате незамещенного 2,3-поли (глицерофосфата), так как последний дает аналогичные результаты при его химических исследованиях, за исключением диглицеринтрифосфата при щелочном гидролизе. Вопрос был решен ЯМР-спектроскопическими методами.
Препарат 2, с электрофоретической подвижностью mGroP 0,9, в составе кислотных гидролизатов имел глицерин и его фосфорные эфиры, глюкозамин и лизин. HF-гидролиз препарата 2 привел к образованию двух гликозидов: Г1 — GlcpNAc-(1>2)-snGro и Г2 — GlcpNН-(1>2)-snGro и фрагмента цепи ТК — Lys-(1>2)-Gro. Эти данные в совокупности с результатами изучения продуктов щелочного гидролиза препарата 2, среди которых были найдены два фосфодиэфира глицерина с глюкозамином, причем лишь один из фосфодиэфиров был нингидрин положительным, привели к предположению, что ТК из этого препарата является 1,3-поли (глицерофосфатом) частично замещенным глюкозамином, только часть остатков которого ацетилирована. Молекулярная масса этой ТК составила 6,0 кДа, что соответствует ~25 глицерофосфатным единицам.
Независимо оба препарата были исследованы методом ЯМР-спектроскопии. В результате химическими и ЯМР-спектроскопическими исследованиями удалось установить, что клеточная стенка S. castelarensis ВКМ Ас-832Т содержит набор различных ТК. Минорные — незамещенные 1,3- и 2,3-поли (глицерофосфаты), основная — 1,3-поли (глицерофосфат), треть мономеров имеет по гидроксилам при С2 глицерина глюкозаминильные остатки, только часть которых N-ацетилирована. ТК такой структуры найдена впервые (Tul'skaya et al., 1991).
S. melanosporofaciens ВКМ Ас-1864Т, S. hygroscopicus ВКМ Ас-831Т, S. violaceusniger ВКМ Ас-583Т, S. endus ВКМ Ас-1331Т, S. endus ВКМ Ас-129. Продукты кислотного и щелочного гидролизов клеточных стенок и суммарных препаратов из них свидетельствовали (табл. 1) о присутствии 1,3-поли (глицерофосфата), а обнаруженные галактоза и глюкозамин — что ТК, замещена сахарными остатками. Электрофорез выявил три фракции, которые были накоплены методом препаративного электрофореза, элюированы, лиофилизованы и исследованы отдельно.
Фракция 1 (mGroP 1,3−1,4) представляла собой, скорее всего, смесь свободных 1,3- и 2,3-поли (глицерофосфатных) цепей (Тульская и др., 1997), о чем свидетельствовали продукты ее кислотного и щелочного гидролизов (табл. 1). Фракция 2 (основная ТК, mGroP 0,82−0,9) — идентифицированы 1,3-поли (глицерофосфатные) цепи, частично замещенные б-глюкозамином, причем часть глюкозаминильных остатков N-ацетилирована в той или иной степени (кроме штамма Ас-1864Т, в ТК которого все глюкозаминильные остатки N-ацетилированы). В продуктах деградации основной ТК из S. hygroscopicus, S. endus Ас-1331Т и Ас-129, S. violaceusniger с помощью гидроксамовой реакции были обнаружены О-ацетильные остатки. Фракция 3 имела электрофоретическую подвижность mGroP 0,3 и окрашивалась реактивом Ишервуда в серый цвет. При кислотном гидролизе обнаружена галактоза, а также в следовом количестве продукты деградации ТК из фракции 2 — это свидетельствовало о том, что последняя не была основным компонентом этой фракции.
Суммарные препараты клеточных стенок каждого исследуемого стрептомицета были изучены методами ЯМР-спектроскопии. Эти исследования подтвердили предварительные предположения, основанные на химических методах. Таким образом, клеточные стенки исследуемых стрептомицетов содержали одновременно четыре анионных углеводсодержащих полимера. Три ТК: незамещенные 1,3- и 2,3-поли (глицерофосфаты) и 1,3-поли (глицерофосфат) с большей или меньшей степенью замещения остатками б-глюкозамина, часть которых N-ацетилирована (табл. 6). Четвертый — обнаруженный впервые в природе полимер Kdn, замещенный в-Galp, состоящий ~ из 20 мономерных звеньев (Тульская и др. 2007а).
Итак, ТК данной группы стрептомицетов были аналогичны таковым у S. castelarensis ВКМ Ас-832Т, а в клеточных стенках последнего была также найдена галактоза, поэтому было предпринято повторное исследование препаратов полимеров этого штамма на предмет обнаружения полимера Kdn. В результате методами ЯМР-спектроскопии в препаратах из клеточной стенки S. castelarensis также был идентифицирован полимер Kdn той же структуры, что и у вышеупомянутых штаммов (Тульская и др. 2007а).
S. sparsogenes ВКМ Ас-1744Т. Профили кислотного и щелочного гидролизов клеточной стенки и препарата ТК свидетельствовали (табл. 1) о присутствии полностью замещенной гликозильными заместителями поли (глицерофосфатной) цепи 1,3-типа. В качестве гликозильных заместителей были выявлены глюкозамин, галактозамин и глюкоза. Дополнительная информация была получена при изучении продуктов гидролиза ТК 47%-ной HF. Идентифицировано два соединения. Соединение 1 было идентично GlcpNAc-(1>2)-snGro, полученному нами ранее из ТК2 S. castelarensis. Соединение 2 содержало галактозамин и глюкозу. ЯМР-спектроскопические исследования препарата из клеточной стенки и соединения 2 позволили установить повторяющуюся единицу основной ТК:
в-D-Glcp-(1>3)-б-D-GalpNAc-(1>3)-в-D-GalpNAc-(1>6)-б-D-GlcpNAc-1.
- v
- 2
- -1)-sn-Gro-(3-P-
ТК такой структуры обнаружена впервые (Шашков и др., 1998). Электрофорез выявил присутствие минимум двух ТК в клеточной стенке стрептомицета: кроме основной ТК обнаружено минорное количество незамещенного 1,3-поли (глицерофосфата), что было подтверждено ЯМР-спектроскопическим исследованием. Молекулярная масса основной ТК составила 9,8 кДа, что соответствует приблизительно 11 повторяющимся звеньям.
Streptomyces sp. ВКМ Ас-2274 (=МБ-8). Продукты кислотного и щелочного гидролизов клеточной стенки и ТХУ-препарата указывали на присутствие 1,3-поли (глицерофосфатных цепей), табл. 1, а обнаружение галактозы, 3-О-метилгалактозы (мадурозы), глюкозамина предполагало, что-либо эти сахариды являются заместителями в молекуле ТК, либо они образуют некий гликополимер. ТХУ-препарат в электрическом поле разделился на три фракции, которые были накоплены и исследованы отдельно.
Фракция 1 (минорная, mGroP 1,3). При кислотном гидролизе идентифицированы моно-, бисфосфаты глицерина и неорганический фосфат. Образование таких же продуктов, а также диглицеринтрифосфата при щелочном гидролизе могло свидетельствовать о том, что фракция 1- незамещенный 1,3-поли (глицерофосфат) (Kelemen and Baddiley, 1961). Фракция 2 (основная, mGroP 0,82). После кислотного гидролиза обнаруживались глицерин, его монои бисфосфаты, неорганический фосфат и глюкозамин. Изучение продуктов HF- (гликозид Г1) и щелочного гидролизов (фосфодиэфир Э1) привело к предположению, что ТК этой фракции — 1,3-поли (глицерофосфат), частично замещенныйN-ацетилглюкозамином. Фракция 3 (mGroP 0,56). Окрашивалась реактивом Ишервуда в серый цвет. Кислотный гидролиз привел к образованию, галактозы, 3-O-метилгалактозы, а также следовых количеств продуктов деградации ТК из фракции 2. Следовательно, ТК не являлась основным полимером этой фракции.
Суммарный препарат полимеров, а также фракции 2 и 3 исследовали ЯМР-спектроскопическими методами, кроме того, фракция 3 была подвергнута MALDI TOF масс-спектроскопическому анализу. В результате проведенных исследований оказалось, что клеточная стенка исследуемого стрептомицета содержит в своем составе две ТК. Основная — 1,3-поли (глицерофосфат), на 60% замещенныйD-N-ацетилглюкозамином; минорная — незамещенный 1,3-поли (глицерофосфат). Кроме того — олигомер 3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновой кислоты (Kdn), имеющий следующую структуру:
- (-D-Galp3OMe) -D-Galp-1 1—D-Galp3OMe (-D-Galp)
- 9 9
- -Kdn-(24)—Kdn
Кислый олигосахарид такой структуры обнаружен впервые (Shashkov et al., 2002).
Streptomyces sp. МБ-2, МБ-5, МБ-6, МБ-7, МБ-10. В кислотных гидролизатах клеточных стенок были идентифицированы рибит, его монои бисфосфаты, ангидрорибитфосфат, неорганический фосфат, ангидрорибит, глюкоза, галактозамин, пировиноградная кислота (для трех штаммов: МБ-2, МБ-5, МБ-6), а также неидентифицированное нингидрин-положительное соединение. Кислотный гидролизат суммарных препаратов из клеточных стенок этих стрептомицетов содержал тот же набор продуктов. Однако количество глюкозы было бьльшим, чем количество рибитфосфата во всех случаях, кроме МВ-5. Полученные данные однозначно свидетельствовали о наличии рибиттейхоевой кислоты с глюкозой в составе суммарных препаратов, и не исключали присутствия полимеров иного строения, в структуру которых также входит глюкоза. Таким образом, можно было предположить, что эти организмы содержат в клеточных стенках похожий набор анионных полимеров. Электрофорез суммарных препаратов из каждого организма в отдельности выявил несколько фракций, которые были накоплены методом препаративного электрофореза, элюированы, лиофилизированы и исследованы отдельно.
Фракция 1 (mGroP 1,3), стрептомицеты MB-2, MB-5, MB-6. Продукты кислотного гидролиза (табл. 1) свидетельствовали о том, что фракция 1, вероятно, является 1,5-поли (рибитфосфатом), несущим остатки пировиноградной кислоты. Предположение было подтверждено данными ЯМР-спектроскопического анализа. Фракция 2, (mGroP 0,9−1,1), все 5 стрептомицетов. Профили продуктов кислотного и щелочного гидролизов этой фракции указывали на поли (рибитфосфатную) природу ТК из нее. Образование при щелочном гидролизе фосфорного эфира, идентифицированного как глюкозилрибитфосфат, а при HF-гидролизе гликозида, определенного как глюкозилрибит, свидетельствовало о том, что полимером фракции 2, вероятно, являлся 1,5-поли (рибитфосфат), замещенный глюкозой, что было подтверждено ЯМР-спектроскопическими исследованиями. Фракция 3 (mGroP 0,45−0,52), для 4-х стрептомицетов, кроме МБ-10. Кислотный гидролиз привел к образованию галактозамина, а также неидентифицированного нингидрин положительного соединения, и, кроме того, следовых количеств продуктов деградации ТК из фракции 2. Структура полимера этой фракции была установлена методами ЯМР-спектроскопии для каждого организма. Это была тейхуроновая кислота: >4)-в-D-ManpNAcA-(1>3)-б-D-GalpNAc-(1>, найденная ранее (Шашков и др., 2001) у стрептомицетов. Фракция 4 (mGroP 0,34), для всех стрептомицетов, за исключением МВ-5. Окрашивалась реактивом Ишервуда в серый цвет, в кислотных гидролизатах этой фракции найдена глюкоза и неидентифицированное соединение, окрашивающееся азотнокислым серебром. Структура полимера этой фракции была расшифрована с помощью ЯМР-спектроскопических исследований. Им оказался полимер 3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновой кислоты (Kdn), замещенныйглюкозой (Shashkov et al., 2000).
Итак, клеточные стенки 5-ти стрептомицетов содержали по два-четыре анионных углеводсодержащих полимера. Среди них ТК: 1,5-поли (рибитфосфат), разной степени замещения в-Glcp, встречающийся во всех изученных организмах; а также 1,5-поли (рибитфосфат), несущий кетально связанную по гидроксилам при С2-С4 рибита пировиноградную кислоту, который был обнаружен в клеточных стенках лишь трех (МБ-2, МБ-5, МБ-6) стрептомицетов. Для 4-х изученных организмов характерно наличие в клеточных стенках тейхуроновой кислоты. Клеточные стенки почти всех изученных стрептомицетов (кроме МБ-5) содержат полимер Kdn, замещенный в-Glcp (табл. 9, Тульская и др, 2003).
Streptomyces sp. ВКМ Ас-2534 (=Ив-219). Продукты кислотного гидролиза клеточной стенки и суммарного препарата полимеров указывали на присутствие ТК поли (рибитфосфатной) природы (табл. 1), видимо, с глюкозой и глюкозамином в качестве заместителей, а также неидентифицированного нингидрин положительного соединения. Электрофорез суммарного препарата привел к разделению на две фракции, которые были накоплены электофоретически, элюированы, лиофилизированы и исследованы отдельно.
Фракция 1 (mGroP 1,10), минорная, содержала ТК рибитфосфатной природы, вероятно, несущей в качестве заместителей глюкозу и глюкозамин, о чем свидетельствовали продукты кислотного гидролиза (табл. 1). При аммонолизе фракции образовались лизин и амид лизина, последний, по-видимому, входил в структуру ТК. Изучение продуктов дефосфорилирования (HF-гидролиз) привело к обнаружению двух гликозидов, идентифицированных как: Г1 — глюкозилрибит; Г2 — N-ацетилглюкозаминилрибит. Можно было предположить, что полимер этой фракции представляет собой 1,5-поли (рибитфосфатную) ТК, отдельные рибитфосфатные остатки которой несут глюкозу, в то время как другие — замещены N-ацетилглюкозамином. Фракция 2 (mGroP 0,52), преобладающая, была проявлена реактивом Ишервуда в виде белого пятна на фореграмме. Кислотные гидролизаты этой фракции содержали лишь следовые количества продуктов деградации фракции 1, а также неидентифицированное нингидрин положительное соединение. Таким образом, ТК не являлась основным компонентом этой фракции.
Тип фосфодиэфирной связи, положение гликозильных заместителей и их конфигурация в ТК фракции 1, а также структура полимера из фракции 2 были определены с помощью ЯМР-спектроскопии.
Таким образом, было доказано, что клеточная стенка изучаемого фитопатогенного стрептомицета содержит два анионных углеводсодержащих полимера. Минорный полимер — ТК, 1,5-поли (рибитфосфатные) цепи которой несут по гидроксилам при С-2(4) рибита в-глюкопиранозу, однако некоторые рибитфосфатные звенья полимера замещены в-N-ацетилглюкозамином, нарушая тем самым его регулярность. Второй полимер, преобладающий, представлял собой тейхуроновую кислоту, повторяющейся единицей которой является дисахарид:
4)—D-Manp2,3NAcyA-(13)—D-GalpNAc-(1, где Acy — ацетил или L-Glu.
Полимер такой структуры обнаружен впервые у грамположительных бактерий (табл. 9, Тульская и др., 2007б).
5.5. Тейхоевая кислота и полисахарид клеточной стенки Kineosporia aurantiaca ВКМ Ас-702Т.
К началу наших исследований имелись сведения (Евтушенко и др., 1984) о том, что клеточная стенка Kineosporia aurantiaca ВКМ Ас-702Т, представителя семейства Kineosporiaceae подпорядка Frankineae, содержит ТК глицерофосфатной природы. Однако структурные исследования последней, а также возможных других гликополимеров, имеющихся в ней, ранее не проводили.
В кислотных гидролизатах клеточной стенки и суммарного препарата из неё обнаружены галактоза и манноза, а также некоторое количество глицерина, его монои бисфосфатов, неорганический фосфат и глюкозамин. Электрофорез суммарного препарата обнаружил наличие двух фракций, которые были накоплены методом препаративного электрофореза, элюированы, лиофилизированы и исследованы отдельно.
Фракция 1 (минорная, mGroP 0,93) при кислотном гидролизе дала продукты, позволяющие предположить наличие глицеринтейхоевой кислоты, замещенной глюкозамином (табл. 1). Ценная информация о структуре ТК была получена при изучении фосфорных эфиров, полученных после щелочного гидролиза фракции 1, а также гликозидов, полученных после ее обработки 47%-ной HF. Полученные продукты гидролизов, изученные по схеме, приведенной для S. сastelarensis, оказались идентичными таковым для названного стрептомицета. Таким образом, следовало думать, что полимер из фракции 1 является 1,3-поли (глицерофосфатом) частично замещенным б-глюкозаминильными остатками, только часть которых N-ацетилирована. Это предположение было подтверждено ЯМР-спектроскопическими исследованиями. Фракция 2 (основная) была электронейтральна и проявлена на фореграмме AgNO3 в нейтральной области. При кислотном гидролизе найдены галактоза и манноза в соотношении ~ 1: 2. Абсолютная конфигурация галактозы и маннозы определена методом ГЖХ после их превращения в ацетилированные (S)-октан-2-ил гликозиды сравнением с октан-2-ил D-гликопиранозами (Gerwig et al., 1979). Эти результаты показали, что данная фракция вероятнее всего содержит нейтральный полисахарид. Структура последнего была полностью расшифрована с помощью ЯМР-спектроскопии.
Моносахаридная последовательность в повторяющейся единице полисахарида установлена на основании анализа 1H, 1H ROESY и 1H, 13C HMBC спектров:
>3)-в-d-Galp-(1>6)-в-d-Manp-(1>4)-в-d-Manp-(1>3)-в-d-Galp-(1>4)-в-d-Manp-(1>4)-в-d-Manp-(1>.
Одинаковая D-конфигурация каждого из моносахаридных остатков подтверждена при определении гликозилирующих эффектов в 13C ЯМР спектрах полисахарида (Lipkind et al., 1988; Shashkov et al., 1988). Структура данного нейтрального полисахарида описана впервые (Tul'skaya et al., 2005).
Анализ собственных результатов и литературных данных указывает на широкое распространение тейхоевых кислот в клеточных стенках представителей порядка Actinomycetales: более 80% всех изученных нами к настоящему времени штаммов актиномицетов содержат эти полимеры, причем до 70% всех обнаруженных тейхоевых кислот составляют глицеринтейхоевые кислоты. Рибиттейхоевые кислоты менее распространены в клеточных стенках бактерий. И, наконец, тейхоевые кислоты, содержащие другие полиолы (эритрит, арабит, маннит, 6-О-метил-галактит) в коре полимера, выявлены у актиномицетов в редких случаях, рис. 4.
Рис. 4. Известные в настоящее время полиолы, входящие в состав тейхоевых кислот.
Заметим, что именно для глицеринтейхоевых кислот обнаружено наибольшее разнообразие (рис. 4.) в локализации фосфодиэфирных связей: 1,3- и 2,3-поли (глицеринфосфаты), поли (гликозилглицеринфосфаты), поли (глицеринфосфат-гликозилглицеринфосфаты). Недавно найден новый тип тейхоевых кислот: поли (ацилгликозилглицерофосфат), фосфодиэфирная связь в котором осуществляется по гидроксилу при С2 глицериновой кислоты, ацилирующей хиновозамин в коре полимера, и гидроксилу при С3 остатка глицерина (Козлова и др., неопубликованные данные).
Итак, глицеринтейхоевые кислоты наиболее широко распространены в природе, и среди них выявлено наибольшее разнообразие структур.
Интересные данные были получены в наших совместных работах с сотрудниками группы чл.-корр. РАН И. С. Кулаева (Кулаев и др., 1996; Степная и др., 1997, 2004). Бактерии с глицеринтейхоевой кислотой были практически не подвержены действию комплекса литических ферментов, тогда как наличие рибиттейхоевой и/или тейхуроновой кислот приводило к усиленному лизису микроорганизмов. Возможно, глицеринтейхоевые кислоты защищают микробную клетку от лизиса.
Являются ли глицеринтейхоевые кислоты наиболее значимыми для выживания микроорганизмов в их экологической нише по сравнению с другими тейхоевыми кислотами, в коре которых имеются другие полиолы, предмет дальнейших исследований.
Глава VI. Тейхоевые кислоты клеточных стенок как видоспецифический маркер актиномицетов.
Ранее было показано успешное применение признака «наличие тейхоевых кислот» для разделения стафилококков и микрококков (Schleifer and Stackebrandt, 1983): первые содержат ТК, вторые — нет. Идея о возможности использования ТК в систематике актиномицетов была выдвинута впервые немецкими исследователями для рода Brevibacterium (Fiedler et al., 1981) и развита в работе И. Б. Наумовой (Naumova, 1988).
Участие ТК клеточных стенок в жизненно важных процессах, происходящих в живой бактериальной клетке (Neuhaus and Baddiley, 2003; Weidenmaier and Peschel, 2008), их колоссальное структурное разнообразие (см. Главу V, обзоры: Наумова и Шашков, 1997; Потехина, 2006; Naumova et al., 2001), детерминированное информацией, содержащейся в кодирующих их генах (Lazarevic et al., 2002), а также их широкое распространение в грамположительных бактериях (наши данные; Weidenmaier and Peschel, 2008), с очевидной вероятностью демонстрируют возможность их применения в систематике бактерий.
С начала 70-х годов в таксономической практике успешно используется строение пептидогликана (Schleifer and Kandler, 1972) — основного гликополимера клеточной стенки прокариот. Тогда как таксономическая значимость структур ТК и других гликополимеров клеточной стенки с таксономической точки зрения не оценена в полной мере, поскольку до сих пор не проводилось направленного анализа с целью обнаружения коррелятивных связей между наличием и структурой ТК и гликополимеров клеточных стенок актиномицетов и таксономическим статусом последних. К настоящему времени показана возможность использования тейхоевых кислот в качестве видоспецифического маркера для представителей родов Agromyces (Гнилозуб, 1994), Actinomadura, Nonomurea и Brevibacterium (Потехина, 2005).
В настоящей главе анализируются полученные автором и литературные данные о структурных типах и подтипах ТК, обнаруженных в клеточных стенках представителей нескольких родов актиномицетов (Nocardiopsis, Glycomyces, Nocardioides, Streptomyces), принадлежащих 4-м различным семействам четырех подпорядков порядка Actinomycetales.
6.1. Структуры и набор тейхоевых кислот клеточных стенок как видоспецифические маркеры видов и подвидов рода Nocardiopsis.
В данном разделе проанализированы собственные результаты (29 штаммов) и литературные данные (5 штаммов) исследования клеточных стенок 34 штаммов, принадлежащих к 13 видам и подвидам рода Nocardiopsis (семейство Nocardiopsaceae, подпорядок Streptosporangineae, Fisher et al., 1983; Yassin et al., 1993; 1997; Evtushenko et al., 2000; Al-Zarban et al., 2002; Kдmpfer et al., 2002). Структуры и комбинация ТК в клеточных стенках актиномицетов рода Nocardiopsis хорошо коррелируют с филогенетической группировкой этих организмов, основанной на данных анализа генов 16S рРНК и данными ДНК-ДНК гибридизации. С другой стороны, филогенетически близкие организмы (сходство генов 16S рРНК до 99,9%) различаются по составу анионных полимеров.
Таблица 2. Тейхоевые кислоты клеточных стенок видов и подвидов рода Nocardiopsis.
Тейхоевая кислота. | N. dassonvillei ssp. dassonvillei. | N. synnematofor-mans. | N. halotolerans. | N. dassonvillei ssp. albirubida 1. | N. alba (3 strains). | N. listeri 2. | N.metallicа. | N. prasina. | N. lucentensis 2. | N.compostа. | N. trehalosi. | N.tropica 3. | |
Группа N. dassonvillei. | Группа N. alba. | ||||||||||||
Поли (глицерофосфат-в-N-ацетилгалактозаминилглицерофосфат)/ связь -3-P-3 ; | |||||||||||||
Поли (глицерофосфат-в-N-ацетилгалактозаминилглицерофосфат)/ связь -3-P-4 ; | |||||||||||||
Поли (глицерофосфат-в-N-ацетилгалактозаминил-глицерофосфат)/ связь -3-P-3 -, с пируват-кетальной группой. | |||||||||||||
Поли (глицерофосфат-в-N-ацетилгалактозаминил-глицерофосфат)/ связь -3-P-4 —, с O-сукцинильным остатком. | |||||||||||||
Незамещенный 3,5-поли (рибитфосфат) ТК1. | |||||||||||||
1,5-Поли (рибитфосфат) с 2,4- пируват-кетальной группой ТК3. | |||||||||||||
1,3-Поли (глицерофосфат) сN-ацетилглюкозамином ТК2. | |||||||||||||
1,3- Поли (глицерофосфат) с в-глюкозой. | |||||||||||||
1,5- Поли (рибитфосфат) с боковыми глицерофосфатными олигомерами. | |||||||||||||
1 Шашков и др, 1997; 2 Стрешинская и др., 1998; 3 Стрешинская и др., 1996.
основная (преобладающая) тейхоевая кислота.

Рис. 5. 13С ЯМР-спектры ТК клеточных стенок видов и подвидов Nocardiopsis.
Таблица 3. Дифференцирующие характеристики видов и подвидов рода Nocardiopsis, основанные на сравнении продуктов химической деградации общей фракции ТК или клеточных стенока).
Продукты химической деградации. | N. dassonvillei ssp. dassonvillei. | N. synnematofor-mans. | N. halotolerans. | N. dassonvillei ssp. albirubida 1. | N. alba (3 штамма). | N. listeri 2. | N.metallicа. | N. prasina. | N. lucentensis 2. | N.compostа. | N. trehalosi. | N.tropica 3. | |
Группа N. dassonvillei. | Группа N. alba. | ||||||||||||
Кислотный гидролиз. | |||||||||||||
Глицерин Рибит Глюкоза Глюкозамин Галактозамин Пировиноградная кислота Янтарная кислота. | |||||||||||||
Щелочной гидролиз. | |||||||||||||
Глицерин. GroP, GroP2. Рибит. RboP, RboP2. RboP3. Э3б) Фосфодиэфир Gro c GlcNAc. | сл. | сл. | сл. | сл. | сл. | сл. | сл. | сл. | |||||
а) +, присутствует;, отсутствует; б) Фосфодиэфир содержит два остатка глицерина, один — N-ацетилгалактозамин и три фосфатных группы: P-(¾)-GalpNAc-(1>2)-snGro-3-P-1-snGro-2-P; 1 Шашков и др, 1997; 2 Стрешинская и др., 1998; 3 Стрешинская и др., 1996.
В первую группу (табл. 2) N. dassonvillei (N. dassonvillei ssp. dassonvillei, N. synnematаformans, N. halotolerans, N. dassonvillei ssp. albirubida) входят организмы, содержащие в клеточной стенке уникальный, обнаруженный только у представителей этого рода поли (полиолфосфатгликозилполиолфосфат). Штаммы вида N. dassonvillei ssp. dassonvillei, имеют единственную ТК с фосфодиэфирной связью между глицерином и аминосахаром по (-3-P-3-). Два вида N. synnematаformans и N. halotolerans, содержат по две ТК: минорную — с фосфодиэфирной связью между глицерином и аминосахаром по (-3-P-4-) и основную — N. synnematаformans, как и у N. dassonvillei ssp. dassonvillei, а N. halotolerans — ТК с кетально связанным пируватом; и, наконец, подвид N. dassonvillei ssp. albirubida (Шашков и др, 1997), имеет единственную ТК с фосфодиэфирной связью между глицерином и аминосахаром по (-3-P-4-), но несущую сукцинильный остаток по гидроксилу при С3 аминосахара.
Во вторую группу (табл. 2) N. alba (N. alba, N. prasina, N. composta, N. metallica, N. listeri, N. lucentensis) объединяются виды, содержащие в клеточных стенках различный набор полимеров: ТК1, ТК2 и ТК3 (табл. 2). При одинаковом наборе ТК имеются выраженные количестванные различия в их содержании (основная или минорная ТК, N. listeri и N. metallicа), а также степени замещения и длине цепи полимера (N. lucentensis и N. composta). Два других изученных организма этого рода N. tregalosei и N. tropica (Стрешинская и др., 1996) содержат в клеточной стенке ТК иных структур (табл. 2), имеют низкую степень филогенетического родства как между собой, так и с N. dassonvillei и с N. alba.
Следует отметить, что именно на этой группе организмов впервые показана возможность использования 13С ЯМР-спектров как фингерпринтов для идентификации видов и подвидов рода Nocardiopsis (рис. 5).
Кроме того, виды и подвиды рода Nocardiopsis отличаются по набору и комбинации продуктов кислотного гидролиза как самих полимеров, так и нативных клеточных стенок, которые могут быть легко определены с использованием методов хроматографии (табл. 3). Определение некоторых специфических продуктов щелочного гидролиза полимера или нативной клеточной стенки расширяет таксономические возможности при использовании этого подхода. Например, N. alba и N. listeri, которые характеризуются похожими профилями продуктов кислотной деградации (табл. 3), можно отличить друг от друга по наличию в щелочных гидролизатах их клеточных стенок монои бисфосфатов рибита у N. alba.
6.2. Структуры и набор тейхоевых кислот клеточных стенок как видоспецифический маркер актиномицетов рода Glycomyces
В данном разделе проанализированы собственные результаты исследования клеточных стенок 5 штаммов трех видов рода Glycomyces (семейство Glycomycetaceae подпорядок Glycomycineae): G. harbinensis (три штамма) и G. rutgersensis, а также G. tenuis, правомочность выделения которых подтверждена данными ДНК-ДНК гибридизации и анализа последовательностей 16S рРНК генов (Labeda et al., 1985).
Виды рода Glycomyces хорошо идентифицируются при сравнении набора и структур ТК клеточных стенок, установленных химическими и ЯМР спектроскопическими методами (табл. 4). Вид G. tenuis характеризуется наличием в клеточных стенках редко встречающейся эритриттейхоевой кислоты (Potekhina et al., 1993).
Таблица 4. Тейхоевые кислоты клеточных стенок видов рода Glycomyces.
Тейхоевая кислота. | G. tenuis. | G. rutgersensis. | G. harbinensis. (три штамма). | |
1,4-Поли (эритритфосфат), замещенный по С2(3) эритритаглюкозамином. | ||||
1,3-Поли (глицерофосфат), замещенный по С2 глицеринаглюкозой ТК1. | ||||
2,3-Поли (глицерофосфат), замещенный по С1 глицеринаглюкозой ТК2. | ||||
Для вида G. rutgersensis характерным оказался 1,3-поли (глицерофосфат) практически полностью замещенный по гидроксилам при С2 глицеринаглюкозой, а в клеточных стенках у всех штаммов вида G. harbinensis были обнаружены одновременно две ТК: 1,3-поли (глицерофосфат), замещенный по гидроксилам при С2 глицеринаглюкозой (ТК1) и 2,3-поли (глицерофосфат), замещенный по гидроксилам при С1 глицеринаглюкозой (ТК2), причем количественное соотношение этих двух ТК варьировало в зависимости от штамма (см. ниже).
И в данном случае в качестве дифференцирующих характеристик видов можно использовать продукты кислотной (HCl и HF) и щелочной деградации как самих полимеров, так и нативных клеточных стенок изучаемых организмов: глицерин, эритрит, глюкоза, глюкозамин, различные гликозиды — все эти соединения могут быть легко определены с использованием методов хроматографии и электрофореза.
Изучение спектров 13С ЯМР ТК клеточных стенок видов рода Glycomyces показало, что они значительно различаются между собой (рис. 6), поэтому соответствующие им полимеры можно идентифицировать при наличии соответствующих баз данных по химическим сдвигам.
Характерными явились химические сдвиги в аномерной области атомов углерода при 99,7 м.д. (рис. 6). Учитывая интегральные интенсивности сигналов углеродных атомов ТК1 и ТК2, было вычислено, что в клеточной стенке G. harbinensis NRRL 16 897 ТК2 в два раза больше, чем ТК1. Анализ гликозидов, полученных из клеточных стенок двух других штаммов G. harbinensis IFO 14487T и G. harbinensis ВКМ Ас-1247Т показал, что ТК1 и ТК2 находятся в них примерно в одинаковом количестве. Следует учесть, что все три исследуемых штамма были выращены в стандартных условиях — до середины логарифмической фазы роста. Эти данные, вероятно, можно расценивать как штаммовые различия внутри вида G. harbinensis, выявленные с помощью ЯМР-спектроскопических методов анализа.
тейхоевый кислота гликополимер клеточный.
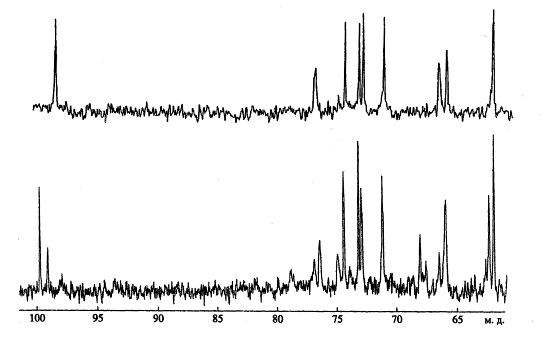
Рис. 6. 13С ЯМР спектры ТК клеточных стенок видов рода Glycomyces. Вверху — для G. rutgersensis, внизу — для G. harbinensis.
6.3 Структуры и набор тейхоевых кислот клеточных стенок как видоспецифические маркеры видов и подвидов рода Nocardioides
Род Nocardioides (семейство Nocardioidaceae, подпорядок Propionibacterineae) был предложен в 1976 году Г. Праузером (Prauser, 1976) для нокардиоформных актиномицетов с Nocardioides albus в качестве типового вида.
В данном разделе проанализированы собственные результаты обследования клеточных стенок 17 штаммов из этого рода, принадлежащих, как было установлено, к 5-ти видам.
Предварительные исследования клеточных стенок видов рода Nocardioides показали, что ТК, наличие которой определяли по образовавшимся фосфорным эфирам после кислотного гидролиза клеточных стенок, присутствует у N. albus, N. luteus, N. prauseri и N. jensenii, тогда как у N. plantarum — нет. Структуры ТК установлены для видов N. albus, N. luteus и «N. albus» (см. раздел 5.3.), образующих хорошо развитый ветвящийся вегетативный мицелий, и характеризующихся высокой степенью сходства по морфологии и некоторым физиологическим признакам.
В работе изучены образующие мицелий изоляты с белыми колониями (ВКМ Ac-562, ВКМ Ac-563, ВКМ Ac-564, ВКМ Ac-565, ВКМ Ac-566, ВКМ Ac-567, ВКМ Ac-568), выделенные из почв разных регионов. Вследствие большого сходства с видом N. albus (колонии белого цвета и некоторые физиологические признаки) эти изоляты были описаны как штаммы названного вида (Евтушенко и Зеленкова, 1989).
Однако все изученные изоляты содержали в клеточных стенках ТК, идентичную таковой из клеточных стенок N. luteus ВКМ Ас-1246Т, что предполагало их ближайшее родство именно с данным видом.
Изучение ДНК-ДНК гомологии показало, что все упомянутые изоляты имеют 37−45% сходства с N. albus ВКМ Ac-805T, тогда как с N. luteus ВКМ Ас-1246Т — 63−74%, что указывало на их принадлежность к тому же геномовиду (Wayne et al., 1987), что и ВКМ Ас-1246Т.
Кроме того, обнаружено, что и другие изученные в работе штаммы рода Nocardioides (ВКМ, рабочая коллекция: ВКМ AcW-29 146, AcW-29 169, AcW-29 196, а также DSM 46 114, DSM 46 115) содержали в клеточных стенках ТК полностью идентичную таковой из клеточных стенок N. luteus ВКМ Ас-1246Т, и, следовательно, также скорее всего принадлежали к виду N. luteus — очевидно, наиболее распространенному в природе виду этого рода.
Полученные результаты показали, что члены двух геномовидов, N. albus и N. luteus (включающий штаммы с белой окраской колоний), легко дифференцируются по структуре их ТК, а также по некоторым компонентам их клеточных стенок, таким как рибит и глицерин, которые легко определяются хроматографически в гидролизатах клеточных стенок.
Таким образом, наши исследования позволили уточнить диагноз двух видов рода Nocardioides:
Nocardioides albus. В дополнение к признакам, данным Г. Праузером (1976, 1989), вид характеризуется наличием в клеточных стенках галактозы и глицерина и содержит ТК. ТК является поли (галактозилглицерофосфатом), в которомD-галактопиранозильные остатки по гидроксилам при С4 замещеныD-глюкопиранозой, несущей по гидроксилу при С4,6 кетально связанную пировиноградную кислоту S-конфигурации; соотношение пиранозной и фуранозной форм галактозы 7: 1.
Nocardioides luteus В дополнение к признакам, данным Г. Праузером (1984, 1989): вид характеризуется белой или желтой окраской воздушного мицелия; клеточнык стенки содержат галактозу, рибит и ТК. ТК является 1,5поли (рибитфосфатом), замещеннымD-галактопиранозой, несущей по гидроксилу при С4,6 кетально связанную пировиноградную кислоту R-конфигурации, соотношение пиранозной и фуранозной форм галактозы от 3: 1 до 5: 1.
Штамм «Nocardioides albus» ВКМ Ас-806 был выделен и описан Г. Праузером. Он характеризовался обильно ветвящимися гифами, растущими на поверхности и внутри агаризованных сред и образовывал нерегулярно ветвящийся или неветвящийся воздушный мицелий. И первичный, и воздушный мицелий распадался на неправильные палочковидные или кокковидные фрагменты, не способные к движению. Цвет колоний был белый, организм не синтезировал кислоту из L-рамнозы и сахарозы. На основании этих свойств он был причислен к виду Nocardioides albus.
Однако уровень сходства ДНК с обоими референтными типовыми штаммами оказался низким и составил: 36,0% с N. аlbus ВКМ Ас-805 Т и 52,2% с N. luteus ВКМ Ac-1246T. Это свидетельствовало о том, что N. аlbus ВКМ Ас-806 представлял собой третий геномовид, и его таксономическое положение, таким образом, оставалось неопределенным.
Кроме того этот штамм отличался как от N. аlbus, так и от N. luteus по составу клеточной стенки (от последнего вида — в меньшей степени).
Так в клеточной стенке ВКМ Ас-806 обнаружено по меньшей мере две ТК: одна из которых полностью идентична рибиттейхоевой кислоте из клеточной стенки N. luteus, за исключением того, что соотношение Galp: Galf составляло 1:1, вторая имела поли (рибитфосфатную) природу, с рамнозой в качестве заместителя. Таким образом, штамм ВКМ Ас-806 дифференцирован от N. luteus соотношением Galp и Galf (1Н ЯМР-спектр, сигналы при 5,34 и 5,04 м.д.) и присутствием бьльшего количества рамнозы в гидролизатах ТК или клеточной стенки (см. раздел 5.3.). Эту разницу легко установить методами хроматографии или ЯМР-спектроскопией, сигнал при 18 мд (рис. 7).

Рис. 7. 13С ЯМР-спектры ТК клеточных стенок видов Nocardioides.
От N. аlbus штамм ВКМ Ас-806 хорошо дифференцируется по наличию рибита и рамнозы (см. раздел 5.3., рис. 7) в гидролизатах ТК или клеточных стенок, которые также легко определяются методами хроматографии.
13С ЯМР-спектры ТК для представителей данного рода могут являться фингерпринтами при идентификации видов (рис. 7).
Принимая во внимание все обнаруженные различия в хемотаксономических признаках изученных видов, а также данные об их ДНК-ДНК гибридизации (36,0−52,2%), также как и существующее определение этих актинобактерий (Wayne et al., 1987), нами был предложен новый вид в составе рода Nocardioides, названный Nocardioides prauseri sp. nov, в честь германского микробиолога Гельмута Праузера, который внес большой вклад в систематику актиномицетов и описание рода Nocardioides (Tul'skaya et al., 2003).
Таким образом, клеточные стенки изученных представителей видов рода Nocardioides содержали ТК разной структуры, что подтверждает видоспецифичность структур ТК внутри этого рода. Наличие пировиноградной кислоты и в-галактофуранозы в структуре полимеров может являться признаком, характерным для изучаемого рода.
6.4 Тейхоевые кислоты клеточных стенок как хемотаксономический маркер кластер-вида «Streptomyces violaceusniger»
Род Streptomyces семейства Streptomycetaceae является в настоящее время наиболее многочисленным по видовому составу среди бактерий (включает более 500 видов). На протяжении многих лет стрептомицеты как продуценты новых биологически активных природных соединений зачастую необоснованно описывались как новые виды в связи с патентованием, и к началу 70-х годов род насчитывал около 3000 видов, большинство из которых не были включены в Список одобренных наименований (Anderson and Wellington, 2001; Kдmpfer, 2006). Достоверная дифференциация близких видов и описание новых внутри групп филогенетически близких организмов по-прежнему остаётся неразрешенной проблемой в терминах традиционных фенотипических характеристик. К одной из таких групп относится фенокластер «S. violaceusniger» (включающий виды S. violaceusniger, S. Castelarensis, S. melanosporofaciens, S. hygroscopicus, S. еndus и ряд других). Видовой статус перечисленных организмов, характеризующихся серым воздушным мицелием, спиральными спороносцами и складчатой поверхностью спор (Williams et al., 1983а; Al-Tai et al., 1999, подтверждён данными ДНК-ДНК гибридизации (Labeda and Lyons, 1991b; Kumar and Goodfellow, 2008).
Таблица 5. Отличительные характеристики ТК изученных стрептомицетов.
Характеристика. | S. melanosporo-faciens ВКМ Ас-1864Т. | S. castelarensis ВКМ Ас-832Т. | S. hygroscopicus ssp. hygroscopicus ВКМ Ас-831Т. | S. endus. ВКМ Ас-1331Т. | S. endus. ВКМ Ас-129. | S. violaceusniger ВКМ Ас-583Т. | S. sparsogenes ВКМ Ас-1744 Т. | |
Преобладающая ТК3 — 1,3-поли (глицерофосфат) с б-глюкозаминильными заместителями. | ||||||||
Степень замещения б-N-ацетилглюкозамином и б-N-глюкозамином, %. | ; | |||||||
Доля б-N-ацетил-глюкозамина, %. | ; | |||||||
1,3-Поли (глицеро-фосфат) с тетраса-харидом. | ; | ; | ; | ; | ; | ; | ||
Продукты HF-гидролиза ТК или клеточных стенок. | ||||||||
N-ацетилглюкоз-аминилглицерин. | ||||||||
Глюкозаминил-глицерин. | ||||||||
Трисахарид. | ||||||||
С целью поиска критериев, дифференцирующих фенотипически и филогенетически близкие виды группы «S. violaceusniger» (до 99,8% сходства генов 16S рРНК), было проведено сравнительное изучение ТК их клеточных стенок.
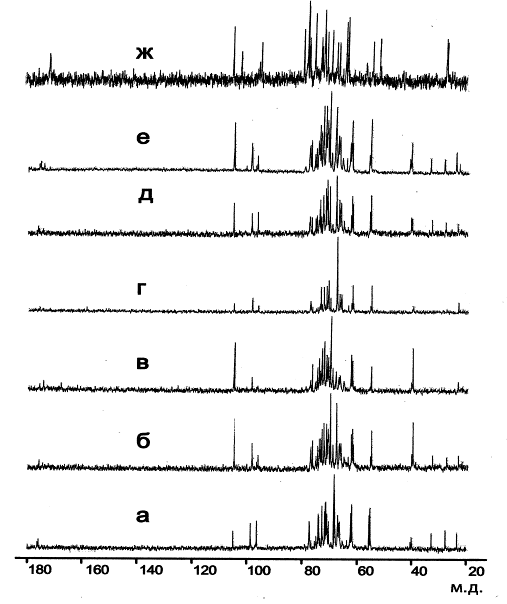
Рис. 8. 13C ЯМР-спектры суммарных препаратов анионных углеводсодержащих полимеров клеточных стенок изучаемых стрептомицетов. а — S. endus ВКМ Ас-1331Т; б — S. endus ВКМ Ас-129; в — S. hygroscopicus ssp. hygroscopicus ВКМ Ас-831Т; г — S. castelarensis ВКМ Ас-832 Т; д — S. violaceusniger ВКМ Ас-583 Т; е — S. melanosporofaciens ВКМ Ас-1864Т; ж — S. sparsogenes ВКМ Ас-1744 Т.
Сходство структуры преобладающей ТК — 1,3-поли (глицерофосфатный) кор с непосредственно присоединенным к остаткам глицерина б-глюкозамином — является еще одним свидетельством того, что филогенетически близкие организмы имеют высокое сходство. Кроме того, клеточные стенки изученных организмов (за исключением филогенетически более удаленного S. sparsogenes) содержали в дополнение к преобладающей ТК незамещенные 1,3- и 2,3-поли (глицерофосфатные) полимеры в минорном количестве. Цепи имеют также О-ацетильные и О-лизильные группы.
Штаммы близких видов кластера «S. violaceusniger» (S. melanosporofaciens, S. castelarensis, S. hygroscopicus, S. endus и S. violaceusniger) имели разную степень замещения основного полимера (66%; 50%; 40%) и различались по соотношению ацетилированных и неацетилированных глюкозаминильных заместителей (83%; 45%; 55%), выявляемых методом ЯМР-спектроскопии (табл. 5; рис. 8).
Кроме того, S. melanosporofaciens легко дифференцируется от штаммов видов S. hygroscopicus, S. endus и S. violaceusniger по наличию единственного гликозида в HF-гидролизатах клеточных стенок или суммарного препарата полимеров из нее, определяемого с помощью хроматографических методов.
S. sparsogenes, также входящий в фенокластер «S. violaceusniger» (Williams et al., 1983а), но имеющий шиповатую поверхность спор, значительно отличался от вышеперечисленных видов по составу полимеров, и содержал в клеточной стенке две ТК: минорную — незамещенный 1,3-поли (глицерофосфат) и основную — с тетрасахаридом в качестве заместителя по гидроксилам при С2 остатков глицерина. Впоследствии было показано, что этот вид более удален от других исследованных штаммов и на филогенетическом уровне (Kumar and Goodfellow, 2008).
Следует также отметить, что спектры 13С ЯМР полимеров клеточных стенок представителей фенокластера «S. violaceusniger» в целом имеют некоторые индивидуальные особенности и в данном случае могут быть также использованы как фингерпринты, полезные для дифференциации видов исследуемой группы (рис.8).
Сравнительный анализ собственных результатов исследования организмов рода Streptomyces (представители 3-х фенокластеров, Тульская и др., 1997а; 2003а; 2007а, б; Shashkov et al., 2002a) и литературных данных (5 фенокластеров, работы Стрешинской с соавт.) показывает, что имеется высокая степень корреляции между структурными особенностями тейхоевых кислот и гликополимеров клеточных стенок, с одной стороны, и генотипическими характеристиками организмов, с другой. Ряд фенокластеров, неоднородных по составу полимеров, гетерогенен также и на филогенетическом (геномном) уровне. Штаммы с высоким сходством ДНК-ДНК (55−70%) имеют практически идентичные анионные полимеры клеточных стенок и могут различаться некоторыми нюансами, например, фенокластер «S. violaceusniger», кластер-вид Streptomyces griseoviridis, кластер-вид Streptomyces cyaneus и др. Результаты исследований открывают новые возможности в решении задачи по уточнению границ видов и реорганизации таксономической структуры рода Streptomyces в целом на основе полифазного подхода.
Глава VII. Распространение тейхоевых кислот и моносахариды клеточных стенок у представителей порядка Actinomycetales.
В связи с огромной ролью, которую играют ТК в жизнедеятельности микробной клетки, а также в связи с таксономической значимостью этих биополимеров, нами были продолжены исследования по изучению распространения ТК в клеточных стенках организмов порядка Actinomycetales. Кроме того, параллельно в клеточных стенках многих из исследованных организмов был изучен моносахаридный состав, что также представляет таксономическую ценность.
Таблица 6. Распространение тейхоевых кислот среди представителей различных таксонов порядка Actinomycetales.
Подпорядок, семейство. | ТК. | Таксоны имеющие ТК. | |
Подпорядок Streptosporangineae. Сем. Nocardiopsaceae. Сем. Streptosporangiaceae*. Сем. Thermomonosporaceae*. | Все изученные виды. | ||
Подпорядок Glycomycineae. Сем. Glycomycetaceae. | Все виды Glycomyces. | ||
Подпорядок Corynebacterineae. Сем. Corynebacterineae. Сем. Gordoniaceae. Сем. Nocardiaceae. Сем. Mycobacteriaceae. |
| ||
Подпорядок Pseudonocardineae. Сем. Actinosynnemataceae. Сем. Pseudonocardiaceae. |
| ||
Подпорядок Frankineae. Сем. Geodermatophilaceae*. Сем. Frankiaceae*. Сем. Kineosporiaceae. |
В. | Kineosporia aurantiaca. | |
Подпорядок Streptomycineae. Сем. Streptomycetaceae. | В. | Все виды Streptomyces; Следы поли (GroP) у Kitasatospora spp.*. | |
Подпорядок Micrococcineae. Сем. Brevibacteriaceae*. Сем. Rarobacteraceae*. Сем. Cellulomonadaceae*. Сем. Intrasporangiaceae*. Сем. Promicromonosporaceae. Сем. Dermabacteraceae*. Сем. Microbacteriaceae*. Сем. Micrococcaceae*. |
В В. В. | Некоторые виды Brachybacterium*. Некоторые виды Agromyces*. Группа «Arthrobacter nicotinae"*. | |
Подпорядок Micromonosporineae. Сем. Micromonosporaceae*. | В. | Все виды Spirilliplanes. Большинство видов Actinoplanes. | |
Подпорядок Propionibacterineae. Сем. Nocardioidaceae. Сем. Propionibacteriaceae*. | Aeromicrobium, Nocardioides. | ||
В — признак вариабелен у представителей таксона;
- * - данные по ряду организмов указанных родов взяты из публикаций: Евтушенко и др., 1984; Наумова и Шашков, 1997; Козлова и др., 2000; Потехина, 2006; Fiedler and Schдffler, 1987; Takeuchi and Yokota, 1989; Schubert et al., 1993; Evtushenko et al., 2007.
- 7.1 Распространение тейхоевых кислот в клеточных стенках некоторых представителей порядка Actinomycetales
Всего в данной работе обследовано более 100 штаммов различных родов актиномицетов, относящихся к 12-ти семействам 9-ти подпорядкам порядка Actinomycetales. Как видно из табл. 6, организмы ряда высших таксонов (подпорядки и семейства), характеризуются наличием или отсутствием ТК. Последние обнаружены в клеточных стенках у всех изученных актиномицетов подпорядков Glycomycineae и Streptosporangineae и не выявлены у представителей подпорядка Corynebacterineae и Pseudonocardineae. Не содержат ТК в клеточных стенках и большинство изученных штаммов подпорядка Frankineae. В случае вариабельности признака «наличие ТК» внутри высших таксонов, признак характерен для всех организмов более узких филогенетических групп (родов или близких видов в составе рода).
Можно также отметить, что ТК обычно свойственны организмам с хорошо развитым воздушным мицелием и сложными репродуктивными структурами, реже встречаются у нокардиоформных и палочковидных организмов и не выявлены у кокковых форм. Полимеры обнаружены у абсолютного большинства изученных организмов, включая Kineosporia aurantiaca, содержащих LL-диаминопимелиновую кислоту в пептидогликане. Доля ТК в клеточной стенке нокардиои коринеформных организмов (семейство Nocardioidaceae) обычно ниже, чем у спорообразующих (напр., Streptomycetaceae). ТК не обнаружены у анаэробов семейства Propionibacteriacea, а также у организмов с арабиногалактаном или арабиногалактаном и миколовыми кислотами в клеточных стенках (подпорядки Corynebacterineae и Pseudonocardineae), у организмов с муреином Б-типа (семейство Microbacteriaceae), за исключением единичных видов рода Agromyces (Гнилозуб, 1994), и у абсолютного большинства организмов (включая спорангиальные) с лизином и орнитином в составе муреина. Исключение — Rarobacter (Takeuchi and Yokota, 1989), а также ряд филогенетически обособленных видов рода Arthrobacter (семейство Micrococcaceae, Fiedler and Schдffler, 1987), которые, видимо, должны быть выведены из состава рода.
В качестве примера практического использования на ранних этапах работы признака «наличие ТК» можно привести нашу работу (Стрешинская и др., 1989 г.) по уточнению таксономического положения ряда видов рода Nocardiopsis, сходных с Saccharothrix морфологически и по типу клеточной стенки (III C). Было исследовано 9 штаммов видов Nocardiopsis и Saccharothrix и выявлено две группы организмов внутри рода Nocardiopsis. К первой относились четыре штамма видов N. dassonvillei и N. trеhalosi (доминирующий моносахарид клеточной стенки — глюкоза, клеточные стенки содержали ТК глицерофосфатной природы). Вторую группу составили N. atra, N. coeruleofusca, N. longispora и N. syringae (доминирующий моносахарид клеточной стенки — галактоза, ТК отсутствуют). Виды второй группы по указанным критериям и ряду других характеристик оказались близкими к изученным Saccharothrix spp. Было сделано предположение, что их следует вывести из состава рода Nocardiopsis и отнести к Saccharothrix. Впоследствии зарубежными авторами было подтверждено это предположение и представители второй изученной нами группы (N. coeruleofusca, N. longispora и N. syringae) реклассифицированы в род Saccharothrix (Grund and Kroppenstedt, 1990).
7.2 Моносахариды в клеточных стенках изученных актиномицетов
Состав диагностических моносахаридов клеточной стенки, определяемый обычно в препаратах целых клеток, наряду с диаминокислотой пептидогликана, предложенный в качестве хемотаксономического признака, дифференцирующего роды (группы родов) в период становления хемотаксономического направления в систематике актиномицетов (Lechevalier and Lechevalier 1970a, b, c), продолжает успешно использоваться и в настоящее время. Признак несет информацию о специфических для определенных групп организмов компонетах клеточной стенки. Для ряда мицелиальных организмов метод определения сахаров в целых клетках даёт те же результаты, что и в препаратах клеточных стенок, однако последний метод более инфрмативен и позволяет выявлять дополнительные диагностические для таксона моносахариды (например, глюкозу, рибозу, галактозу). Помимо клеточной стенки, такие сахара могут происходить из цитоплазмы, капсул и экзополисахаридов, и традиционно не рассматривались в качестве диагностических. Так, например, принято считать, что для стрептомицетов характерен тип клеточной стенки I — LL-диаминопимелиновая кислота и отсутствие «дифференцирующих» сахаров.
Сравнительный анализ опубликованных и наших данных по «сахарам клеточных стенок» (определяются на первых этапах изучения структуры ТК и других гликополимеров) показал, что моносахариды, не относящиеся к группе «дифференцирующих сахаров», часто входят в состав этих полимеров и в ряде случаев являются важной дополнительной характеристикой таксона. Так, галактоза является ценным химическим маркером группы видов стрептомицетов из кластера «S. violaceusniger», галактоза и манноза (происходящие из галактоманнана) характерны для Kineosporia aurantiaca, наличие галактозы (глюкозы) свойственно ряду видов Nocardiopsis и Saccharothrix (см. выше), и т. д. Изучение состава сахаров препаратов клеточных стенок позволяет также выявить моносахариды, считавшиеся ранее не свойственными представителям того или иного рода (например, мадуроза для ряда видов стрептомицетов).
С другой стороны, обнаружение у штамма нового моносахарида, не найденного в составе клеточных стенок известных (близких) видов, с высокой степенью вероятности свитетельствует о том, что такой штамм относится к новому таксону. Специфичность биосинтеза «нового» сахара и полимера, включающего такой сахар, обусловлена специфичностью соответствующих локусов генома микроорганизма.
При изучении 6-ти новых изолятов рода Kribbella в клеточной стенке 3-х штаммов нами были выявлены редкий сахар 2,3-ди-О-метил-D-галактопираноза и высший сахар — псевдаминовая кислота. Клеточные стенки двух других штаммов содержали 2,4-диацетамидо-2,4-дидезокси-D-глюкозу — впервые обнаруженный сахар (названный крибелозой), который сходен с бацилозамином (Schдffer et al., 2001), отличающемся от вновь найденного наличием О-метильной группы у пятого атома углерода глюкозы. В клеточной стенке еще одного штамма обнаружен редкий диаминосахар — 2,3-диацетамидо-2,3-дидезокси-D-глюкоза. Изученные штаммы содержали также в клеточной стенке то или иное количество галактозы и маннозы. Отличия изученных штаммов от известных видов рода по составу моносахаридов, входящих в полимеры, связанные с пептидогликаном, позволяют предполагать, что они принадлежат как минимум к трем новым видам рода Kribbella. Вопрос о видовой принадлежности этих изолятов будет решен в дальнейшем на основании изучения фенотипических и генотипических характеристик.
Глава VIII. Экологические аспекты изучения анионных углеводсодержащих полимеров клеточных стенок актиномицетов Среди множества обитающих в почве сапрофитных видов стрептомицетов в возрастающем количестве обнаруживаются фитопатогенные организмы, вызывающие экономически значимые заболевания сельскохозяйственных растений, включая паршу картофеля обыкновенную (Takeuchi et al., 1996; Loria et al., 1997; Bouchek-Mechiche et al., 2000; Bukhalid et al., 2002). Основными факторами патогенности известных стрептомицетов-возбудителей парши являются фитотоксин (такстомин), ингибирующий биосинтез целлюлозы, некротический белок и гидролитические ферменты (Loria et al., 1997; Bukhalid et al., 2002). Вместе с тем, сведения о механизме взаимодействия патогена с растением-хозяином, в который, несомненно, вовлечены поверхностные структуры клеточной стенки фитопатогена, крайне фрагментарны. Обнаружение (Shashkov et al., 2000) у фитопатогенного штамма Streptomyces sp. ВKM Ac-2090, наряду с тейхоевой кислотой, полимера Kdn, обладающего адгезивными свойствами по отношению к тканям растения, положило начало исследованиям по выявлению особенностей строения анионных полимеров клеточной стенки у возбудителей парши картофеля в связи с возможным участием этих полимеров в патогенезе.
Нами были исследованы анионные полимеры клеточных стенок у 13 штаммов — изолятов из пораженных паршой клубней картофеля различных сортов, почвы картофельных полей, а также представителей типовых штаммов известных «почвенных» видов, таксономически близких к фитопатогенам (табл.7). Кроме того, были проведены эксперименты по проверке вирулентности, определению такстомина и целлюлозолитической активности у вышеупомянутых и других организмов, у котрых были обнаружены аналогичные по структуре полимеры клеточных стенок (табл.7). С целью идентификации штаммов, были также определены нуклеотидные последовательности фрагмента гена 16S рРНК. На основании полученных данных, было установлено, что рассматриваемые объекты относятся к 3 филогенетическим группам: «Streptomyces scabei», «Streptomyces setonii-griseus» и «S. violaceusniger» (табл. 8).
Таблица 7. Вирулентность, синтез такстомина и наличие Kdn у изученных штаммов фитопатогенных стрептомицетов.
<…
Первая включает штаммы, имеющие практически идентичную последовательность гена 16S рРНК (99,9%) с типовым штаммом S. scabiei ATCC 49173T (типичным возбудителем парши обыкновенной клубней картофеля и корнеплодов; Loria et al., 1997).
Таблица 8. Тейхоевые кислоты и гликополимеры клеточных стенок изученных фитопатогенных стрептомицетов.
Номер п/п. | Название культуры. | Вирулентность. | Kdn. | Таксто-мин. | ||
Карто-фель. | редис. | |||||
*Streptomyces sp. ВКМ Ас-304. | ++. | +++. | ||||
*Streptomyces sp. ВКМ Ас-305. | +++. | |||||
*Streptomyces sp. ВКМ Ас-306. | ++. | +++. | ||||
Streptomyces sp. ВКМ Ас-2274 (МВ-8). | ++. | н.о. | ||||
S. hygroscopicus ssp. hygroscopicus ВКМ Ac-831T. | +++. | н.о. | ; | |||
S. violaceusniger ВКМ Ас-583 T. | ++. | н.о. | ; | |||
S. endus ВКМ Ac-1331T. | +++. | ++. | ; | |||
S. endus ВКМ Ac-129. | +++. | +++. | ; | |||
S. castelarensis ВКМ Ac-832T. | +++. | н.о. | ; | |||
S. melanosporofaciens ВКМ Ас-1864 T. | +++. | н.о. | ; | |||
*S. griseus ssp. cretosus ВКМ Ac-712T. | +++. | ++. | ; | |||
*S. griseus ssp. griseus ВКМ Ac-800T. | н.о. | ++. | ; | |||
*Streptomyces sp. ВКМ Ас-841. | ++. | н.о. | ; | ; | ||
*S. flavogriseus ВКМ Ac-1325T. | н.о. | н.о. | ; | ; | ||
*Streptomyces sp. ВКМ Ac-2117 (ОБИ-7). | +++. | н.о. | ; | |||
*Streptomyces sp. ВКМ Ac-2124 (ОИЗ-4). | +++. | н.о. | ; | |||
*Streptomyces sp. ВKM Ac-2277 (B-15). | н.о. | ; | ||||
*Streptomyces sp. ВКМ Ac-2528. | ++. | н.о. | ; | ; | ||
Под-группа. | Штамм. | Тейхуроновая кислота. | Тейхоевая кислота. | Kdn*. | ||
Группа Streptomyces scabei (99,9% сходства нуклеотидной последовательности гена 16S рРНК со S. scabei ATCC 49173T). | ||||||
Streptomyces sp. ВКМ Ac-305. | нет. | TК1: 2,3- поли (глицерофосфат); TК2: 1,3- поли (глицерофосфат); TК3: 1,3- поли (глицерофосфат) сD-GlcNАс. | Kdn-полимер сD-Galp и. — D-Galp3OMe. | |||
Streptomyces sp. ВКМ Ac-304. | нет. | то же, а также ПС¦ | Kdn-полимер сD-Galp и. — D-Galp3OMe. | |||
Streptomyces sp. ВКМ Ac-306. | нет. | то же, а также ПС¦ | Kdn-полимер сD-Galp и. — D-Galp3OMe. | |||
Streptomyces sp. ВКМ Ac-2274. | нет. | TК2: 1,3- поли (глицерофосфат); TК3: 1,3- поли (глицерофосфат) сD-GlcNАс. | Олигомер Kdn сD-Galp и. — D-Galp3OMe. | |||
Группа Streptomyces setonii-griseus (99,2−99,7% сходства нуклеотидной последовательности гена 16S рРНК со S. setonii ATCC 25497T). | ||||||
Streptomyces sp. ВKM Ac-2124 1). S. flavogriseus ВKM Ac-1325 T. | 4)—D-Manp2,3NAcA-(16)—D-Glcp-(1. то же. | 1,5-поли (рибитфосфат) сGlcp. то же. | Полимер Kdn сGlcp. нет. | |||
Sreptomyces sp. ВKM Ac-2528. |
| то же. | нет. | |||
Streptomyces sp. ВKM Ас-2117 2). «S. flavovirens» MB-7. S. griseus ssp. griseus ВKM Ac-800T. | 4)—D-Manp2,3NAcA-(13) — -D-GalpNAc-(1. то же то же. | 1,5-поли (рибитфосфат) сGlcp. так же так же. | Полимер Kdn сGlcp — сл Полимер Kdn сGlcp. Полимер Kdn сGlcp — сл. | |||
Streptomyces sp. MБ-2. Streptomyces sp. MБ-5. Streptomyces sp. MБ-6. Streptomyces sp. ВКМ Ас-841. Streptomyces sp. ВКМ Ас-2277. | 4)—D-Manp2,3NAcA-(13)—D-GalpNAc-(1. то же то же то же то же. | 1,5-поли (рибитфосфат) сGlcp. и 1,5-поли (рибитфосфат) с Pyr. то же то же то же то же. | Полимер Kdn сGlcp. нет Полимер Kdn сGlcp. нет Полимер Kdn сGlcp — сл. | |||
Streptomyces sp. ВКМ Ас-2534. | 4)—D-Manp2,3NAcyA-(13)—D-GalpNAc-(1, где Acy — ацетил или L-Glu. | 1,5-поли (рибитфосфат) сGlcp. и/илиD-GlcpNAc. | нет. | |||
Sreptomyces griseus ssp. cretosus ВКМ Ас-712. Streptomyces sp. МБ-10. | нет нет. | 1,5-поли (рибитфосфат) сGlcp. то же. | Полимер Kdn сGlcp. то же. | |||
Группа «S. violaceusniger"(Williams et al., 1983, до 99,7% сходства нуклеотидной последовательности гена 16S рРНК с S. violaceusniger). | ||||||
S. hygroscopicus ssp. hygroscopicus ВКМ Ac-831T. | нет. | TК1: 2,3- поли (глицерофосфат); TК2: 1,3- поли (глицерофосфат); TК3: 1,3- поли (глицерофосфат) сD-GlcpNАс. | Kdn-полимер сD-Galp. | |||
S.violaceusniger ВКМ Ас-583 T. | нет. | то же. | то же. | |||
S. endus ВКМ Ac-1331T. | нет. | то же. | то же. | |||
S. endus ВКМ Ac-129. | нет. | то же. | то же. | |||
S. castelarensis ВКМ Ac-832T. | нет. | то же. | то же. | |||
S. melanosporofaciens ВКМ Ас-1864 T. | нет. | то же. | то же. | |||
¦ ПС: полисахарид ?6)-?-d-GalpNAc-(1>3)-?-d-GalpNAc-(1?, (Козлова и др., 2006); 1) Shashkov et al., 2002b; 2) Шашков и др., 2001 *Kdn, 3-дезокси-d-глицеро-d-галакто-нон-2-улопиранозоновая кислота При этом штамм Ас-305 характеризовался наличием трех ТК: основная — 1,3-поли (глицерофосфат) с б-N-ацетилглюкозамином и минорные — незамещенные 1,3- и 2,3-поли (глицерофосфаты). Два других штамма Ас-304 и Ас-306 имели такой же набор ТК плюс полисахарид. Во всех трех штаммах обнаружен полимер Kdn сгалактозой и -3-О-метилгалактозой (мадурозой), табл. 8. Штамм Ас-2274 содержал лишь две ТК, а Kdn был в виде олигомера, в отличие от вышеупомянутых штаммов. На основании отличий в наборе и структурах ТК и гликополимеров клеточных стенок, среди представителей данной группы можно выделить подгруппы, соответствующие трем хемотипам клеточной стенки (табл. 8). Интересно отметить, что только в эту группу вошли штаммы, синтезирующие такстомин (табл. 7).
Вторую геногруппу составили штаммы, филогенетически (16S рРНК) близкие к типовому штамму S. setonii ATCC 25 497 Т, вызывающему паршу обыкновенную картофеля (Takeuchi et al., 1996). Интересно отметить, что S. setonii и S. griseus ssp. griseus имеют 99,7% сходства генов 16S рРНК (Takeuchi et al., 1996; Liui et al., 2005). Для всех членов этой группы характерно наличие в клеточных стенках 1,5-поли (рибитфосфата) в той или иной степени замещенногоглюкозой (табл. 8). У пяти штаммов был дополнительно обнаружен 1,5-поли (рибитфосфат), замещенный по гидроксилам при С2,4 рибита остатком пировиноградной кислоты. Почти все штаммы содержали поли-Kdn сглюкозой, а также тейхуроновые кислоты, различные по структурам (обнаружены впервые). Исключение составили штаммы «griseus», в которых тейхуроновые кислоты отсутствовали вовсе. Наконец, штамм Ас-2534 имел более сложные по структуре тейхоевую и тейхуроновую кислоты. Таким образом, по набору и структуре ТК и гликополимеров клеточных стенок исследованные представители группы «Streptomyces setonii-griseus» разделились на 6 хемотипов.
Третья группа (табл. 8) представлена штаммами, входящими в филогенетический кластер «S. violaceusniger». Виды этой группы (S. violaceusniger, S. hygroscopicus ssp. hygroscopicus, S. endus, S. castelarensis и S. melanosporofaciens) известны как типичные сапрофитные обитатели почвы, не входящие в список известных фитопатогенов (Young et al., 1995; 2004). Обнаружение в их клеточных стенках кислого полимера Kdn, замещенногогалактозой и состоящего примерно из 20 повторяющихся единиц, побудило проверить патогенные свойства этих организмов. Было обнаружено, что все взятые в эксперимент штаммы поражают клубни картофеля и ингибируют развитие проростков редиса (табл. 7). Такстомин не был найден, но выялены экстрацеллюлярные целлюлозолитическая и ксиланолитическая активности (Барышникова и др., неопубликованные данные), которые, по-видимому, могут быть причиной поражения клубней при контакте микроорганизмов с клетками растения в условиях модельного опыта.
Таким образом, изученные организмы содержат в клеточных стенках набор анионных углеводсодержащих полимеров: тейхоевых и тейхуроновых кислот, в том числе с пировиноградной или глутаминовой кислотой, усиливающими анионные свойства этих полимеров, а также полимеров/олигомеров Kdn. Подобные кислые структуры, несомненно, участвуют в инфекционном процессе, обусловливая адсорбцию фитопатогена к клетке растения-хозяина. Отличия по структурам ТК и гликополимеров клеточных стенок изученных фитопатогенных штаммов от близких референтных культур, наряду с данными о видоспецифичности таких полимеров для ряда других родов актиномицетов, однозначно указывают на то, что изученные организмы представляют собой несколько видов.
Заключение
Проведенные исследования выявили широкое разнообразие структур тейхоевых кислот и других гликополимеров у представителей порядка Actinomycetales и обнаружили большое число не известных ранее природных полимеров, в том числе уникальных (табл. 9). Наряду с общим планом строения, изученные тейхоевые кислоты проявляют различия в тонкой структуре, обусловленные типом полиола, локализацией фосфодиэфирных связей, природой заместителей, присоединенных гликозидными связями разной конфигурации к полиольным остаткам и т. д. В числе обнаруженных новых структур уникальный тип тейхоевой кислоты, найденный пока только у Nocardiopsis dassonvillei и близких видов, новый подтип с 3,5-локализацией фосфодиэфирной связи в рибитфосфатном полимере, 1,5-поли (рибитфосфат) с пируват-кетальными группами, тейхоевая кислота сфуранозным олигомером на терминальном конце цепи, тейхоевая кислота с частично ацетилированным аминокислотным заместителем. (что обусловливает новые свойства этого полианионного соединения) и т. д.
Открыто два новых кислых гликополимера c 3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновой кислотой (Kdn) в качестве повторяющегося звена: полисахарид (-Kdn)/олигосахарид [-Kdn-(24)—Kdn], несущие либогалактозильные, либо и — галактозильные и -3-О-метилгалактозильные заместители. Гликоконъюгаты с Kdn широко распространены в тканях животных; моно-, дии тримеры Kdn известны в составе О-полисахаридов у грамотрицательных бактерий, тогда как полимеры Kdn обнаружены в природе впервые. Впервые (в клеточных стенках фитопатогенных стрептомицетов) найдена тейхуроновая кислота с димером, состоящим из диаминоманнуроновой кислоты и галактозамина, связанными (13) гликозидной связью, первая ацилирована N-связанной глютаминовой кислотой. Впервые выявлен нейтральный полисахарид — галактоманнан. Открыт новый сахар (крибелоза) у бактерий рода Kribbella. Обнаруженные и описанные новые химические структуры расширяют представления о многообразии органического мира и биосинтетическом потенциале микроорганизмов, и представляют интерес для будущих исследований в области молекуляпной и клеточной биологии, экологии, эволюции микроорганизмов. Полученные результаты будут, несомненно, востребованы при аннотации полных геномов микроорганизмов.
Значительно пополнена база данных спектров ЯМР тейхоевых кислот и гликополимеров бактериальных клеточных стенок. Показана возможность использования ЯМР-спектров тейхоевых кислот как своеобразных фингерпринтов организмов для идентификации новых изолятов исследованных родов.
Использование строения тейхоевых кислот и гликополимеров клеточных стенок и их структурных элементов в качестве химических маркеров таксонов принадлежит к числу новых направлений в таксономии актинобактерий. На большом экспериментальном материале продемонстрирована возможность и перспективность использования тейхоевых кислот и других гликополимеров для решения задач классификации и идентификации актинобактерий на всех таксономических уровнях (от подпорядка до вида). Обнаружение корреляции между структурами тейхоевых кислот и гликополимеров клеточных стенок представителей ряда родов, в том числе Streptomyces, с одной стороны, и генотипическими и фенотипическими характеристиками организмов, с другой, открывает новые возможности при решении задач по уточнению границ видов и ревизии таксономической структуры родов актиномицетов. Выявленные различия в структурах тейхоевых кислот способствовали установлению видовой принадлежности ряда изолятов и позволили дополнить описание ранее предложенных видов рода Nocardioides (N. luteus и N. albus), а также описать новый вид рода (Nocardioides prauseri sp. nov). Отличия в структурах полимеров фитопатоненных штаммов рода Streptomyces позполяют прогнозировать открытие не менее 15-ти новых фитопатогенных видов.
Таблица 9. Новые структуры тейхоевых кислот и гликополимеров исследованных актиномицетов.
№ п/п. | Тип и подтип ТК. | Полиол. | Структура. | Организм. | Ссылка. | |
I-Г 1,3. | Глицерин. | 1,3-поли (глицерофосфат) с б-Glc. | G. rutgersensis; G. harbinensis. | Тульская и др., 1993. | ||
I-Г 1,3. | Глицерин. | 1,3-поли (глицерофосфат) с б-GlcN/ б-GlcNAc. | S. castelarensis, S. hygroscopicus,. S. violaceusniger, S. endus; Kineosporia aurantiaca. | Tul’skaya et al., 1991; 2005; Тульская и др., 1997; 2007а. | ||
I-Г 1,3. | Глицерин. | 1,3-поли (глицерофосфат)с тетрасахаридом. | S. sparsogenes. | Шашков и др., 1998. | ||
I-Г 2,3. | Глицерин. | 2,3-поли (глицерофосфат). | S. castelarensis, S. hygroscopicus,. S. violaceusniger, S. endus. | Тульская и др., 1997; 2007а. | ||
I-Р 1.5. | Рибит. | 1,5-поли (рибитфосфат) с кетально связанной Pyr. | N. alba; N. metallica; Streptomyces sp. МБ-2, 5, 6. | Tul’skaya et al., 1995; 2007; Тульская и др.,-не опубл. | ||
I-Р 1,5. | Рибит. | 1,5-поли (рибитфосфат). c б-Gal и кетально связанной. Pyr; -Galf. | Nocardioides luteus, Nocardioides prauseri. | Шашков и др., 2000; Tul’skaya et al., 2003. | ||
I-Р 3,5. | Рибит. | 3,5-поли (рибитфосфат). | Nocardiopsis alba, N. prasina. | Tul’skaya et al., 1995; Тульская и др., 2000. | ||
II-ГС 3,3. | Глицерин. | Поли (галактозилглицерофосфат) сGlc и кетально связанной Pyr; — Gal. | Nocardioides albus. | Шашков и др., 1999; Tul’skaya et al., 2003. | ||
IV-ГС 3,3. | Глицерин. | Поли (глицерофосфат-галактозилглицерофосфат). | N. dassonvillei. | Tul’skaya et al., 1993. | ||
IV-ГС 3,4. | Глицерин. | то же. | N. synnemataformans, N.halotolerans. | Tul’skaya et al., 2007. | ||
IV-ГС 3,3. | Глицерин. | то же c кетально связанной Pyr. | N. halotolerans. | Tul’skaya et al., 2007. | ||
Повторяющееся звено:4)—D-Manp2,3NAcyA-(13)—D-GalpNAc-(1, где Acy — ацетил или L-Glu тейхуроновая кислота. | Streptomyces sp. ВКМ Ас-2534. | Тульская и др., 2007 б. | ||||
Повторяющееся звено: >3)-в-d-Galp-(1>6)-в-d-Manp-(1>4)-в-d-Manp-(1>3)-в-d-Galp-(1>4)-в-d-Manp-(1>4)-в-d-Manp-(1> нейтр. полисахарид. | Kineosporia aurantiaca. | Tul’skaya et al., 2005. | ||||
Олигомер: биKdn, замещенныйGal или/и — Galp3OMe. | Streptomyces sp. ВКМ Ac-2274. | Shashkov et al., 2002. | ||||
Полимер: -Kdn, замещенныйGal. № 14 и 15 — кислые полисахариды. | S. castelarensis, S. hygroscopicus,. S. violaceusniger, S. endus; S. melanosporofaciens. | Tul’skaya et al., 2007а. | ||||
Сравнительный анализ опубликованных и наших данных по «сахарам клеточных стенок» показал, что определение сахаров в препаратах клеточных стенок позволяет выявлять дополнительные диагностические для таксона моносахариды, не учитываемые при стандартном определении признака «тип клеточной стенки», производимом в целых клетах. Обнаружение характерных моносахаридов в составе клеточных стенок в некоторых случаях может достаточно точно указывать на принадлежность к определенному роду (например, в-галактофураноза для рода Nocardioides; 2,3-дидезокси-2,3-диметилгалактоза и крибелоза для рода Kribbella).
Важным результатом исследования клеточных стенок стрептомицетов, вызывающих паршу обыкновенную картофеля было обнаружение в их составе набора высокоанионных тейхоевых и тейхуроновых кислот с пировиноградной или глутаминовой кислотой в качестве ацилирующих заместителей и полимеров/олигомеров Kdn. Предполагается, что подобные кислые структуры, локализованные на поверхности клетки фитопатогенного микроорганизма, играют важную роль в инфекционном процессе, обусловливая адсорбцию фитопатогена к клетке растения-хозяина. Дальнейшие исследования, наряду с изучением факторов патогенности и устойчивости, будут способствовать пониманию молекулярных механизмов взаимодействия фитопатогенных стрептомицетов и растения и разработке эффективных средств защиты растений. Обнаружение полимера Kdn в клеточной стенке известных «почвенных» видов из филогенетического кластера «Streptomyces violaceusniger», традиционно считавшихся сапрофитами, позволило выявить неизвестные ранее функции этих видов в системе «почва-растение».
Выводы
- 1. Исследованы тейхоевые кислоты и гликополимеры клеточных стенок более 100 штаммов — представителей различных родов актиномицетов, относящихся к 12-ти семействам 9-ти подпорядкам порядка Actinomycetales. Названные выше полимеры, среди которых доминируют глицеринтейхоевые кислоты разных типов, обнаружены у 80% изученных актиномицетов.
- 2. Выявлено широкое разнообразие структур тейхоевых кислот и других гликополимеров у представителей порядка Actinomycetales. Расшифрованы структуры полимеров у 63 штаммов. Впервые установлены структуры 15 новых полимеров:
- ? 11 тейхоевых кислот, среди которых: уникальные поли (полиолфосфат-гликозилполиолфосфаты), незамещенный 3,5-поли (рибитфосфат), 1,5-поли (рибитфосфат) с пируват-кетальными заместителями, 1,3-поли (глицерофосфат) с ацетилированным и неацетилированным аминосахаром на одной цепи, тейхоевая кислота сфуранозным олигомером на терминальном конце цепи и ряд других;
- ? тейхуроновая кислота с дисахаридом в повторяющемся звене и N-глютаминовой кислотой в качестве заместителя;
- ? нейтральный полисахарид — галактоманнан;
- ? два кислых полисахарида: олигомер и полимер 3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновой кислоты (Kdn), несущие либогалактозильные, либо игалактозильные, и -3-О-метилгалактозильные заместители.
- 3. Получены приоритетные данные о корреляции состава и строения тейхоевых кислот и других гликополимеров клеточных стенок у представителей более 25 видов Nocardiopsis, Nocardioides, Glycomyces и Streptomyces с группировкой организмов по генотипическими признакам. Показана эффективность использования строения вышеназванных полимеров и их структурных компонентов для решения таксономических задач, в т. ч., ревизии системы структуры рода Streptomyces.
- 4. Структура тейхоевых кислот может служить основанием для описания новых видов и определения видовой принадлежности выделенных из природных источников изолятов. С учетом отличий по структурам тейхоевых кислот и результатов ДНК-ДНК гибридизации описан новый вид Nocardioides prauseri sp. nov. и предложено уточнение диагноза видов Nocardioides luteus и Nocardioides albus.
- 5. Анализ результатов собственных исследований и данных других авторов о распространении тейхоевых кислот и гликополимеров у организмов порядка Actinomycetales выявил корреляцию признака «наличие/отсутствие тейхоевых кислот» с таксономическим положением актиномицетов. Признак характеризует высшие таксоны (подпорядки и семейства), при вариабельности — дифференцирует роды внутри семейств или группы близких видов внутри родов.
- 6. Впервые определен моносахаридный состав в препаратах клеточных стенок у большого массива актиномицетов ранее не исследованных в этом плане. Выявлены дополнительные диагностические моносахариды для ряда таксонов. Обнаружение редких или новых (крибеллеза) природных сахаров, входящих в связанные с пептидогликаном гликополимеры, может указывать на принадлежность организмов к определённому роду и позволяет прогнозировать открытие новых видов в исследованных группах.
- 7. Тейхоевые кислоты и гликополимеры служат выявлению новых свойств изучаемых актиномицетов: обнаружена новая группа фитопатогенных стрептомицетов, филогенетически и фенотипически отличных от известных возбудителей парши обыкновенной картофеля — это представители «почвенных» видов из филогенетического кластера «Streptomyces violaceusniger», традиционно считавшихся сапрофитами. Характерной особенностью клеточных стенок изученных фитопатогенных стрептомицетов является наличие нескольких анионных полимеров: тейхоевых и тейхуроновых кислот и полимеров/олигомеров Kdn.
Публикации по теме диссертации
Обзоры.
1. Naumova I.B., Shashkov A.S., Tul’skaya E.M., Streshinskaya G.M., Kozlova Yu.I., Potekhina N.V., Evtushenko L.I., Stackebrandt E. Cell wall teichoic acids structural diversity, specificity in the genus Nocardiopsis, and chemotaxonomic perspective. // FEMS Microbiol. Rev. 2001. V. 25. № 3. p. 269−283.
Экспериментальные статьи.
- 2. Тульская Е. М., Вылегжанина Е. С. Стрешинская Г. М. Шашков А. С. Наумова И.Б. Гетерогенность цепей глицеринтейхоевой кислоты клеточной стенки Streptomyces rutgersensis var. castela-rense ВКМ Ас-238. // Биохимия. 1989а. Т. 54. № 4. стр. 531−536
- 3. Стрешинская Г. М., Тульская Е. М., Терехова Л. П., Галатенко О. А., Наумова И. Б., Преображенская Т. П. Некоторые хемотаксо-номические критерии рода Nocardiopsis. // Доклады Академии Наук СССР. 1989а. Т. 309. № 2. стр. 477−480.
- 4. Шашков А. С., Тульская Е. М., Стрешинская Г. М. Наумова И.Б. Терехова Л. П. Галатенко О.А. ЯМР спектроскопическое исследование тейхоевой кислоты клеточной стенки Nocardiopsis dassonvillei IMRU 509. // Биоорганическая химия. 1990. Т. 16. № 7. стр. 993−996.
- 5. Tul’skaya E.M., Vylegzhanina E.S., Streshinskaya G.M., Shashkov A.S., Naumova I.B. Heterogeneity of glycerol teichoic acids in the cell wall of Streptomyces rutgersensis var. castelarense VKM Ac-238. // Biochim. Biophys. Acta. 1991. V. 1074. p. 237−242.
- 6. Тульская Е. М., Стрешинская Г. М., Наумова И. Б., Терехова Л. П., Галатенко О. А. Некоторые хемотаксономические критерии видов Nocardiopsis dassonvillei и Nocardiopsis antarcticus. // Микробиология. 1992. Т. 61. № 5. стр. 908−915.
- 7. Tul’skaya E.M., Streshinskaya G.M., Shashkov A.S., Terekhova L.P., Galatenko O.A., Naumova I.B. A new structural type of teichoic acid and some chemotaxonomic criteria of two species Nocardiopsis dassonvillei and Nocardiopsis antarcticus. // Arch. Microbiol. 1993. V. 160. № 4. p. 299−305.
- 8. Тульская Е. М., Потехина Н. В., Наумова И. Б., Шашков А. С., Евтушенко Л. И. Сравнительное изучение тейхоевых кислот клеточных стенок актиномицетов Glycomyces rutgersensis и Glycomyces harbinensis. // Микробиология. 1993. Т. 62, № 5, стр. 932−937.
- 9. Potekhina N.V., Tul’skaya E.M., Naumova I.B., Shashkov A.S., Evtushenko L.I. Erythritol teichoic acid in the cell wall of Glycomyces tennuis VKM Ac-1250. // Eur. J. Biochem. 1993. V. 218. p. 371−375.
- 10. Тульская Е. М., Шашков А. С., Евтушенко Л. И., Таран В. В., Наумова И. Б. Тейхоевые кислоты клеточной стенки Nocardiopsis albus ssp. albus DSM 43 120. // Биохимия. 1995а. Т. 60. № 3. стр. 179−186.
- 11. Tul’skaya E.M., Shashkov A.S., Evtushenko L.I., Taran V.V., Naumova I.B. Novel cell wall teichoic acid from Nocardiopsis albus ssp. albus as a species-specific marker. // Microbiology UK. 1995. V. 141. № 8. p. 1851−1856.
- 12. Кулаев И. С., Наумова И. Б., Стрешинская Г., Тульская Е. М., Степная О. А., Северин А. И., Бегунова Е. А. Литическое действие лизоамидазы из Xantomonas sp. коррелирует с присутствием в клеточной стенке бактерий-мишеней рибиттейхоевых кислот. // Микробиология. 1996. Т. 65. № 3. стр. 326−332.
- 13. Тульская Е. М., Шашков А. С., Евтушенко Л. И., Буева О. В., Наумова И. Б. Идентичность структур тейхоевых кислот актиномицетов вида Streptomyces hygroscopicus. // Биохимия.1997. Т. 62. № 3. стр. 338−343.
- 14. Стрешинская Г. М., Тульская Е. М., Шашков А. С., Евтушенко Л. И., Таран В. В., Наумова И. Б. Тейхоевые кислоты клеточны стенок Nocardiopsis listeri, Nocardiopsis lucentensis и Nocardiopsis tregalosei. // Биохимия. 1998. Т. 63. № 2. стр. 86−90.
- 15. Потехина Н. В., Тульская Е. М., Шашков А. С., Таран В. В., Евтушенко Л. И., Наумова И. Б. Таксономическая специфичность тейхоевых кислот клеточных стенок актиномицетов рода Glycomyces. // Микробиология. 1998. Т. 67. № 3. стр. 399−403.
- 16. Шашков А. С., Тульская Е. М., Грачев А. А., Евтушенко Л. И., Буева О. В., Наумова И. Б. Структура тейхоевой кислоты клеточной стенки Streptomyces sparsogenes ВКМ Ас-1744Т. // Биохимия. 1998. Т. 63. № 9. стр. 1288−1294.
- 17. Шашков А. С., Тульская Е. М., Евтушенко Л. И., Наумова И. Б. Тейхоевая кислота клеточной стенки Nocardioides albus ВКМ Ас-805Т. // Биохимия. 1999. Т. 64. № 11, стр. 1544−1549.
- 18. Тульская Е. М., Шашков А. С., Евтушенко Л. И., Наумова И. Б. Тейхоевые кислоты клеточной стенки Nocardiopsis prasina ВКМ Ас-1880Т. // Микробиология. 2000. Т. 69. № 1, стр. 58−61.
- 19. Шашков А. С., Тульская Е. М., Евтушенко Л. И., Грачев А. А., Наумова И. Б. Структура тейхоевой кислоты клеточной стенки Nocardioides luteus ВКМ 1246 Т. // Биохимия. 2000. Т. 65. № 4. стр. 505−510.
- 20. Shashkov A.S., Tul’skaya E.M., Evtushenko L.I., Denisenko V.A., Ivanyuk V.G., Stomakhin A.A., Naumova I.B., Stackebrandt E. Cell wall anionic polymers of Streptomyces sp. MB-8, the causative agent of potato scab. // Carbohydr. Res. 2002. V. 337. № 21−23. p.2255−2261.
- 21. Тульская Е. М., Шашков А. С., Евтушенко Л. И., Стомахин А. А., Иванюк В. Г., Денисенко В. А., Наумова И. Б. Анионные полимеры клеточных стенок некоторых стрептомицетов, вызывающих паршу обыкновенную у картофеля. // Материалы Международной научно-практической конференции, посвященной 75-летию Института картофелеводства Национальной академии наук Беларуси. 2003. Часть II. стр. 200−210.
- 22. Степная О. А., Бегунова Е. А., Цфасман И. Е., Тульская Е. М., Стрешинская Г. М., Наумова И. Б., Кулаев И. С. Роль анионных полимеров клеточных стенок грамположительных бактерий-мишеней в механизме действия на них внеклеточных бактериолитических ферментов Lysobacter sp. // Микробиология. 2004. Т. 73. № 4. стр. 479−485.
- 23. Tul’skaya E.M., Senchenkova S.N., Evtushenko L.I., Shashkov A.S., Naumova I.B. A new neutral polymer from the cell wall of actinomycete Kineosporia aurantiaca VKM Ас_702Т. // Carb. Res. 2005. V. 340. № 6. p. 1247−1251.
- 24. Тульская Е. М., Шашков А. С., Буева О. В., Евтушенко Л. И., Анионные углеводсодержащие полимеры клеточных стенок Streptomyces melanosporofaciens и близких видов. // Микробиология. 2007a. Т. 72. № 1. стр. 39−45.
- 25. Тульская Е. М., Шашков А. С., Сенченкова С. Н., Акимов В. Н., Буева О. В., Ступарь О. С., Евтушенко Л. И. Анионные полимеры клеточной стенки Streptomyces sp, ВКМ Ас-2534. // Биоорганическая химия. 2007б. Т. 33. № 2. стр. 269−276.
Тезисы докладов и стендовых сообщений.
- 26. Тульская Е. М., Вылегжанина Е. С., Стрешинская Г. М., Шашков А. С., Наумова И. Б. Тейхоевая кислота Streptomyces rutgersensis var. castelarense. // Всесоюзная конференция «Регуляция микробного метаболизма», Пущино, июнь, 1989б. стр. 21.
- 27. Стрешинская Г. М., Тульская Е. М., Наумова И. Б., Терехова Л. П., Галатенко О. А., Преображенская Т. П. Некоторые аспекты хемотаксономии рода Nocardiopsis. // Всесоюзная конференция «Регуляция микробного метаболизма», Пущино, июнь, 1989б. стр. 19−20.
- 28. Terekhova L.P. Galatenko O.A. Rudenskaya Yu.A. Naumova I.B. Streshinskaya G.M., Tul’skaya E.M. Proposal of reclassificftion of «Actinimadura citrea» and «Streptomyces glaucoflavus» as «Actinomadura luteofluorescens». // Abstr. of: Intern. Symp. on Biology of Actinomycetes, Univ. of Wisconsin, Madison, USA, August, 11−16, 1991. P3−007.
- 29. Tul’skaya E.M., Naumova I.B., Shashkov A.S., Evtushenko L.I. Teichoic acid is a species-specific trait for Nocfrdiopsis albus ssp. albus. // Abstr. of: Intern. Symp. on Biology of Actinomycetes. Moscow, Russia, July, 10−15, 1994. p. 249.
- 30. Galatenko O.A., Terekchova L.P., Tul’skaya E.M., Streshinskaya G.M., Naumova I.B. A new actinomycete species Amycolatopsis atropurpureus sp.nov. // Abstr. of: Intern. Symp. on Biology of Actinomycetes. Moscow, Russia, July, 10−15, 1994. p. 252.
- 31. Тульская Е. М., Шашков А. С., Евтушенко Л. И., Таран В. В., Наумова И. Б. Новые тейхоевые кислоты некоторых видов рода Nocardiopsis. // Тезисы докл. Всеросс. Конференции «Биосинтез и деградация микробных полимеров. Фундаментальные и прикладные аспекты». Пущино. 13−17 июня, 1995б. cтр. 53.
- 32. Tul’skaya E.M., Shashkov A.S., Evtushenko L.I., Bueva O.V., Taran V.V., Naumova I.B. Composition of the cell wall teichoic acids as a taxonomic marker of the Streptomyces hygroscopicus species. // Abstr. of: Intern. Conference «Microbial diversity: current situation, conservation strategy and ecological aspects». Perm, Russia, 8−11 of October, 1996. p. 241−242.
- 33. Наумова И. Б., Шашков А. С., Стрешинская Г. M., Тульская Е. М., Потехина Н. В., Козлова Ю. И., Евтушенко Л. И. Новые типы структур тейоевых кислот актиномицетов. Хемотаксономические перспективы. // Тез. докл.: Второй съезд Биохимического общества Российской АН. Москва, 19−23 мая, 1997. стр.340
- 34. Степная О. А., Бегунова Е. А., Цфасман И. М., Ледова Л. Д., Рязанова Л. П., Стрешинская Г. М., Тульская Е. М., Наумова И. Б., Кулаев И. С. Механизм действия бактериолитических ферментов лизоамидазы на грамположительные и грамотрицательные клетки-мишени. // Тез. докл.: Второй с’езд Биохимического общества Российской АН. Москва, 19−23 мая, 1997. стр. 236.
- 35. Naumova I.B., Shashkov A.S., Tul’skaya E.M., Streshinskaya G.M., Kozlova Yu.I., Potekhina N.V., Evtushenko L.I., Widmalm G., Stackebrandt E. Cell wall teichoic acids are chemical markers of some actinomycete taxa. // Abstr. of: INTAS Symposium «Microbial and cellular systema for pharmacology, biotechnology, medicine and environment». Moscow: Dialog-MSU, 1999. p. 34−36.
- 36. Tul’skaya E.M., Shashkov A.S., Gavrish E.Yu., Krausova V.I., Evtushenko L.I., Naumova I.B. Two Nocardioides species with fragmentimg hyphae differ in cell wall teichoic acids. // Abstr. of: Int. Symposium «Modern Problems of Microbial Biochemistry and Biotechnology». Pushchino, June, 25−30, 2000. p. 83
- 37. Tul’skaya E.M., Shashkov A.S., Naumova I.B., Stomakhin A.A., Structural investigation on cell wall anionic polymers of Streptomyces sp. MB-8 the causative agent of potato scab. // Abstr. of: The 2nd German-Polish-Russian Meeting on Bacterial Carbohydrates. Moscow, September 10−12, 2002. p. 22.
- 38. Тульская Е. М., Шашков А. С., Евтушенко Л. И., Иванюк В. Г., Денисенко В. А., Наумова И. Б. Новые анионные олигомеры в клеточной стенке стрептомицета, вызывающего паршу обыкновенную у картофеля. // Тез. докл. «Первая Всероссийская конференция по иммунитету растений к болезням и вредителям». Санкт-Петербург, 2002. стр. 53−54.
- 39. Tul’skaya E. M., Krausova V. I., Gavrish E. Yu., Shashkov A S., Evtushenko L. I., Naumova I. B. Cell wall teichoic acid composition is a chemical marker of the mycelium-forming Nocardioides species and the proposal of Nocardioides prauserii sp. nov. // Abstr. of: The 1st FEMS Congress of European Microbiologists. Ljubljana, Slovenia, June 29 — July 3, 2003. p. 357.
- 40. Naumova I.B., Shashkov A.S., Kozlova Yu.I., Potekhina N.V., Streshinskaya G.M., Tul’skaya E. M., Evtushenko L.I. Novel structures of actinomycetes cell wall polymers. // Abstr. of: II Moscow Internacional Congress Biotechnology; state of the art and prospects of development. Moscow, Russia, 10 — 14 of November, Part 1. 2003. p. 357
- 41. Тульская Е. М., Стрешинская Г. М., Шашков А. С., Евтушенко Л. И., Иванюк В. Г., Наумова И. Б. Анионные полимеры клеточных стенок фитопатогенных стрептомицетов, выделенных из разных источников и вызывающих паршу обыкновенную у картофеля. // Тез. докл. III Всероссийской школы-конференции «Химия и биохимия углеводов». Саратов, 9−11 сентября, 2004. стр. 59.
- 42. Потехина Н. В., Козлова Ю. И., Стрешинская Г. М., Тульская Е. М., Шашков А. С., Евтушенко Л. И. Новые структуры анионных полимеров клеточных стенок актиномицетов. // Тез. докл. Всерос. Симп. «Биотехнология микробов», посвященного 120-летию со дня рождения академика В. Н. Шапошникова. Москва, Россия, МАКС Пресс, 20−23 октября, 2004. стр. 74.
- 43. Стрешинская Г. М., Потехина Н. В., Тульская Е. М., Козлова Ю. И., Шашков А. С., Евтушенко Л. И. Глутаминовая кислота — новый структурный элемент анионных полимеров клеточных стенок некоторых актиномицетов. // Материалы Всероссийского симпозиума с международным участием «Автотрофные микроорганизмы» Памяти академика РАН Е. Н. Кондратьевой, Москва. 21−24 декабря 2005. стр. 99.
- 44. Tul’skaya E.M., Streshinskaya G.M., Kozlova Yu.I., Shashkov A.S., and Evtushenko L. I Species and strain specific features of cell wall teichoic acids in Nocardiopsis. //Abstr.book of: The 11th Int. Congr. Cuture Coll. (ICCC 11). Cцslar, Germany, November, 10−15, 2007. p. 272.
- 45. Тульская Е. М., Стрешинская Г. М., Потехина Н. В., Козлова Ю. И., Шашков А. С., Евтушенко Л. И. Анионные углеводсодержащие полимеры клеточных стенок в таксономии актиномицетов. // Тез. докл: IV Съезд Российского общества биохимиков и молекулярных биологов. Новосибиск, 11−15 мая, 2008. стр. 493.
Благодарности
Автор выражает глубокую признательность всем российским и зарубежным коллегам — соавторам публикаций, принимавшим участие в представленной работе на различных этапах ее выполнения: д.б.н. Н. В. Потехиной (Биологический факультет, МГУ); к.б.н. Ю. И. Козловой (Биологический факультет, МГУ); д.х.н. А. С. Шашкову (Институт органической химии им. Н. Д. Зелинского РАН); к.х.н. С. Н. Сенченковой (Институт органической химии им. Н. Д. Зелинского РАН); д.б.н. Л. П. Тереховой (Институт Новых Антибиотиков им. Г. Ф. Гаузе РАМН); к.б.н. В. Н. Акимову (ИБФМ им. Г. К. Скрябина РАН); к.б.н. Е. Ю. Гавриш (ИБФМ им. Г. К. Скрябина РАН); к.б.н. В. И. Краузовой (ИБФМ им. Г. К. Скрябина РАН); м.н.с. В. В. Таран (ИБФМ им. Г. К. Скрябина РАН); к.б.н. О. А. Степной (ИБФМ им. Г. К. Скрябина РАН), чл.-корр. РАН И. С. Кулаеву (ИБФМ им. Г. К. Скрябина РАН), к.х.н. А. А. Стомахину (Институт молекулярной биологии им. В. А. Энгельгардта РАН), чл.-корр. БелНАН В. Г. Иванюку (Белорусский НИИ картофелеводства БелАН); проф. Э. Стакебрандту (Немецкая коллекция микрооранизмов, Германия).
Автор бесконечно благодарен своим наставникам и учителям: д.б.н., профессору Ирине Борисовне Наумовой (Биологический факультет, МГУ) и д.б.н., професору Ирине Михайловне Грачёвой (Московский Технологический Институт Пищевой Промышленности), а также д.б.н., профессору Дмитрию Григорьевичу Звягинцеву (Факультет Почвоведения, МГУ) и к.б.н. Галине Матвеевне Стрешинской (Биологический факультет, МГУ).
Автор признателен научным консультантам настоящей работы д.б.н. Людмиле Ивановне Евтушенко (ИБФМ им. Г. К. Скрябина РАН, отдел «Всероссийская коллекция микроорганизмов») за помощь в обсуждении и интерпретации результатов, по чьей инициативе и выполнена данная работа, и д.б.н., профессору Александру Ивановичу Нетрусову (Биологический факультет, МГУ, зав. каф. микробиологии) за постоянное внимание и интерес к нашим работам, а также за помощь в обсуждении результатов и оформлении данной работы.