Об особенностях идентификации почвенной микрофауны при помощи проекционного микроскопа

Применялся также метод культивирования в питательной среде. На чашки Петри помещали образцы почвы из верхних горизонтов на 10−12 дней. Регулярно смачивали раствором Кнопа (дистиллированная вода — 1000 мл; Ca (NC>3)2 — 0, 25 г; MgSCE — 0, 06 г; KH2PO4 — 0, 06 г; KCl — 0, 03 г; FeCl3 — 1 капля 1% раствора). Держали под лампой 10 ч в сутки. На поверхности почвы помещались покровные стекла для… Читать ещё >
Об особенностях идентификации почвенной микрофауны при помощи проекционного микроскопа (реферат, курсовая, диплом, контрольная)
Почва — это среда и одновременно ресурс глобального биоразнообразия. Сложность физико-химического строения почвы, пористая структура, огромная площадь внутренней поверхности, разнообразие органических веществ, воды, пищи и химических соединений означают, что представители животного, растительного мира и мира микробов могут сосуществовать одновременно и занимать подходящие для их существования разные экологические ниши [1]. Представители микрофауны, такие как простейшие, нематоды, микроартроподы, выполняют экосистемную роль микрорегуляторов, т. е. регулируют потоки питательных веществ. Они воздействуют на микробиальную активность почв через хищничество, а также через паразитические или мутуалистические взаимодействия с другими микробами или беспозвоночными животными.
Разнообразие биологических регуляторов важно для длительной стабильности функционирования почвы, равно как для регулирования количества видов и сохранения биоразнообразия [2, 3]. Актуальна эта проблема и для Казахстана, где фауна почв и эпигейных растительных сообществ изучена совершенно недостаточно. Но изучать представителей микромира отнюдь не просто. Мир малых величин зачастую хрупок и недолговечен: зажатые между двумя стеклышками живые клетки гибнут. Фотография позволяет увековечить все эти мимолетности прежде, чем они исчезнут. Способность фиксировать изображения, невидимые невооруженным глазом, — бесценный вклад фотографии в науку. Недаром Роберт Кох, знаменитый немецкий бактериолог, еще в 1870-х гг. убеждал коллег отказаться от зарисовок и пользоваться микрофотографией. Однако до сих пор большинство видов животных, неразличимых невооруженным глазом, не известны науке. Считают, что не описано 99% почвенных бактерий и нематод.
Эффективность исследований разнообразных объектов в лабораторных условиях при помощи микроскопических приборов сегодня значительно повышается благодаря применению современных цифровых комплексов, которые содержат микроскоп, систему захвата изображений и программу. Результаты анализов изображений зависят напрямую от установленного программного обеспечения. Перед современным исследователем микрофауны стоит не только задача правильного выбора и подготовки образцов для исследования, но и не менее сложная — подбор такого программного обеспечения, которое эффективно управляется камерой, качественно обрабатывает нужные изображения и сохраняет все полученные результаты. Это дает возможность экспериментировать со множеством различных фильтров и операций с цветовыми оттенками, устранять разнообразные дефекты для облегчения и уточнения таксономического диагноза. Применение такого современного, отлаженного для целей исследования цифрового комплекса является важной составляющей успешной экспериментальной работы, получения новых данных по фаунистике и экологии видов.
Целью нашей работы было предварительное определение некоторых представителей микрофауны почв, взятых на участке ботанического сада КарГУ им. Е. А. Букетова с помощью выбранного программного обеспечения.
Мы исходили из представления о том, что до сих пор вопрос о классификации простейших является одним из самых сложных вопросов в современной систематике. Освоение практических методов применения подобранного программного обеспечения вместе с цифровой микроскопией дает возможность формирования базы данных для изучения анатомо-морфологической организации микроскопических беспозвоночных также и в учебном процессе. Еще один важный аспект — эстетический. Мир малых величин открывает неожиданную красоту. В увеличенных фотоизображениях возникают новые сочетания линий, форм и красок: симметричное строение крошечных ресничек, сложная фактура поверхности клетки и т. д. Поэтому владение мастерством микрофотографии — несомненный плюс для биолога любого профиля: и педагога, и исследователя.
Материалы и методы исследования
анатомический микрофауна почвенный учебный Микроскопическая фауна обитает в почве в водных пленках и капиллярах. Из образцов почвы верхних горизонтов брали навеску 200 г для приготовления водных суспензий. Оставляли на 3−4 часа для размокания почвенных частиц. Затем суспензию взбалтывали в течение 10 мин и сливали в чашку Петри, дно которой расчерчено на квадраты по 1 см2. Тонко оттянутой пипеткой под бинокуляром или при малом увеличении микроскопа раковинки выбирали из водной суспензии на предметное стекло. Живые организмы изучали в капле воды из той же пробы под покровным стеклом. Для фиксации и хранения использовали 3%-ный формалин или 70%-ный спирт [4−6].
Применялся также метод культивирования в питательной среде. На чашки Петри помещали образцы почвы из верхних горизонтов на 10−12 дней. Регулярно смачивали раствором Кнопа (дистиллированная вода — 1000 мл; Ca (NC>3)2 — 0, 25 г; MgSCE — 0, 06 г; KH2PO4 — 0, 06 г; KCl — 0, 03 г; FeCl3 — 1 капля 1% раствора). Держали под лампой 10 ч в сутки. На поверхности почвы помещались покровные стекла для покрытия пленками обрастания. Образовавшиеся пленки обрастания рассматривали сначала при помощи бинокулярного микроскопа МБС. Однако простое наблюдение за микроскопическими животными в капле воды на препарате обычно позволяет определить только принадлежность особи к старшим таксонам. Изготовление фиксированных образцов, а тем более умерщвление делают идентификацию невозможной. Поэтому дальнейшее исследование морфологической организации проводилось по фотоили видеосъемке движения объектов при увеличениях в М60−640 с помощью поляризационного лабораторного микроскопа «BinaLogic 6ХВ-РС», предназначенного для наблюдения, фотографирования и видеопроекции прозрачных объектов в проходящем поляризованном и обычном свете.
Для съемки внешнего вида микроскопических животных с целью визуализации образцов и их первичного поверхностного анализа использовалось программное обеспечение «Camtasia Studio», позволяющее производить быстрые и точные снимки высокого разрешения. Методика анализа и обработки изображений включала регистрацию входных видеоснимков, их редактирование (изменение яркости, контрастности, морфологические операции, подавление шумов, специальные фильтры и т. д.) и идентификацию зоологических объектов [7].
Для обработки изображения использовался графический редактор Adobe Photoshop. Чтобы улучшить визуальное восприятие и проанализировать изображение исследуемых объектов, использовался фильтр для устранения «шумов» Topaz DeNoise 5.
Для проявления мелких деталей строения органелл, ресничек и цирр, выраженности мембран, подсчета и уточнения места расположения ребер, щетинок и рядов цирр, являющихся важными систематическими признаками инфузорий, использовался фильтр «Увеличение резкости».
Для восстановления исходных цветов полученного изображения, искаженного при вводе в компьютер из-за недостаточного освещения, использовался фильтр «Автотон». Чтобы выявить отличия форм, размеров и топологии объектов, использовалось сравнение наложением двух изображений друг на друга.
Результаты и их обсуждение
Для повышения четкости изображения и наилучшего визуального анализа внешнего вида структурных особенностей клетки или анатомических и морфологических частей тела, являющихся важными систематическими признаками, использовались различные фильтры в графическом редакторе Adobe Photoshop.
При изучении морфологии почвенных амеб применялся фильтр «Увеличение резкости» — для улучшения четкости псевдоподий. Выполнялась коррекция «Цветовой тон/Насыщенность. Для создания наилучшего визуального поля проводилось устранение помех (указано на рис. 1 стрелкой).
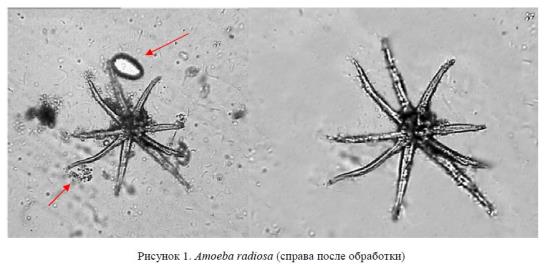
Проведенный анализ позволил отнести эту амебу, имеющую хорошо выраженную звездчатую форму тела и тонкие, длинные, игловидные псевдоподии к отряду Amoebida семейству Amoebidae.
Подтип Sarcodina — Саркодовые. Для саркодовых характерно наличие плазматического тела, окруженного тонкой плазмалеммой или более плотной оболочкой; оно может лежать и внутри различно устроенных раковинок. Ложноножки, или псевдоподии, служащие для движения и захвата пищи, у разных групп саркодовых имеют различное строение. В цитоплазме саркодовых видны сократительные и пищеварительные вакуоли, экскреторные гранулы и иногда симбиотические водоросли, благодаря которым некоторые простейшие приобретают зеленый цвет.
Отряд Amoebida. Тело голое, лишенное плотной оболочки или раковинки, лишь изредка имеется уплотненная пелликула.
Семейство Amoebidae. Ядро одно, включения в плазме иные.
Вид Amoeba radiosa (Ehrenberg, 1831). Псевдоподии тонкие, длинные, игловидные. Форма тела в покое звездчатая. Встречается между водными растениями, в сырых местах [8].
Для восстановления исходных цветов полученного изображения раковинной амебы, искаженных при вводе в компьютер из-за недостаточного освещения, использовался фильтр «Автотон». Исходное изображение нуждалось в корректировке цветов, так как изображение получилось достаточно бледным. Для этого использовалась коррекция «Цветовой тон/Насыщенность» (рис. 2).
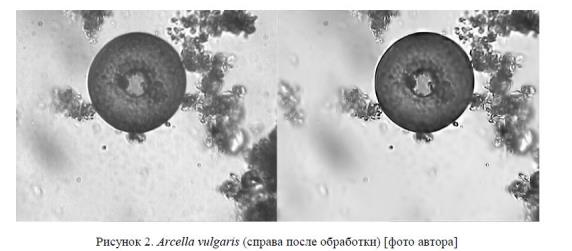
Проведенный анализ позволил отнести эту амебу, имеющую характерную округлую форму раковины и круглое устье, расположенное в центре вогнутой вентральной поверхности, к семейству Arcellidae, роду Arcella.
Отряд Testacida. Тело заключено в раковинку или окружено плотной студенистой оболочкой. Для определения представителей отряда раковинных амеб (Testacida) большое значение имеет изучение строения и формы раковинки. У небольшого числа раковинных амеб тело покрыто прилегающей к цитоплазме более или менее плотной студенистой оболочкой, которая меняет свою форму при движении простейшего. У остальных раковинка не прилегает плотно к телу, оно соединяется с раковинкой при помощи особых выростов — эпиподий. Раковинка у Testacida однокамерная, но у некоторых представителей (например, Pontigulasia) между передней и задней частями раковинки имеется тонкая кожистая перфорированная диафрагма, так что возникает мнимая двухкамерность.
Псевдохитиновая раковинка может быть бесструктурной (например, Hyalosphaenia) или иметь отчетливо выраженную гексагональную структуру (Arcella). Большинство раковинных амеб имеет раковинку, состоящую из двух слоев — нижнего, псевдохитинового, и наружного, который может быть представлен либо идиосомами (кремнеземными пластинками, образующимися внутри цитоплазмы амебы и затем выходящими на ее поверхность), либо ксеносомами (минеральными частицами экзогенной природы). Для идиосом характерна более или менее правильная форма: округлые, овальные, изредка извитые или прямоугольные и квадратные пластинки. Ксеносомы чаще всего мелкие песчинки или частицы детрита, реже — пустые раковинки диатомовых водорослей, спикулы губок и другие частицы. Форма устья и его расположение имеют большое значение для определения видов. Устье может быть округлым, удлиненным, щелевидным, лопастным; края его могут утолщаться, образуя так называемые губы, или изгибаться, образуя воротнички. Вокруг устья может располагаться венец из вторичных пор.
Определенные морфотипы приурочены к тому или иному местообитанию: водной среде свойственны уплощенно-дисковидный (Arcella), трахелостомный (Pontigidasia), акростомный (Difflugia) типы; гумусовым горизонтам почв — уплощенная вентральная поверхность при осевой симметрии (Cyclopyxis), плагиостомный (Centropyxis) и криптостомный (Plagiopyxis) типы. Поэтому морфологическая структура населения тестацей может быть использована как экологический индикатор, характеризующий условия обитания в том или ином биотопе [5].
В гумусовом горизонте почвы обитают тестацеи с полусферическими раковинками, которые характеризуют облик всего сообщества раковинных амеб (таксоценоз). Псевдостом этих раковинок или округлый (с тенденцией к суживанию), или же образуется криптостом (верхняя губа раковинки натянута на щелевидное отверстие) и почти всегда отмечается инвагинация. Размер раковинки, как правило, более 50 мкм.
Семейство Arcellidae (Ehrenberg, 1843). Раковинка органическая, имеет постоянную форму, однослойная с альвеолярным строением. Поверхность без инородных включений, гладкая или с мелкими вдавлениями. Симметрия радиальная, форма дисковидная, чашевидная или шапочковидная. Устье округлое, расположено в центре на впяченной внутрь вентральной поверхности раковинки (центро-стом). Одно-, двухи многоядерные формы.
Род Arcella. Раковинка полностью органическая, с гексагональной структурой, кроющие элементы отсутствуют. В плане раковинка округлая, многоугольная, овальная или неправильной формы. В профиль раковинка чаще всего полусферическая или уплощенная, реже трапециевидная или другой формы. Устье круглое, значительно реже лопастное или неправильной формы, располагается в центре вентральной поверхности, на дне предустьевой впадины. Цитоплазма, как правило, заполняет раковинку не полностью, прикрепляясь к ней эпиподиями. Ядер два и более.
Вид Arcella vulgaris (Ehrenberg, 1830). Раковинка относительно крупная, полусферическая, в плане круглая. Ровная дорсальная поверхность в области перехода в вентральную образует небольшой округлый киль. Устье круглое, с воротничком или без, располагается в центре вогнутой вентральной поверхности. В цитоплазме два ядра, расположенные по бокам ротового отверстия, и несколько вакуолей. Диаметр раковинки 100−145 мкм, высота — 52−73 мкм, диаметр устья 30−73 мкм, глубина предустьевой воронки 14−24 мкм. Отношение высота раковинки/диаметр раковинки 0, 370, 51. Экология: пресные воды, мхи, обычный вид [4, 9].
Для проявления мелких деталей, структурных элементов раковины амеб (идиосомы раковинки), использовался фильтр «Увеличение резкости». Удалены ненужные объекты для очищения визуального поля (рис. 3).
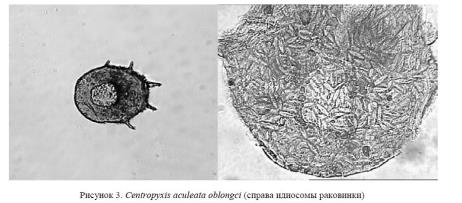
Проведенный анализ позволил отнести эту амебу, имеющую характерную округлую, слегка вытянутую форму раковины с 5-ю шипами, к семейству Centropyxidae, роду Centropyxis.
Семейство Centropyxidae (Jung, 1942). Раковинка либо органическая (альвеолярная структура при помощи светового микроскопа не выявляется), без ксеносом, либо агглютинированная, причем количество ксеносом и их характер различны. Симметрия билатеральная. Форма в плане округлая или эллиптическая, в профиль — полушаровидная, выше или ниже полусферы, часто латерально сжатая на переднем конце. Устье центрально расположенное (центростом) или эксцентричное (пла-гиостом), округлое или овальное, более или менее углубленное внутрь раковинки. В цитоплазме одно ядро.
Род Centropyxis. Является наиболее филогенетически изменчивым родом раковинных амеб подотряда Arcellina. При помощи топофенетического подхода возможно выявление эволюционных линий, начинающихся от центропиксисов и приводящих к появлению новых родов. Предковым видом считается Centropyxis aculeata, от которого берут начало несколько линий:
- · корненожки, заселяюшие почвенно-моховые местообитания; ряд заканчивается типично почвеннымPlagiopyxis;
- · также почвенно-моховые корненожки; ряд завершается родомHeleoperci, Euglypha, Trinema, Archerella.
В более засушливых биотопах — «подушках» эпигейных, эпилитных и эпифитных зеленых мхов — характерными являются отдельные виды родов Arcella, Trinema, Euglypha, Assulina, Corythion.
Вид Centropyxis aculeata (Ehrenberg, 1838). Раковинка относительно крупная, в плане округлая, в профиль сильно уплощенная, причем передняя часть сплющена несколько больше задней. Стенки раковинки хитиновые, бурого или коричневого цвета, редко покрыта ксеносомами. Края задней половины раковинки снабжены 2−8 (и более) шипами длиной 12−40 мкм. Округлое или неправильной формы устье расположено в передней части раковинки в неглубокой приротовой впадине. Края ротового отверстия воронкообразно вогнуты. Передняя часть углубляется в раковинку несколько больше, чем задняя, и с помощью специальных дугообразных скреп часто срастается с внутренней ее поверхностью, оставляя лишь отдельные полукруглые отверстия для выхода псевдоподий.
Длина раковинки без шипов 110−160 мкм, диаметр устья 31−60 мкм, высота раковинки составляет 2/5 диаметра. Экология: пресные воды. Centropyxis aculeata oblongci (Deflandre, 1929) отличается от вида несколько вытянутой формой с параллельными боковыми сторонами и меньшей дорсовентраль-ной уплощенностью. Длина раковинки без шипов 100−160 мкм, ширина раковинки 95−120 мкм [8, 9].
При проведении съемок микроскопических объектов не всегда удавалось создать идеальные условия для точной передачи особенностей структурных частей организмов. Все необходимые операции редактирования (удаление ненужных частиц на снимке, изменение фона и контрастности, монтирование нескольких снимков в один и т. д.) производились при помощи графического редактора Adobe Photoshop. Использовались различные виды корректировки. Например, для того чтобы выявить отличия форм, размеров и топологии объектов, выполнено наложение двух изображений друг на друга (рис. 4).Сравнение наложением происходило путем перемещения, поворота и масштабирования одного изображения (или его части) относительно другого, причем верхнее изображение могло иметь разную степень прозрачности.
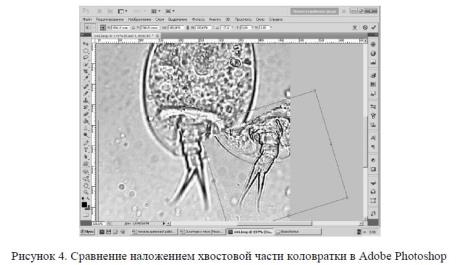
Для удобства совмещение проводилось по отмеченным точкам, установленным попарно на обоих изображениях и соответствующим идентичным участкам изображения.
Для проявления мелких деталей, выраженности пальцев ног, контура формы панциря, как важных систематических признаков, добавлялся фильтр «Увеличение резкости» (рис. 5).
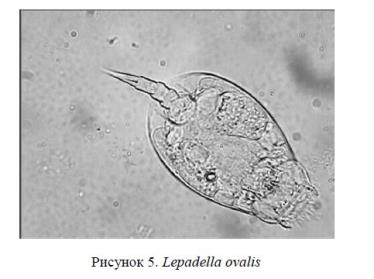
Такой анализ позволил отнести коловратку, имеющую характерную форму панциря на спинном краю с U-образным вырезом, а также характерное строение пальцев ног к классу Monogononta и семейству Colurellidae.
Семейство Colurellidae. Размеры мелкие. Тело подразделено на голову, туловище и ногу. Голова хорошо обособленная от туловища, у Colurella и Squatinella со спинной стороны защищена на брюшную сторону согнутой тонкой прозрачной пластинкой («капюшон»). Туловище покрыто панцирем, состоящим из 1−2 пластинок. Панцирь у рода Lepadella составлен из 2 плотно друг к другу прилегающих краями спинной и брюшной пластинок и сильно сплющен дорсовентрально. Спинная, реже брюшная, пластинка нередко с срединным продольным килем или горбом. Поверхность панциря гладкая, иногда несколько граненая или со скульптурой в виде зерен, складок, сеточки или точек. Нога 3−4-члениковая, заметно сдвинутая на брюшную сторону. Пальцы ноги более или менее длинные, на концах острые, иногда частично или полностью сросшиеся. Коловращательный аппарат близок к типу Euchlanis. Мастакс маллеатного типа. Спинное щупальце плохо выражено. Боковые щупальцы обычно в задней половине панциря. Глазные пятна, как правило, имеются в числе 2 или 4 в виде маленьких округлых пятен с линзами.
Род Lepadella (Bory de St. Vincent, 1826). Панцирь сплющенный дорсовентрально, составленный из спинной и брюшной пластинок, плотно сросшихся краями. Поверхность панциря гладкая, редко со скульптурой в виде точек. Обычно скульптура лишь в краевой шейной части, где образует своеобразную широкую кайму — воротничок. Спинная пластинка панциря более или менее выпуклая, часто со срединным продольным острым или сводчатым килем, реже с округлым срединным горбом. Брюшная пластинка обычно почти плоская. Передние края панциря вогнутые и обычно неодинаковые: брюшной вырез («синус») более глубокий, спинной — иногда почти прямой, реже — вперед выступающий. У ряда видов с боков переднего края острые шипы. Задний край панциря округлый, угловатый, иногда с 1−2 шиповидными выростами. Отверстие для ноги сравнительно большое, впереди обычно закругленное и с параллельными боковыми краями, реже многоугольное. Нога 3−4-чле-никовая, членики ноги иногда разной длины. Пальцы довольно длинные, к концу суживающиеся, прямые или слегка согнутые, разделенные, равной (подрод Lepadella si str.) или разной (подрод Heterolepadella) длины, полностью или частично сросшиеся (подрод Xenolepadella). Боковые щупальца в последней трети панциря, не всегда хорошо заметные. Обычно 2 глазных пятна.
Вид Lepadella ovalis (Muller. 1786). Спинная пластинка панциря слабо выпуклая (высота около 1/5 длины панциря). Панцирь от овальной до круглой формы. Передний спинной край с U-образным вырезом, брюшной — с еще более глубоким, почти округло-ромбическим. Отверстие для ноги с параллельными или несколько сходящимися книзу боковыми краями. Длина панциря 93−155 мкм. Встречается на илистых грунтах различных водоемов. Распространен повсеместно. Всесветен [10].
Нематоды после простейших являются наиболее богатой по численности, видовому разнообразию группой почвенных животных. Чтобы улучшить визуальное восприятие и проанализировать изображение этой нематоды, использовался фильтр для устранения «шумов» Topaz DeNoise 5. С помощью графического редактора смонтированы две фотографии в одну, на которой рассмотрены отдельные части тела (рис. 6).
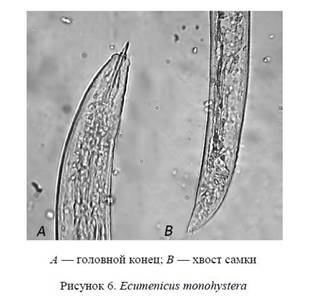
Проведенный анализ позволил определить систематическое положение этой нематоды: принадлежность к отряду Dorylaimida, роду Dorylaimus.
Класс Nematoda. Несегментированные черви без хоботка. Тело покрыто плотной упругой кутикулой, либо гладкой, либо так или иначе орнаментированной. Это могут быть кольца — от едва заметных до весьма глубоких и широких. Склероции в виде бляшек разного рода; продольные ребра; тонкие штрихи, нерегулярно исчерчивающие кутикулу вдоль тела или несколько диагонально. Довольно обычны и короткие соматические щетинки. Ротовое отверстие расположено терминально и окружено слабо выраженными губами и, как правило, головными щетинками. Губные папиллы и головные щетинки выполняют механорецепторную функцию. Хеморецепция осуществляется амфида-ми — органами, расположенными по бокам головы на уровне стомы или несколько ниже. Форма ам-фидов различна и играет ведущую роль в диагностике отрядов. Например, круглый амфид — признак отряда Monhysterida, спиральный — Chromadorida, карманообразный характерен для отрядов Enoplida, Dorylaimida и Mononchida. Сенсорные органы обычно в форме шипов, щетинок или сосочков. У пресноводных и сухопутных видов самок больше, чем самцов. Свободноживущие нематоды обильны во всевозможных водоемах, почве и даже во льду [11].
Отряд Dorylaimida. Все представители отряда имеют червеобразное тело, иногда довольно крупных размеров, У многих видов хвост хлыстовидно удлинен, у других же он короткий, цилиндрический или конический. каудальный, Трофикосенсорный отдел начинается от головного конца и тянется до конца пищевода. Здесь хорошо различима голова, обычно выделенная из контуров тела. На голове расположены два круга папилл, иногда довольно сильно разрастающихся, а за постлабиальным сужением — пара амфид. В трофикогенитальном отделе располагается средняя кишка с ее задним обособленным участком (преректумом), а также ректум, мужские или женские половые трубки, чувствительный аппарат половых органов. Каудальньй отдел начинается у анального отверстия и тянется до конца тела. У начала хвоста обычно расположены папиллы и кутикулярные поры.
Семейство Dorylaimidae объединяет свободноживущих нематод, обитающих в пресных и солоноватых водах и в любых типах почв. Некоторые из них могут встречаться и на растениях. Кутикула гладкая или с продольными ребрами, иногда с кольчатым внутренним слоем. Лабиальная область обычно широкая и несклеротизированная, иногда узкая и склеротизированная. Копье аксиальное, обычно довольно широкое, с хорошо выраженным просветом, реже тонкое. Отверстие копья варьирует по величине, преимущественно хорошо заметное, занимает 1/3−¼ длины копья; приставка простая. Ведущее кольцо двойное или простое, обычно ясное. Пищевод мускулистый, разделенный на переднюю узкую и заднюю расширенную части, последняя имеет цилиндрическую форму, небульбо-видная, Преректум ясно обособленный, иногда очень длинный. Гонады самок обычно парные, реже имеется непарная поствульварная гонада. Супплементы самцов обычно расположены перед спикула-ми, образуют серию или разбиты на группы. Спикулы парные, с отростком. У большинства форм наблюдается половой диморфизм в строении хвоста: у самок он длинный, у самцов — короткий, тупой; у некоторых форм хвост самок и самцов удлиненный.
Род Dorylaimus (Dujardin, 1845). Относительно крупные нематоды, длина тела от 1 до 8 мм или несколько больше; кутикула толстая, с ясными боковыми порами; она всегда несет продольные кути-кулярные ребра. Головная капсула в большинстве случаев не выделяется или очень слабо выделяется из контуров тела. Копье хорошо развито, плотное, обычно в 2−3 раз больше ширины головной капсулы; ведущее кольцо двойное. В задней части тела самца, кроме супплементов, имеется обычно серия парных субмедиальных (субвентральных) лапищ. Спикулы плотные, искривленные, с отростком (придатком). Преректум хорошо развит у обоих полов; у самца начинается еще до серии супплемен-тов. Хвост самки удлиненный, на конце у некоторых видов крюковидно загнут; хвост самца короткий, тупоокруглый.
Вид Ecumenicus monohystera (de Man, 1880) Thorne, 1974. Копье в 2−3 раза больше лабиальной ширины, отверстие занимает 1/3 его длины или больше. Лабиальная область ясно выделена, ротовое отверстие окружено плоскими внутренними губами. Клетки кишечника с рассеянными темными гранулами. Космополит [12].
Таким образом, для изучения анатомо-морфологической организации объектов микрофауны было сделано более 70 фотографий и 20 видеозаписей, послуживших основой для выявления основных диагностических признаков. На примере представителей типов Sarcomastigophora, Rotatoria, Nematoda сделана попытка идентификации микрофауны почв. С помощью графического редактора Adobe Photoshop выполнены поэтапные стадии определения видов Amoeba radiosa (Ehrenberg, 1831), Arcella vulgaris (Ehrenberg, 1830), Centropyxis aculeata (Ehrenberg, 1838), Lepadella ovalis (Muller. 1786), Ecumenicus monohystera (de Man, 1880). Подобное сочетание традиционных и современных методов исследования микроэукариот значительно повышает качество работы. Однако большую роль в изучении группы играет материальная база исследований. Это и оборудование для культивирования, и цифровые микроскопы для проведения светомикроскопических исследований, и подготовка материала для электронной микроскопии, и т.д. Полученные данные о биоразнообразии, систематике и биологии микрофауны позволяют участвовать в разработке современных проектов по изучению механизмов амебоидного движения, молекулярной экологии и проблемы вида, индикации загрязнения среды. Поэтому отработка приемов исследования и организация планомерного и поэтапного изучения микроэукариот остается актуальной составляющей традиционной университетской науки.
- 1. Jimenez J.J., DecaensТ., Gioia C. et al. The values of soil animals for conservation biology // European Journal of soil biol — 2006. — Vol. 42. — P. 523−538.
- 2. Assessment of soil biodiversity policy instruments in EU-27 / Draft final report. European Commission DG ENV. — Intelligence Service Bio, 2009. — 232 p.
- 3. Лебедева Н. В., Дроздов Н. Н., Криволуцкий Д. А. Биоразнообразие и методы его оценки. — М.: Изд-во МГУ, 1999. — 93 с.
- 4. Мазей Ю. А., Цыганов А. Н. Пресноводные раковинные амебы. — М.: Товарищество научных изданий КМК, 2006. —300 с.
- 5. Гельцер Ю. Г., Корганова Г. А., Алексеев Д. А. Почвенные раковинные амебы и методы их изучения. — М.: Изд-во МГУ, 1985. — 79 с.
- 6. Алимов А. Ф. Протисты // Руководство по зоологии. 2007. — Ч. 2. — 1141 с.
- 7. Пантелеев В. Г., Егорова О. В., Клыкова Е. И. Компьютерная микроскопия. — М.: Техносфера, 2005. — 304 с.
- 8. Определитель пресноводных беспозвоночных России и сопредельных территорий / Низшие беспозвоночные. — СПб., 1994. — Т. 1. — 340 с.
- 9. Кутикова Л. А., Старобогатов Я. И. Определитель пресноводных беспозвоночных Европейской части СССР (планктон и бентос). — Л.: Гидрометеоиздат. 1977. — 315 с.
- 10. Кутикова Л. А. Бделлоидные коловратки фауны России. — М.: Товарищество научных изданий КМК, 2005. — 315 с.
- 11. Ettema C. Soil nematode diversity: species coexistence and ecosystem function // Journal of nematology. — 1998. — 30. — P. 159−169.
- 12. ЭлиаваИ.Я. Свободноживущие нематоды семействаDorylaimidae. — Л.: Наука, 1984. — С. 139.