Ультраструктурные показатели участия мононуклеарных фагоцитов в формировании эндототксемического отека в коре головного мозга, спинальных ганглиях и периферических нервах

Эндотоксин играет центральную роль в патогенезе синдрома системного воспаления и септического шока, являющихся основными причинами развития полиорганных недостаточностей, которые от 40 до 70% случаев заканчиваются летально. Среди причин, приводящих к полиорганной недостаточности при эндотоксемии, особое место занимает появление отечной жидкости, являющееся следствием повышения сосудистой… Читать ещё >
Ультраструктурные показатели участия мононуклеарных фагоцитов в формировании эндототксемического отека в коре головного мозга, спинальных ганглиях и периферических нервах (реферат, курсовая, диплом, контрольная)
На светооптическом и ультраструктурном уровне показано развитие острого отека коры головного мозга, спинальных ганглиев и периферических нервов спустя 2 часа после внутривенно введенного эндотоксина. На основании полученных фактических материалов определена ведущая роль мононуклеарных фагоцитов в повышении сосудистой проницаемости, приводящей к появлению отечной жидкости во всех исследованных частях нервной системы.
Эндотоксин [липополисахарид (ЛПС) стенки грамм-отрицательных бактерий] играет центральную роль в патогенезе синдрома системного воспаления и септического шока, являющихся основными причинами развития полиорганных недостаточностей [1−2], которые от 40 до 70% случаев заканчиваются летально [3]. Среди причин, приводящих к полиорганной недостаточности при эндотоксемии, особое место занимает появление отечной жидкости, являющееся следствием повышения сосудистой проницаемости [4]. Долгое время главной причиной появления отечной жидкости считалось воздействие ряда цитокинов (фактора некроза опухоли, интерлейкинов, тромбоксана А2, простагландинов и др.), освобождающихся при дегрануляции тучных клеток. Однако в последние годы, благодаря применению современных методов исследования в молекулярной биологии, было уточнено, что наряду с тучными клетками существенная роль в повышении сосудистой проницаемости принадлежит мононуклеарным фагоцитам. Sawai A и соавт. [5] показали, что уровень перитонеальной проницаемости не коррелирует с инфильтрацией нейтрофилов, тучных клеток, Ти B-лимфоцитов, С-реактивного белка и др. С помощью множественного линейного регрессионного анализа они установили, что основным фактором приводящим к увеличению проницаемости сосудов перитона является инфильтрация CD-68-позитивных макрофагов. Более того, результаты недавних исследований показали, что среди цитокинов, продуцируемых мононуклеарными фагоцитами фактор ингибирующий миграцию макрофагов (MIF) представляет собой один из главных регуляторов их реакции на воздействие эндотоксина (липополисахарида) грам-отрицательных бактерий [6]. Значительное возрастание концентрации MIF в составе цереброспинальной жидкости при гнойных менингитах и энцефалитах указывает на его непосредственное участие в воспалительных реакциях ЦНС [7].
Учитывая вышеизложенное, целью настоящего исследования было изучение гистотопографии и ультраструктурных параметров взаимоотношений мононуклеарных фагоцитов с паренхиматозными элементами коры головного мозга, спинальных ганглиев и периферических нервов при экспериментальной эндотоксемии.
Материал и методы исследования. Эксперименты были проведены на двадцати взрослых самцах белой крысы (массой 220−260g). Эндотоксемия была достигнута введением очищенного ЛПС (1mg/kg взятой от Escherichia coli, Серотип 0111: B4 InvivoGen, San Diego, USA) в 0,5мл физиологического раствора в латеральную хвостовую вену белых крыс (n = 10). Контрольной группе (n = 10) вводили только 0.5 ml физиологического раствора. Спустя 2 часа, животные были декапитированы под кетамин/ксилазиновой (100/10 mg/kg и. п.) анестезией. Сразу после декапитации головной мозг был извлечен и погружен в раствор фиксатора, состоящего из 2.5% параформальдегида, 2.0% глютаральдегида и 0.1% пикриновой кислоты в 0.1 M растворе фосфатного буфера (pH 7.4) на ночь. После двухчасовой постфиксации в 1%-ном растворе осмиевой кислоты ткани были обработаны согласно общеустановленным методам электронной микроскопии и уплотнены в заливочной среде Спурр и Эпон-аралдит. Полученные полутонкие срезы (1−2 мкм) окрашивались 0,5%-ным раствором метиленового синего и обследовались световым микроскопом Latimet (Leika). Изображения были сфотографированы цифровой фотокамерой Pixera (USA). Ультратонкие срезы были окрашены 2,0%-ным уранила-ацетатом и цитратом свинца и были исследованы трансмиссионными электронными микроскопами Hitachi-HU-12A и Jeol 1200CX, при ускоряющем напряжении 75−80 кв. эндотоксин септический полиорганный отечный.
Результаты исследования и их обсуждение. Спустя 2 часа после внутривенного введения липополисахарида в элементах как центральной так и периферической нервной системы наблюдались многие признаки острого воспалительного процесса. Так, на светооптическом уровне отмечается значительное расширение субарахноидального и субпиального, а также перисосудистых пространств в коре головного мозга (рисунок 1А). Появление различных форм гранулярных лейкоцитов и лимфоцитов в субарахноидальном пространстве свидетельствует о миграции данных клеток в результате повышения сосудистой проницаемости.
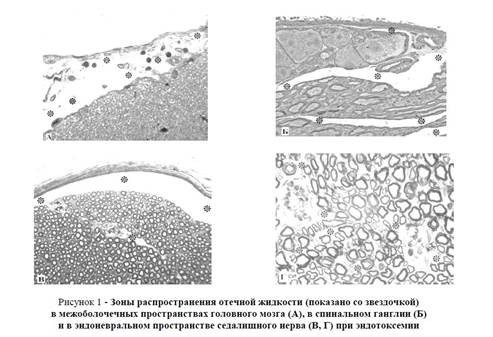
Рисунок 1 — Зоны распространения отечной жидкости (показано со звездочкой) в межоболочечных пространствах головного мозга (А), в спинальном ганглии (Б) и в эндоневральном пространстве седалищного нерва (В, Г) при эндотоксемии Примечание: Объяснение дано в тексте. Микрофотография. Полутонкий срез. Окраска — метиленовый синий. Увл.: А, Б, Г — х500; В — х250.
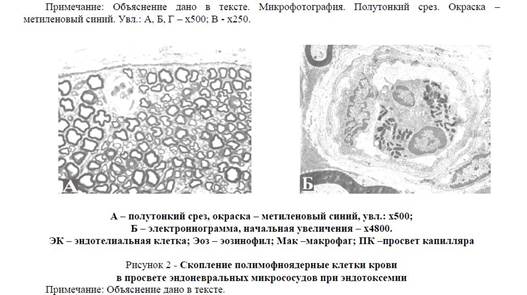
Рисунок 2 — Скопление полимофноядерные клетки крови в просвете эндоневральных микрососудов при эндотоксемии Примечание: Объяснение дано в тексте.
Вторым обязательным признаком эндотоксемического отека является увеличение количества микроглиальных клеток в коре мозга (рисунок 3), а макрофагов в спинальных ганглиях (рисунок 4А) и периферических нервах (рисунок 4Б).
Как видно из рисунка 3, активированная микроглиальная клетка располагается в непосредственной близости деформированного кровеносного сосуда коры головного мозга. В просвете сосуда можно обнаружить миелиноподобное тельце, указывающее на нарушение целостности плазмалеммы эндотелия. В цитоплазме как микроглиальной клетки, так и эндотелия сосуда отмечается большое количество рибосом, дающих информацию об усилении синтетической активности в данных клетках. Вокруг коркового капилляра (рисунок 3) между элементами нейропила можно определить наличие просветленных участков, соответствующих вазогенному отеку (указан звевдочкой), не обнаруживающемуся в контрольных препаратах. Отек особенно явно выражен на стороне активированной микроглии. Данное обстоятельство, а также расположение микроглиальной клетки между кровеносным сосудом и отекшей периваскулярной астроцитарной ножкой указывают на непосредственное участие микроглии в ее возникновении. Кроме этого, наличие большого количества пиноцитозных везикул, а также увеличение числа первичных и вторичных лизосом, мультивезикулярных телец в цитоплазме микроглиальныхй клеток дают основание предполагать усиление ее «очистительной» функции.
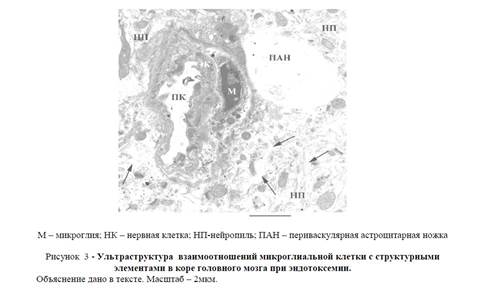
Рисунок 3 — Ультраструктура взаимоотношений микроглиальной клетки с структурными элементами в коре головного мозга при эндотоксемии. Объяснение дано в тексте. Масштаб — 2мкм.
В спинальных ганглиях активированные макрофаги наблюдаются в основном вокруг сосудов, располагающихся между глиоцитами, покрывающими псевдоуниполярные нейроны (рисунок 4A). Вблизи месторасположения активированных макрофагов обнаруживается расширение щелевидных пространств между мантийными глиоцитами и чувствительными нейронами спинальных ганглиев. Следует отметить, что в контрольных препаратах данные пространства не определяются. Появление миелиноподобных структур в описанных расширениях указывает на появление очагов деструкции в окружающих их мембранных элементах.
Вокруг эндоневральных микрососудов (рисунок 4Б и 5Б) наряду с просветвленными участками, соответствующими вазогенному отеку можно определить несколько фрагментов отдельных макрофагов. В периферических участках макрофага, прилежащего к стенке эндоневрального капилляра, определяется наличие незначительного количества аморфного вещества, в составе которого можно обнаружить поперечные и продольные срезы отдельных коллагеновых волокон. Кроме того, в цитоплазме макрофага увеличено содержание пиноцитозных везикул, а также рибосом как свободных, так и связанных с гранулярной эндоплазматической сетью. В стенке кровеносных сосудов, расположенных близко к макрофагу, резко усилен процесс пиноцитоза, отмечаются признаки деструкции плазмалеммы эндотелиоцитов, и нарушение непрерывности базальной мембраны. В эндотелии можно заметить митохондрии с разрушенными кристами. Помимо эритроцитов, в просвете эндоневрального капилляра отмечаются также активированные тромбоциты.
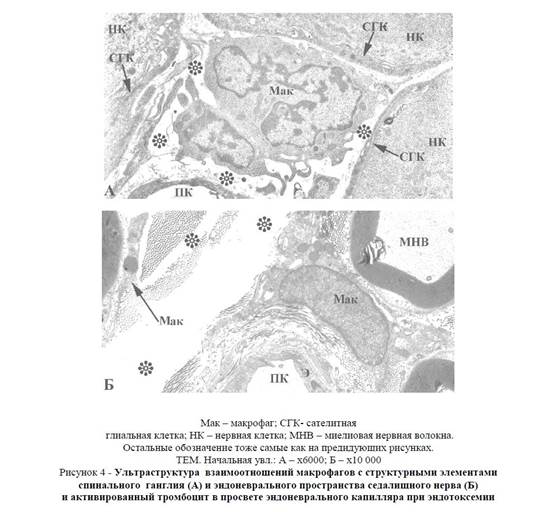
Рисунок 4 — Ультраструктура взаимоотношений макрофагов с структурными элементами спинального ганглия (А) и эндоневрального пространства седалищного нерва (Б) и активированный тромбоцит в просвете эндоневрального капилляра при эндотоксемии
Следует подчеркнуть, что в эндоневральном пространстве активированные макрофаги встречаются между отдельными нервными волокнами, а также вокруг почти всех сосудов микроциркуляторного русла. Уплощенные периферические участки макрофагов, примыкая друг к другу, порой со всех сторон охватывают эндоневральные артериолы и прекапилляры, не относящиеся к числу обменных микрососудов.
Нередко наблюдаются контакты между активизированными макрофагами и отростками фибробластов, на периферических частях которых можно заметить расширение цистерн гранулярной эндоплазматической сети.
Острая эндотоксемия приводит к заметным структурным изменениям эндотелиальной выстилки всех без исключения эндоневральных сосудов. Увеличение пиноцитозных везикул (кавеол) на периферии эндотелиоцитов (рисунок 5А) не исключает возможность формирования трансэндотелиальных каналов, признаками которых можно считать частичные нарушения целостности базальной мембраны. В межэндотелиальных контактах отмечается уменьшение количества точек слипания между наружными слоями плазмалеммы соседних эндотелиоцитов, соответствующих месторасположению плотных контактов. Нередко наблюдается расширение межэндотелиальных шелей, заполняющихся осмиофильным аморфным веществом (рисунок 5А).
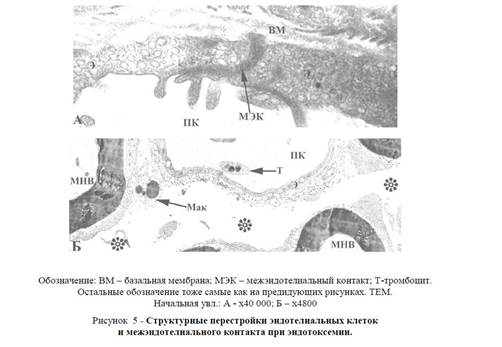
Рисунок 5 — Структурные перестройки эндотелиальных клеток и межэндотелиального контакта при эндотоксемии.
Анализируя полученные данные, можно отметить, что, несмотря на относительно невысокую дозу использованной нами ЛПС, в модели экспериментального отека обнаруживались почти все признаки острого воспалительного процесса. При этом наряду с повышением количества полиморфоядерных клеток и появлением отечной жидкости в межклеточных пространствах на себя обращали внимание следующие обстоятельства: заметное повышение содержания активированных тромбоцитов в просвете микрососудов; значительная перестройка цитоплазматических элементов и межклеточных контактов в эндотелиальном слое практически всех отделов микроциркуляторного русла; увеличение количества и активности микроглии в коре мозга, а макрофагов в спинальных ганглиях и эндоневральных пространствах периферических нервов.
Многочисленные фундаментальные исследования последних лет подтверждают, что на поверхности всех без исключения иммунокомпотетных клеток, участвующих как в врожденном, так и в приобретенном иммунитете, имеются рецепторы, распознающие патоген-связанные молекулярные структуры, так называемые Толл подобные рецепторы (Toll-like receptors — TLRs). Как тромбоциты и эндотелиоциты, так и мононуклеарные фагоциты экспрессируют TLR4 лигандом которых ЛПС грамм-отрицательных бактерий. В указанных клетках имеются также все основные компоненты сигнального комплекса TLR4 (TLR4, CD14, внеклеточный MD-2 и внутриклеточный адапторный белок MyD88), активизирующий ядерного фактора транскрипции — NF-kB, что приводит к экспрессии генов провосполительных цитокинов, хемокинов и других факторов.
Если в начальной стадии эндотоксемии противовоспалительные ответные реакции направлены в основном на уничтожение патогенных агентов посредством реактивных форм кислорода и активизации бактерицидных функций макрофагов, то в дальнейшем на первый план выходит увеличение проницаемости обменных микрососудов за счет усиления пиноцитоза с возможностью формирования трасэндотелиальных каналов [8−9] и разрушения межэндотелиальных контактов. Многие авторы едины в том, что под действием провоспалительных цитокинов и ЛПС в эндотелии сосудов происходит повышение уровня кальциевых ионов и активация киназы легкой цепи миозина, приводящие в конечном итоге к деполимеризации актина и разрушению межэндотелиальных контактов [9−11]. Наряду с этим существуют доказательства, согласно которым разрушение межклеточных контактов осуществляются путем интернализации (с помощью эндоцитоза) как адгезивных белков, так и белков (окклюдин, клаудин ј) участвующих в формировании плотных контактов [12].
Было установлено, что под действием тромбокиназы, выделяемой ЛПС-активированными тромбоцитами, из протромбина плазмы крови синтезируется тромбин, который также участвует в увеличении сосудистой проницаемости [13,14]. Интересно то, что под действием тромбина в течение 30 мин эндотелиальные клетки начинают вырабатывать MIF [11], который, по последним данным [15], является одним из ключевых провоспалительных цитокинов, участвующих в увеличении сосудистой проницаемости. Более того, исследованиями многих авторов было доказано, что основным источником секреции MIF являются мононуклеарные фагоциты, а провоцирующими факторами (триггерами) служат ЛПС, провоспалительные цитокины и глюкокортикоиды [16−17]. Следует особо подчеркнуть, что нейтрализация MIF с помощью антител предотвращает развитие эндотоксемического септического шока [18].
Анализируя результаты литературных и собственных данных, можно заключить, что центральная роль мононуклеарных фагоцитов в развитии полиорганной недостаточности при эндотоксемии может быть связана со следующими обстоятельствами: во-первых мононуклеарные фагоциты в отличие от полинуклеарных лейкоцитов являются долго живущими клетками; во-вторых, при воспалительных процессах они являются основным источником секреции MIF; в-третьих, именно мононуклеарные фагоциты под действием MIF по аутокринными механизму экспрессируют TLR4. Экстрацеллюлярная иммуннонейтрализация последних снижает экспрессию TLR4, тем самым ответ макрофагов на воздействие ЛПС. Кроме того, трансгенные мыши с отсутствием гена MIF становятся малочувствительными воздействию ЛПС и грамм-отрицательных бактерий [19].
Таким образом, при эндотоксемии в очаге воспаления формируется своеобразный «порочный круг», который усугубляет ход воспалительных реакций. Так, в ответ на MIF мононуклеарные фагоциты увеличивают экспрессию TLR4. Это создает условия для присоединения к ним еще больших количеств выходящего из кровотока ЛПС (вследствии разрушения межэндотелиальных контактов). В итоге, секреции воспалительных цитокинов значительно возрастают. Мы предполагаем, что именно данные обстоятельства и приводят к неуправляемому медиаторному хаосу, в результате которых развиваются острая полиорганная недостаточность и эндотоксиновый шок.
- 1. Яковлев М. Ю., Галанкин В. Н., Ипатов А. И. и др. Острый респираторный дистресссиндром при эндотоксиновом шоке // Архив патологии. — М., — № 11. — С.81−89.
- 2. James A. Russell, M.D. Management of Sepsis // N Engl J Med 2006. — 355. — Р. 1699−1713.
- 3. Annane D, Aegerter P, Jars-Guincestre MC et Current epidemiology of septic shock: the CUB-Rea Network // Am J Respir Crit Care Med. — 2003. — Vol.168. Р.165−172.
- 4. Kolaczkowska E, Scislowska-Czarnecka A, Chadzinska M et Enhanced early vascular permeability in gelatinase B (MMP-9)-deficient mice: putative contribution of COX-1-derived PGE2 of macrophage origin // J Leukoc Biol, 2006. Jul;- 80(1). — Р.125−132.
- 5. Sawai A, Ito Y, Mizuno M et Peritoneal macrophage infiltration is correlated with baseline peritoneal solute transport rate in peritoneal dialysis patients. Nephrol Dial Transplant. — 2010. — Vol. 299(3).- Р. 545−558.
- 6. Roger T, Glauser MP, Calandra T. Macrophage migration inhibitory factor (MIF) modulates innate immune responses induced by endotoxin and Gram-negative bacteria // J Endotoxin — 2001. — Vol. 7(6). — Р. 456−460.
- 7. Шstergaard C, Benfield T. Macrophage migration inhibitory factor in cerebrospinal fluid from patients with central nervous system infection // Crit Care. — - Vol.13 (3). — Р.101−112.
- 8. Гасымов Э.K., Кулиева Н.T., Алиев Г. M. Морфологические основы участия артериол в формировании острого эндоневрального отека // Доклады НАНА, — Т. LXVI. — № 1. — С. 119−129.
- 9. Vandenbroucke E, Mehta D, Minshall R, Malik AB. Regulation of endothelial junctional permeability. Ann N Y Acad Sci. 2008 Mar; 1123. — Р.134−145.
- 10. Ширинский В. П. Роль киназы легких цепей миозина в барьерной функции эндотелия и перспективы использования ее ингибиторов при нарушениях сосудистой проницаемости // Кардиологический вестник. — 2006. — Т. 1. — № 2. — С. 1-
- 11. Wadgaonkar R, Somnay K, Garcia JG. Thrombin induced secretion of macrophage migration inhibitory factor (MIF) and its effect on nuclear signaling in // J Cell Biochem, 2008 Dec 1. — Vol. 105 (5).- Р.1279−1288.
- 12. Bruewer M, Luegering A, Kucharzik T et Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms // J Immunol. — 2003 Dec 1. — Vol.171 (11). — Р. 6164−6172.
- 13. Leithдuser B, Fassbender M, Eickhoff M et al. The direct thrombin inhibitor melagatran counteracts endotoxin-induced endothelial leukocyte adherence and microvascular leakage in the rat Rationale for the treatment of inflammatory disorders beyond sepsis? Clin Hemorheol Microcirc. — 2007. -Vol. 36 (4). — Р. 277−289.
- 14. Zhang G, Han J, Welch EJ et Lipopolysaccharide stimulates platelet secretion and potentiates platelet aggregation via TLR4/MyD88 and the cGMP-dependent protein kinase pathway // J Immunol. — 2009 Jun 15. Vol. 182 (12). — Р. 7997−8004.
- 15. Chuang YC, Lei HY, Liu HS et Macrophage migration inhibitory factor induced by dengue virus infection increases vascular permeability // Cytokine. — 2011. — Vol. 54(2). — Р. 222−231.
- 16. Lolis E. Glucocorticoid counter regulation: Macrophage migration inhibitory factor as a target for drug discovery. Curr Opin Pharmacol. — 2001. — Vol.1. — Р.662−668.
- 17. Calandra T, Roger Macrophage migration inhibitory factor: A regulator of innate immunity. Nat RevImmunol. - 2003. -Vol. 3. — Р.791−800.
- 18. Bernhagen,, T. Calandra, R. A. Mitchell et al. MIF is a pituitary-derived cytokine that potentiates lethal endotoxaemia. Nature, 1993. — Vol. 365. — Р. 756−759.
- 19. Roger T, Froidevaux C, Martin C, Calandra T. Macrophage migration inhibitory factor (MIF) regulates host responses to endotoxin through modulation of Toll-like receptor 4 (TLR4) // J Endotoxin Res. — 2003. — 9 (2). — Р. 119−123.
Фамилия автора: Э. К. Гасымов, Н. Т. Кулиева, Г. М. Эйюбова, А. А. Алиярбекова.