Патогенетическая роль хронического бактериального простатита в формировании андрогенодефицита у пациентов фертильного возраста

Многообразие оказываемых эффектов цитокинов на клетки организма позволяет открывать новые горизонты в изучении последствий развития воспаления. Многими авторами исследовались возможные параллели между уровнями некоторых цитокинов и гормонов. В исследованиях, проводимых на культуре клеток Лейдига, выделенной у мышей и крыс, был подробно продемонстрирован механизм ингибирующего влияния ИЛ-1… Читать ещё >
Патогенетическая роль хронического бактериального простатита в формировании андрогенодефицита у пациентов фертильного возраста (реферат, курсовая, диплом, контрольная)
В последние годы всё больше внимание исследователей привлекает вероятная взаимосвязь между хроническим бактериальным простатитом (ХБП) и клинико-лабораторными характеристиками андрогенодефицита (АД) [1, 2]. Известно, что у человека при острых, хронических и аутоиммунных заболеваниях наблюдается низкий уровень тестостерона в крови [3, 4]. Поскольку в большинстве случаев при этих заболеваниях происходит активация макрофагов, предполагается, что медиаторы макрофагов могут непосредственно влиять на регуляцию функций клеток Лейдига.
В основе любого воспалительного процесса в организме лежит дисбаланс между синтезом провоспалительных и противовоспалительных цитокинов. Хронический бактериальный простатит не является исключением для реализации подобного патофизиологического сценария. Несмотря на неспецифичность тех или иных цитокинов по отношению к характеру воспалительного процесса, измерение их уровня позволяет определить активность воспалительного процесса, что необходимо для выбора наиболее адекватной лечебно-диагностической тактики у пациентов с хроническим простатитом.
Многообразие оказываемых эффектов цитокинов на клетки организма позволяет открывать новые горизонты в изучении последствий развития воспаления. Многими авторами исследовались возможные параллели между уровнями некоторых цитокинов и гормонов. В исследованиях, проводимых на культуре клеток Лейдига, выделенной у мышей и крыс, был подробно продемонстрирован механизм ингибирующего влияния ИЛ-1 и ФНО-альфа на стероидогенез. Показано, что введение ИЛ-1 в культуру клеток Лейдига приводит к ингибированию активности транспортного стероидного острого регуляторного белка (StAR), обеспечивающего митохондриальный транспорт холестерина. В результате подавляющей активности ключевого этапа стероидогенеза под воздействием ИЛ-1 происходит нарушение конверсии предшественников тестостерона, в частности, 22-гидроксихолестерола, в тестостерон [5]. Ряд исследователей полагает, что ИЛ-1 ингибирует активность фермента, расщепляющего боковую цепь холестерина (20, 22-десмолаза), который необходим для преобразования холестерина в прегненолон, что также приводит к нарушению синтеза тестостерона [6]. В исследовании Hales, проводимом на клетках Лейдига мышей, описано дозозависимое ингибирующее действие ИЛ-1 на циклический аденозинмонофосфат (цАМФ), обеспечивающий экспрессию 20,22-десмолазы, 17,20-десмолазы и 3-бетагидроксистероиддегидрогеназы, без которых биосинтез тестостерона подавляется [7].
В литературе имеется достаточное количество результатов исследований, подтверждающих ингибирующий эффект и ФНО-альфа на продукцию тестостерона клетками Лейдига в эксперименте. Так, в одной из работ выполнялись инъекции рекомбинантного ФНО-альфа 6 мужчинам для оценки его влияния на гипоталамо-гипофизарно-тестикулярную ось. В ходе исследования измерялись уровни гонадотропинов, общего тестостерона (Т общ.) и глобулина, связывающего половые гормоны (ГСПГ). В результате было зафиксировано снижение уровней гонадотропинов и общего тестостерона и сделан вывод о том, что ФНОальфа оказывает влияние на все уровни гипоталамо-гипофизарнотестикулярной оси [8]. Другое исследование на человеке проводилось с использованием ИЛ-2 для лечения метастатического рака. Известно, что ИЛ-2 вызывает повышенную выработку ФНО-альфа, с чем, по мнению учёных, и было связано статистически значимое снижение уровня общего тестостерона в крови после курса инъекций ИЛ-2 [9]. Демонстрируя механизм ингибирующего действия ФНО-альфа на секрецию тестостерона, большинство исследований показывает его влияние на снижение активности цАМФ, аналогичное таковому у ИЛ-1, что приводит к нарушению каскада трансформаций предшественников тестостерона в культуре клеток Лейдига мышей. Некоторые независимые исследования свидетельствуют о вовлечении сфингомиелинового пути под воздействием ФНО-альфа с последующим подавлением синтеза тестостерона [10,11]. Более поздние исследования, посвящённые влиянию ФНО-альфа на стероидогенез, говорят о действии через путь активации ядерного фактора каппаби, по-видимому, в ответ на активацию протеинкиназы C [12, 13].
Таким образом, результаты представленных исследований подтверждают факт о прямом ингибировании ИЛ-1 и ФНО-альфа экспрессии ферментов генов стероидогенеза и самого стероидогенеза, что способствует серьезным нарушениям функционирования репродуктивной системы, ассоциированным с хроническим воспалительным процессом [14].
Считается, что использование методик измерения уровней цитокинов более специфично при диагностике простатита, чем исследование уровней лейкоцитов в секрете предстательной железы или семенной жидкости [15]. Безусловно, реализация этих методик способна определять объективность лечебно-диагностических мероприятий у пациентов с различными видами хронического простатита. Известные данные о взаимосвязи концентрации уровней цитокинов и тестостерона создают предпосылки для изучения влияния хронического воспалительного процесса в предстательной железе на андрогенный статус пациентов. Имеющиеся исследования демонстрируют лишь наблюдаемую тенденцию к ассоциации ХБП и АД. Именно отсутствие убедительных данных о влиянии ХБП на супрессию показателей андрогенного статуса приводит к поиску возможных патогенетических механизмов, объясняющих ассоциацию ХБП и клинико-лабораторных проявлений АД.
Связь хронического воспалительного процесса в предстательной железе и дефицита тестостерона особенно актуальна у пациентов молодого, трудоспособного возраста из-за широкой распространённости хронического простатита у данной популяционной группы и очевидного негативного влияния обозначенных состояний на фертильность.
Целью данного исследования было патогенетическое обоснование роли ХБП в формировании андрогенодефицита у пациентов фертильного возраста. Основной задачей исследования явилось определение влияния ХБП на уровни провоспалительных цитокинов — ФНО-альфа, ИЛ-1-бета и противовоспалительного цитокина — ИЛ-4 в эякуляте у пациентов с андрогенодефицитом, а также оценка влияния уровней вышеуказанных цитокинов на андрогенный статус этих пациентов после лечения ХБП.
МАТЕРИАЛЫ И МЕТОДЫ простатит бактериальный андрогенодефицит Был обследован 41 пациент с хроническим бактериальным простатитом (средний возраст 26±3,9 лет). У всех пациентов осуществлялся сбор жалоб, анамнеза и проводился осмотр уролога. Пациентам с клинически установленным диагнозом проводилось дообследование, включавшее бактериологическое и микроскопическое исследование секрета предстательной железы, исследование гормонального профиля и измерение уровней прои противовоспалительных цитокинов в эякуляте.
Окраска мазков секрета предстательной железы осуществлялась по Романовскому-Гимзе, микроскопия проводилась при помощи микроскопа AxiostarPlusZeiss х1000. Для изучения андрогенного профиля у пациентов методом хемолюминесцентного анализа исследовался уровень общего тестостерона и глобулина, связывающего половые гормоны сыворотки крови, а в последующем рассчитывался уровень биологически доступного тестостерона (БДТ) и свободного тестостерона (Т св.). Расчёт проводился при помощи номограммы для вычисления уровня свободного тестостерона (Vermeulen A, Verdonik L, Kaufman J.M.) [16], а БДТ рассчитывался при помощи калькулятора расчёта биодоступного тестостерона, разработанного в отделении гормонологии, University Hospital of Ghent, Бельгия и размещённого на сайте Международного общества по вопросам старения мужчин — http://www.issam.ch/freetesto.htm.
Исследование уровня про (ИЛ1-бета и ФНО-альфа) и противовоспалительного (ИЛ-4) цитокинов проводилось в эякуляте иммуноферментным методом с использованием коммерческих тест-систем «Протеиновый контур» (г. Санкт-Петербург) и «DGR Internarional inc.» (Германия).
В ходе исследования пациенты были распределены на две группы. Первую группу составили 17 пациентов (средний возраст 27,3±4,2 года). Критерием для включения пациентов в группу было снижение уровня Т общ. ниже 12 нмоль/л.
Количество пациентов второй группы составило 24 человека, средний возраст — 27,4±3,8 года. Критерием включения пациентов в данную группу было отсутствие лабораторных признаков андрогенодефицита.
Наряду с клинико-лабораторными данными учитывались анамнестические данные, а именно — длительность заболевания у каждого пациента.
Для проведения сравнительного анализа была выделена группа контроля, в которую входили здоровые мужчины, сопоставимые по возрасту с пациентами групп исследования, средний возраст составил 27,1±5 года.
Всем пациентам назначалась антибактериальная терапия, соответствующая рекомендациям Европейской ассоциации урологов, заключающаяся в назначении левофлоксацина по 500 мг е/д курсом на 28 дней. В случае резистентности флоры секрета ПЖ к фторхинолонам, применялся препарат в соответствии с результатами антибиотикограммы. Помимо антибактериальной терапии проводился курс дренирующих предстательную железу процедур.
РЕЗУЛЬТАТЫ
Сравнивая полученные данные в группах пациентов, сопоставимых по возрасту, было отмечено статистически значимое различие в ряде показателей, характеризующих особенности течения воспалительного процесса, а также статистически значимое различие между характеристиками андрогенного статуса.
Следует отметить, что в отличие от пациентов I группы, у пациентов II группы анамнез заболевания был значительно короче, составив 4,5 месяца против 1,5 лет. При этом пациенты не занимались самолечением, а обратились к врачу практически сразу после появления первых симптомов, то есть на пике обострения.
Уровень ИЛ-1-бета преобладал в количественном отношении у пациентов II группы с хроническим бактериальным простатитом без лабораторных признаков андрогенодефицита, составив 166,8±33,6 пг/мл против 121,2±24,6 пг/мл (р? 0,01) у пациентов с сочетанием ХБП и андрогенодефицита (табл.1). Аналогичная тенденция наблюдалась и с ФНО-альфа, уровень которого был максимальным среди всех пациентов во II группе, составляя 80,6±29,2 пг/мл против 64±23,4 пг/мл (р? 0,01) у пациентов I группы. Средняя концентрация как ИЛ-1-бета, так и ФНО-альфа была значительно ниже у пациентов группы контроля, составив 21,8±3,5 и 26±4,7 пг/мл (р? 0,01) соответственно.
Таким образом, у пациентов с хроническим бактериальным простатитом наблюдалось превалирование концентраций провоспалительных цитокинов по сравнению со здоровыми мужчинами из группы контроля. Это позволяет сделать вывод о связи между повышенным количеством лейкоцитов в секрете предстательной железы и повышением провоспалительных цитокинов в эякуляте и, соответственно, о наличии воспалительного процесса в предстательной железе. При этом у пациентов I группы с длительным анамнезом заболевания, клинически характеризующимся сменой рецидивов и ремиссий, уровень провоспалительных цитокинов был достоверно ниже (р? 0,01), чем у пациентов II группы, где ХБП носит характер краткосрочного обострения.
Наряду с повышенными концентрациями провоспалительных цитокинов в исследуемых группах отмечается повышение концентрации ИЛ-4, относящегося к противовоспалительным цитокинам. Однако его уровень в группе контроля остался достоверно ниже (р? 0,01), составив 28,7±4,8 пг/мл против 94,9±33 и 72,6±25,7 пг/мл в I и II группе соответственно.
Известно, что соотношение про-и противовоспалительных цитокинов характеризует активность воспалительного процесса [17]. В наших исследованиях уровень ИЛ-4 был достоверно выше, а уровень ИЛ-1-бета и ФНО-альфа достоверно ниже в I группе, чем во II группе (р? 0,01). Характер изменений уровней прои противовоспалительных цитокинов у пациентов с ХБП свидетельствует о длительном и рецидивирующем характере заболевания.
Исследования, посвященные изучению роли цитокинов в патогенезе хронического простатита, демонстрируют связь между повышением уровней ИЛ-1-бета, ФНО-альфа и возникновением болевого синдрома, однако, вместе с тем показывают отсутствие корреляции между колебаниями цитокинов и выраженностью симптомов нижних мочевых путей [15]. То есть у пациентов с длительным анамнезом заболевания, имеющего рецидивирующий характер, многократные периоды обострения сопровождаются повышением концентраций ИЛ-1-бета и ФНОальфа.
Таблица 1. Сравнение уровней цитокинов и показателей андрогенного статуса у пациентов с ХБП, с сочетанием ХБП и АД и у мужчин контрольной группы.
Признаки. | I группа (n=17). | II группа (n=24). | III группа (n=12). | |
Возраст (лет). | 27,3±4,2. | 27,4±3,8. | 27,1±5. | |
ИЛ-1-бета (пг/мл). | 121,2±24,6. | 166,8±33,6. | 21,8±3,5. | |
р? 0,01. | ||||
ФНО-альфа (пг/мл). | 64±23,4. | 80,6±29,2. | 26±4,7. | |
р? 0,01. | ||||
ИЛ-4 (пг/мл). | 94,9±33. | 72,6±25,7. | 28,7±4,8. | |
р? 0,01. | ||||
Тобщ. (нмоль/л). | 10,1±1,9. | 15,5±4,5. | 20±4,2. | |
р? 0,01. | ||||
Тсв. (пг/мл). | 67,3±17,7. | 124±35,7. | 170,8±40,4. | |
р? 0,01. | ||||
БДТ (%). | 52,1±7,8. | 64,7±4,6. | 65,8±4,8. | |
р? 0,01. | ||||
Лейкоциты в секрете ПЖ (ед. в п/зр). | 29,4±12,6. | 32,9±17,9. | ; | |
Сравнительный анализ показателей андрогенного профиля у пациентов I и II групп показал более высокие уровни Т общ., Т св. и БДТ у пациентов II группы: Т общ. — 15,5±4,5 нмоль/л., Т св. — 124±35,7 пг/мл., БДТ — 64,7±4,6%. В тоже время аналогичные показатели андрогенного профиля у пациентов контрольной группы были достоверно выше, чем у пациентов II группы (р? 0,01).
Таким образом, у пациентов с хроническим бактериальным простатитом отмечается снижение всех исследуемых показателей андрогенного профиля. При этом у пациентов I группы с длительным анамнезом ХБП уровень фракций тестостерона был достоверно ниже, чем у пациентов II группы.
После проведения курса лечения выполнялось повторное исследование уровня цитокинов в эякуляте, осуществлялся контроль бактериологической и микроскопической картины секрета предстательной железы, а также мониторинг андрогенного профиля у пациентов обеих групп. В этом случае, контрольные анализы секрета предстательной железы продемонстрировали эрадикацию бактериального агента у всех пациентов в исследуемых группах, либо снижение его концентрации до клинически незначимых значений — менее 103 КОЕ/мл.
Нормализация количества лейкоцитов в секрете предстательной железы наблюдалось также у пациентов обеих групп, после лечения составив у пациентов I группы — 3,7±1,9 в п/зр., у пациентов II группы — 5,2±1,6 в п/зр (р? 0,01). Таким образом, лечение позволило добиться ликвидации как клинических, так и лабораторных критериев заболевания.
Исследование цитокинового профиля эякулята показало изменение соотношения прои противовоспалительных цитокинов. Отмечено статистически значимое снижение ИЛ-1-бета и ФНО-альфа в обеих группах исследования (р? 0,01). ИЛ1-бета после лечения у пациентов I группы составил 57,7±11,7 пг/мл, у пациентов II группы — 50,5±10,2 пг/мл. ФНО-альфа составил у пациентов I группы — 46,2±9,3 пг/мл, а у паци-ентов II группы — 55,6±20,2 пг/мл (табл. 2).
Наряду с купированием воспалительного процесса в ПЖ, что подтверждается как уменьшением количества лейкоцитов в секрете ПЖ, так и снижением концентраций провоспалительных цитокинов в эякуляте, отмечалось снижение уровня ИЛ-4, составившего у пациентов I группы после лечения 35±8,3 пг/мл, а у пациентов II группы — 45,4±16 пг/мл (р? 0,01).
Наблюдение за параметрами андрогенного статуса также показало ряд изменений. У пациентов I группы с андрогенодефицитом в среднем произошло статистически значимое повышение уровня Т общ., нормализовавшегося после лечения и составившего 16,6±5,7 нмоль/л (р? 0,01). Отмечено некоторое повышение уровня Т общ. и у пациентов II группы, у которых этот показатель в среднем после лечения составил 17,8±4 нмоль/л (р? 0,05).
Помимо изменений уровня Т общ. зафиксировано повышение и прочих фракций тестостерона. Так Т св. после лечения составил у пациентов II группы 116,5±37,8 пг/мл, а у пациентов II группы — 137,4±33,6 пг/мл. Доля БДТ в I группе составила 58,6±11%, а во II — 63,2±6,3%.
Сравнительный анализ показателей, полученных до и после лечения у пациентов I и II групп, демонстрирует статистически значимое уменьшение концентраций как про, так и противовоспалительных цитокинов у пациентов обеих групп: в I группе выявлено снижение ИЛ1бета со 121,2±24,6 до 57,7±11,7 пг/мл, ФНО-альфа с 64±23,4 до 46,2±9,3 пг/л, ИЛ-4 — с 94,9±33 до 35±8,3 пг/мл; во II группе — ИЛ-1-бета со 166,8±33,6 до 50,5±10,2 пг/мл, ФНО-альфа — с 80,6±29,2 до 55,6±20,2 пг/мл, ИЛ-4 — с 72,6±25,7 до 45,4±16 пг/мл.
Уменьшение концентраций исследуемых цитокинов в эякуляте сопровождалось статистически значимым уменьшением количества лейкоцитов в секрете предстательной железы в обеих группах: в I группе с 29,4±12,6 до 3,7±1,9 в п/зр, во II группе — с 32,9±17,9 до 5,2±1,6 в п/зр, а также купированием симптомов ХБП.
Таблица 2. Сравнение уровней цитокинов и показателей андрогенного статуса у пациентов с ХБП, сочетанием ХБП и АД до и после лечения.
Признаки. | I группа (n=17). | II группа (n=24). | Контроль (n=12). | |||
До лечения. | После лечения. | До лечения. | После лечения. | |||
Возраст. | 27,3±4,2. | 27,4±3,8. | 27,1±5. | |||
ИЛ-1-бета (пг/мл). | 121,2±24,6. | 57,7±11,7. | 166,8±33,6. | 50,5±10,2. | 21,8±3,5. | |
р? 0,01. | р? 0,01. | |||||
ФНО-альфа (пг/мл). | 64±23,4. | 46,2±9,3. | 80,6±29,2. | 55,6±20,2. | 26±4,7. | |
р? 0,01. | р? 0,01. | |||||
ИЛ-4 (пг/мл). | 94,9±33. | 35±8,3. | 72,6±25,7. | 45,4±16. | 28,7±4,8. | |
р? 0,01. | р? 0,01. | |||||
Тобщ. (нмоль/л). | 10,1±1,9. | 16,6±5,7. | 15,5±4,5. | 17,8±4. | 20±4,2. | |
р? 0,01. | р? 0,05. | |||||
Тсв. (пг/мл). | 67,3±17,7. | 116,5±37,8. | 124±35,7. | 137,4±33,6. | 170,8±40,4. | |
р? 0,01. | р? 0,05. | |||||
БДТ (%). | 52,1±7,8. | 58,6±11. | 64,7±4,6. | 63,2±6,3. | 65,8±4,8. | |
р? 0,01. | р? 0,05. | |||||
Лейкоциты в секрете ПЖ (ед. в п/зр). | 29,4±12,6. | 3,7±1,9. | 32,9±17,9. | 5,2±1,6. | ; | |
р? 0,01. | р? 0,01. | |||||
Таким образом, сочетание повышенного количества лейкоцитов в секрете предстательной железы и высокие уровни ИЛ-1-бета и ФНОальфа в эякуляте может рассматриваться как свидетельство наличия активного воспалительного процесса в предстательной железе. В этом случае изменение уровня лейкоцитов в соке ПЖ может достоверно отражать характер течения воспалительного процесса.
Наряду с уменьшением уровней цитокинов в эякуляте и лейкоцитов в секрете предстательной железы у пациентов обеих групп после лечения отмечалось статистически значимое повышение уровня общего тестостерона и его фракций (рис. 1, 2). Так уровень Т общ. у пациентов I группы достоверно повысился с 10,1±1,9 до 16,6±5,7 нмоль/л (р? 0,01), у пациентов II группы — с 15,5±4,5 до 17,8±4 нмоль/л (р? 0,05). Повышение концентрации общего тестостерона сопровождалось повышением Т св. и БДТ. У пациентов I группы Т св. повысился с 67,3±17,7 до 116,5±37,8 пг/мл, у пациентов II группы повышение не было статистически достоверным, однако, наблюдалась тенденция к повышению со 124±35,7 до 137,4±33,6 пг/мл (р? 0,05). Повышение БДТ зафиксировано с 52,1±7,8% до 58,6±11% у пациентов I группы, а у пациентов II группы было отмечено незначительное уменьшение БДТ с 64,7±4,6% до 63,2±6,3%, что не было статистически значимым (р? 0,05), и показатель находился в пределах нормальных значений. Следовательно, уменьшение концентрации цитокинов в эякуляте, уменьшение количества лейкоцитов в секрете ПЖ коррелировало с повышением показателей андрогенного профиля, а у пациентов I группы отмечена даже нормализация уровня Т общ.
ОБСУЖДЕНИЕ
Из результатов проведённого сравнительного анализа следует вывод о том, что у пациентов I группы с длительным рецидивирующим течением ХБП, чередующимся периодами ремиссии и обострения наблюдаются более глубокие изменения андрогенной составляющей гормонального профиля. Снижение уровня Т общ. и доли БДТ ниже нормативных значений сопровождается повышением цитокинов острой фазы воспаления — ИЛ-1-бета и ФНО-альфа, которые в свою очередь оказывают супрессивное влияние как на тестикулярный механизм выработки тестостерона, так и на гипоталамо-гипофизарнотестикулярный механизм регулирования его выработки.
Характерной особенностью, выявленной в результате анализа полученных данных, явилось отсутствие снижения ниже порогового значения Т общ. и БДТ у пациентов II группы, у которых наблюдалось статистически более выраженное повышение ИЛ-1-бета и ФНО-альфа. В ходе исследования установлено, что на выраженность гормональной супрессии влияет длительность течения воспалительного процесса. У пациентов I группы с длительностью заболевания 4,5 мес. наблюдалось достоверное повышение уровня ИЛ-4 по сравнению с пациентами II группы, длительность заболевания которых составляла 18 мес. Именно ИЛ-4 является ингибитором деятельности макрофагов, вырабатывающих ИЛ-1-бета и ФНО-альфа, таким образом, оказывая противовоспалительное действие. И повышение ИЛ-4 рассматривается как результат хронического воспалительного процесса. Как известно, хроническое воспаление характеризуется эпизодами обострения и ремиссии, что и наблюдается у пациентов I группы. Каждое обострение сопровождается повышением концентрации ИЛ-1-бета и ФНО-альфа в семенной жидкости и в органах репродуктивного тракта, приводя к ингибированию тестикулярной активности. Многократно повторяющиеся обострения, характерные для ХБП, приводят к более значимому снижению уровней андрогенов, наблюдаемому у пациентов I группы.
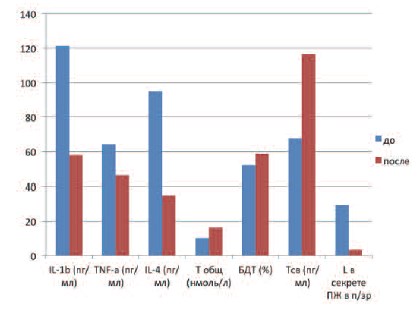
Рис. 1. Изменение уровней цитокинов и показателей андрогенного статуса у пациентов I группы с сочетанием ХБП и АД после лечения
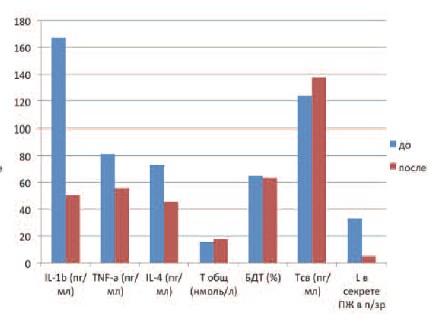
Рис. 2. Изменение уровней цитокинов и показателей андрогенного статуса у пациентов II группы с ХБП после лечения
ЗАКЛЮЧЕНИЕ
У пациентов с сочетанием ХБП и АД достоверно выше уровень ИЛ-4 в эякуляте, чем у пациентов с ХБП и у пациентов контрольной группы, что свидетельствует о длительном течении заболевания, соответствуя анамнестическим данным. Лечение ХБП сопровождается уменьшением концентраций как про, так и противовоспалительных цитокинов в эякуляте, коррелируя с повышением уровня Т общ. и Т св. у всех пациентов и с уменьшением количества лейкоцитов в секрете ПЖ.
Таким образом, в основе механизма формирования АД при ХБП у пациентов фертильного возраста лежит гиперпродукция провоспалительных цитокинов, воздействию которой больше подвержены пациенты с длительным анамнезом заболевания.
- 1. Коган М. И., Ибишев Х. С., Ферзаули А. Х. Хронический бактериальный простатит и биохимический андрогенный дефицит // Материалы пленума правления российского общества урологов. Кисловодск. 2011. С. 326.
- 2. Тюзиков И. А., Калинченко С. Ю., Ворслов Л. О., Греков Е. А. Коррекция андрогенного дефицита при хроническом инфекционном простатите как патогенетический метод преодоления неэффективности стандартной антибактериальной терапии на фоне растущей антибиотикорезистентности // Андрология и генитальная хирургия. 2013. № 1. С. 55.
- 3. Cutolo M, Balleari E, Giusti M, Intra E, Accardo S. Sex hormone status of male patients with rheumatoid arthritis: evidence of low testosterone at baseline and after hu-man chorionic gonadotropin stimulation. // Arthritis Rheum. 1988. Vol. 31. N 10. P. 1314−1317.
- 4. Handelsman DJ, Spaliviero JA, Turtle JR. Testicular function in experimental uremia. // Endocrinology. 1985. Vol. 117. N 5. P. 1974;1983.
- 5. Mauduit C, Chauvin MA, Hartmann DJ. Interleukin-1a as a potent inhibitor of gonad-otropin action in porcine Leydig cells: site (s) of action. // Biol Reprod. 1992. Vol. 46. P. 1119−1126.
- 6. Lin T, Wang D, Stocco DM. Interleukin-1 inhibits Leydig cell steroidogenesis without affecting steroidogenic acute regulatory protein messenger ribonucleic acid or protein levels. // J Endocrinol. 1998. Vol. 156. N 3. P. 461−467.
- 7. Hales DB. Interleukin-1 inhibits Leydig cell steroidogenesis primarily by decreasing 17б-hydroxylase/C17−20 lyase cytochrome P450 expression. // Endocrinology 1992. Vol. 131. P. 2165−2172.
- 8. Van der Poll T, Romijn JA, Endert E, Sauerwein HP. Effects of tumor necrosis factor on the hypothalamic-pituitary-testicular axis in healthy men. // Metabolism. 1993. Vol. 42. N 3. P. 303−307.
- 9. Meikle AW, Cardoso de Sousa JC, Ward JH, Woodward M, Samlowski WE. Reduction of testosterone synthesis after high dose interleukin-2 therapy of metastatic cancer. // J Clin Endocrinol Metab. 1991. Vol. 73. N 5. P. 931−935.
- 10. Budnik LT, Jahner D, Mukhopadhyay AK. Inhibitory effects of TNFб on mouse tu-mor Leydig cells: possible role of ceramide in the mechanism of action. // Mol Cell Endocrinol. 1999. Vol. 150. P. 39−46.
- 11. Morales V, Santana P, Dнaz R, Tabraue C, Gallardo G, Lуpez Blanco F, Hernбndez I, Fanjul LF, Ruiz de Galarreta CM. Intratesticular delivery of tumor necrosis factor-б and ceramide directly abrogates steroidogenic acute regulatory protein expression and Leydig cell steroidogenesis in adult rats. // Endocrinology. 2003. Vol. 144. N 11. P. 4763−477
- 12. Hong CY, Park JH, Ahn RS, Im SY, Choi HS, Soh J, Mellon SH, Lee K. Molecular mechanism of suppression of testicular steroidogenesis by proinflammatory cytokine tumor necrosis factor б. // Mol Cell Biol. 2004. Vol. 24. N 7. P. 2593−2604.
- 13. Li X, Youngblood GL, Payne AH, Hales DB. Tumor necrosis factor-б inhibition of 17б-hydroxylase/C17−20 lyase gene (Cyp17) expression. // Endocrinology. 1995. Vol. 136. N 8. P. 3519−3526.
- 14. Payne AH, Hardy MP. The Leydig cell in health and disease 2007. Humana Press. P. 471.
- 15. Дорофеев С. Д., Кудрявцев Ю. В., Кудрявцева Л. В. Иммуногистохимические аспекты хронического абактериального простатита // Эффективная фармакотерапия 2014. № 2. С. 26−38.
- 16. Vermeulen A, Verdonik L, Kaufman JM. Critical evaluation of simple methods for the free testosterone in serum. // J Clin Endocrinol Metab. 1999. Vol. 84. P.3666 — 3672. 17. Jang TL. Schaeffer AJ. The role of cytokines in prostatitis. // World J Urol. 2003. Vol. 21. P. 95 — 99.