Витамин в12.
Лекарственные средства при макроцитарной анемии

При дефиците витамина В12 в клетках эритропоэза нарушается репликация ДНК, созревание ядра отстает от созревания цитоплазмы. Гемопоэз становится неэффективным, так как в циркулирующую кровь поступают мегалобластические эритроциты. Мегалобласты инфильтрируют бронхи, кишечник, влагалище. В крови эти клетки быстро подвергаются гемолизу вследствие недостаточной активности глутатионредуктазы и низкого… Читать ещё >
Витамин в12. Лекарственные средства при макроцитарной анемии (реферат, курсовая, диплом, контрольная)
Средняя суточная потребность в витамине В12 составляет 2−5 мкг, минимальная гигиеническая норма — 1 мкг. Витамин В12 образуется микрофлорой кишечника, поэтому он содержится в продуктах животного происхождения — мясе, печени (10 мкг/100 г). Меньшее количество витамина находится в молоке, сыре, яйцах, рыбе. Он отсутствует в растениях, за исключением бобовых, у которых образуется клубеньковыми бактериями. Вегетарианцы могут получать достаточное количество витамина В12, употребляя в пищу бобовые.
История изучения витамина В12 насчитывает более 180 лет и две Нобелевские премии.
В 1824 г. Томас Аддисон описал клинические признаки макроцитарной анемии, в 1872 г. Антон Бирмер предложил называть это заболевание прогрессирующей пернициозной анемией (от лат. perniciosus — «гибельный»). В 1925 г. Джордж Уипл установил, что в печени образуются стимуляторы эритропоэза. В 1934 г. Уипл, Джордж Майнот и Уильям Мерфи получили Нобелевскую премию за открытие лечебного эффекта сырой печени при макроцитарной анемии (требовалось съедать более 200 г/сут). Спустя несколько лет были получены экстракты печени, обладающие ее терапевтическим эффектом, — поливитамины (витогепат*) и сирепар. В 1929 г. Уильям Касл предсказал участие внутреннего фактора в механизме всасывания в кровь внешнего противоанемического фактора. В конце 1940;х гг. Риккс, Смит и Паркер идентифицировали внешний фактор Касла как витамин В12 и выделили его в кристаллической форме. Биохимик Дороти Кроуфут-Ходжкин установила химическую структуру и механизм действия витамина В12. За это исследование она в 1964 г. была удостоена Нобелевской премии по химии.
Известно, что в конце 1937 г. выдающийся английский драматург Джордж Бернард Шоу (1856−1950) заболел макроцитарной анемией. До этого в течение более 50 лет Шоу был строгим вегетарианцем. Он категорически возражал против лечения инъекциями печеночного экстракта. Друг и сосед Шоу, Сэн-Джон Эрвин, рассказывал: «Жена Шоу, Шарлотта, все уладила сама. Если печеночные инъекции необходимы для его выздоровления, значит, он будет делать их, несмотря на все свои вегетарианские убеждения. Шоу подчинился. Шарлотта стала бы делать уколы и насильно, если бы он вздумал сопротивляться». Шоу вскоре выздоровел и вернулся к творческой деятельности (Хьюз Э. Бернард Шоу. Серия биографий «Жизнь замечательных людей». — М.: Молодая гвардия, 1968).
Молекула витамина В12 состоит из хромофорной и нуклеотидной части. Хромоформая часть представляет собой порфирин с четырьмя восстановленными пиррольными кольцами и атомом кобальта, связанным с цианогруппой (цианокобаламин), гидроксилом (гидроксокобаламин), метилом (метилкобаламин) или дезоксиаденозилом (дезоксиадено-зилкобаламин). По химическому строению хромофор напоминает гем. Препараты витамина В12 нельзя вводить в одном шприце с тиамином (витамином В!*) и пиридоксином (витамином В6*), так как кобальт их разрушает. Кроме того, витамин В12 усиливает аллергизирующее влияние тиамина.
Фармакокинетика
В желудке и тонком кишечнике витамин В12 освобождается от белков пищи и присоединяет внутренний фактор Касла — гликопротеин с молекулярной массой 59 кДа. Внутренний фактор образуется в париетальных (обкладочных) клетках желез желудка. Биодоступность витамина В12 в комплексе с внутренним фактором достигает 80−90%, без него — снижается до 0−30%.
В тонком кишечнике комплекс витамина В12 с внутренним фактором Касла связывается с белковым рецептором на энтероцитах и пиноцитозом доставляется в кровь. Для всасывания необходимы затраты энергии, присутствие желчи, ионов кальция и нейтральная среда, создаваемая натрия гидрокарбонатом сока поджелудочной железы. При избытке в пище витамин В12 всасывается в кровь простой диффузией по градиенту концентрации.
Я-Глобулин крови транскобаламин II транспортирует витамин В12 в печень, костный мозг и селезенку. Известен наследственный дефицит транскобаламина II. Транскобаламины I и III, связывая витамин В12, выключают его из реакций метаболизма.
Около 90% количества витамина В12 (1−10 мг) находится в печени, ежедневно используется 0,5−8,0 мкг. Около 3 мкг витамина В12 каждый день секретируется с желчью в кишечник, из этого количества 50−60% повторно всасывается в кровь. При заболеваниях печени и кишечника энтерогепатическая циркуляция нарушается, что сопровождается развитием авитаминоза.
Нормальная концентрация витамина В12 в плазме крови составляет 200−900 пг/мл, при концентрации ниже 150 пг/мл возникают симптомы авитаминоза.
Механизм действия, применение, побочные эффекты
Коферментные формы витамина В12 обладают различным биологическим значением. Метилкобаламин (СН3В12) регулирует синтез ДНК и метионина, дезоксиаденозилкобаламин (дезоксиВ12) необходим для образования миелина нервной ткани (рис. 44−1).
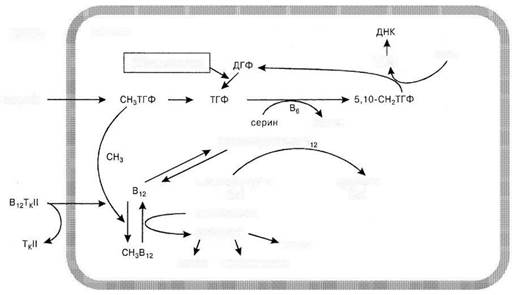
Рис. 44-1 Метаболическая роль витамина В12 и фолиевой кислоты. ДГФ — дигидрофолат; ТГФ — тетрагидрофолат; ТкМ — транскобаламин II; УМФ — дезоксиуридинмонофосфат; ТМФ — тимидинмонофосфат
В дальнейшем СН3В12 метилирует гомоцистеин с образованием метионина — универсального донатора метильных групп, участвующего в синтезе белка, фосфолипидов, бетаина и холина.
Освобожденный от метильной группы тетрагидрофолат (ТГФ) присоединяет метилен (-СН2) в виде мостика между 5-м и 10-м атомом азота, при этом образуется 5,10-метиленТГФ (5,10-СН2ТГФ). Донатор метилена — аминокислота серин — превращается в глицин в реакции, катализируемой витамином В6.
5,10-СН2ТГФ с помощью метиленовой группы трансформирует предшественник пиримидиновых оснований — дезоксиуридинмоно-фосфат в компонент ДНК — тимидинмонофосфат. После отдачи метилена 5,10-СН2ТГФ становится дигидрофолатом. Метаболический цикл завершается восстановлением дигидрофолата в ТГФ под влиянием дигидрофолатредуктазы.
При дефиците витамина В12 в клетках эритропоэза нарушается репликация ДНК, созревание ядра отстает от созревания цитоплазмы. Гемопоэз становится неэффективным, так как в циркулирующую кровь поступают мегалобластические эритроциты. Мегалобласты инфильтрируют бронхи, кишечник, влагалище. В крови эти клетки быстро подвергаются гемолизу вследствие недостаточной активности глутатионредуктазы и низкого содержания восстановленного глутатиона. При тяжелом авитаминозе развиваются лейкопения, тромбоцитопения и даже панцитопения.
Дезоксиаденозилкобаламин как кофактор мутазы участвует в изомеризации L-метилмалоновой кислоты в янтарную. Метилмалоновая кислота подавляет продукцию миелина. У детей с метилмалоновой ацидурией и гомоцистеинурией уменьшается способность клеток синтезировать акцепторы для витамина В12.
Наиболее частая причина гипои авитаминоза В12 — уменьшение количества внутреннего фактора Касла при различных патологических состояниях:
- • атрофии слизистой оболочки желудка у больных тяжелым хроническим гастритом, полипозом и сифилисом желудка;
- • резекции желудка;
- • продукции аутоантител к внутреннему фактору.
Авитаминоз развивается также при заболеваниях кишечника, панкреатите, заражении лентецом широким, дивертикулезе тонкого кишечника и синдроме слепой кишки (паразит и патогенные бактерии интенсивно потребляют витамин В12).
Симптомами авитаминоза В12 являются макроцитарная анемия и фуникулярный миелоз (демиелинизация, набухание и деструкция аксонов в коре головного мозга и боковых канатиках спинного мозга). У больных возникают парестезия, расстройства равновесия и координации движений, угнетены сухожильные рефлексы. При прогрессировании авитаминоза присоединяются параличи, амнезия, нарушения зрения центрального происхождения, галлюцинации, деменция, эпизоды потери сознания.
Для медицинских целей витамин В12 получают методом микробиологического синтеза. Препараты вводят парентерально. Прием цианокобаламина внутрь в составе поливитаминных средств показан только при его дефиците в пище.
Цианокобаламин и гидроксокобаламин вводят подкожно и внутримышечно, кобамамид — подкожно, внутримышечно и внутривенно. Гидроксокобаламин быстрее цианокобаламина превращается в коферментные формы, более прочно связывается с белками и длительнее находится в организме. Препарат дезоксиаденозилкобаламина кобамамид обладает анаболическим, гепатопротективным и липотропным влиянием.
Профилактическое применение цианокобаламина оправданно у строгих вегетарианцев, при резекции желудка, синдроме мальабсорбции. Инъекции необходимы 1 раз в месяц.
Для лечения макроцитарной анемии цианокобаламин вводят в больших дозах через день или ежедневно в течение 6−12 мес. Больные с неврологическими осложнениями, тромбоцитопенией, лейкопенией требуют немедленного введения эритроцитарной массы, цианокобаламина и фолиевой кислоты. При легких и среднетяжелых формах терапию можно отложить до постановки диагноза. Самочувствие улучшается через сутки, количество нормобластических эритроцитов (4,0−4,5 млн/мм3) восстанавливается спустя 10−20 сут, функции нервной системы нормализуются через много месяцев. Витаминотерапия уменьшает в крови уровень свободного железа за счет его включения в гемоглобин.
Лечение цианокобаламином неэффективно при дефиците железа в организме, инфекциях, воспалительных заболеваниях, опухолях, гипотиреозе, почечной недостаточности.
Препараты витамина В12 назначают при постгеморрагической железодефицитной и апластической анемии, диабетической нейропатии, невралгии тройничного и языкоглоточного нервов, радикулите, параличах, психических заболеваниях, гепатите и циррозе печени, в периоде выздоровления после тяжелой операции. У детей витаминотерапия показана при недоношенности, гипотрофии, болезни Дауна, церебральном параличе, метилмалоновой ацидурии. Кобамамид включают в комплексную терапию миокардиодистрофии и миокардита.
Гидроксокобаламин нашел применение в качестве антидота при отравлении цианидами, например, в случаях передозировки нитропруссида натрия. Механизм антидотного действия — замена гидроксила на цианогруппу, при этом гидроксокобаламин превращается в цианокобаламин (химический антагонизм).
Цианокобаламин хорошо переносится больными и лишь изредка вызывает побочные эффекты: рост количества эритроцитов, тромбоцитов, лейкоцитов, повышение свертывания крови, нервное возбуждение, тахикардию, боль в области сердца, аритмию (вследствие гипокалиемии), аллергические реакции.
Гидроксокобаламин меньше цианокобаламина увеличивает свертывание крови. В эксперименте установлена способность цианокобаламина стимулировать развитие опухолей и лейкоза. Гидроксокобаламин и кобамамид не обладают канцерогенными свойствами.
Препараты витамина В12 противопоказаны при тромбозах, тромбоэмболии, эритроцитозе, инфаркте миокарда, доброкачественных и злокачественных новообразованиях, оптической атрофии Лебера.