Муковисцидоз.
Муковисцидоз

Ген МВ был изолирован в 1989 г., он расположен в середине длинного плеча 7 аутосомы, содержит 27 экзонов и охватывает 250 000 пар нуклеотидов. Он контролирует структуру и функцию белка, названного МВТР — трансмембранный регулятор МВ. МВТР локализуется в апикальной части мембраны эпителиальных клеток, выстилающих выводные протоки желез внешней секреции (в бронхах, поджелудочной железе, кишечнике… Читать ещё >
Муковисцидоз. Муковисцидоз (реферат, курсовая, диплом, контрольная)
«Если при поцелуе ребенка ощущается соль, значит он скоро умрет».
Так писали в старых немецких книгах по медицине про детей больных муковисцидозом.
Муковисцидоз (МВ) (Cystic Fibrosis) — наиболее частая наследственная полиорганная патология, характеризующаяся выраженной генетической гетерогенностью и клиническим полиморфизмом. Это — моногенное заболевание, обусловленное мутацией гена МВТР (муковисцидозного трансмембранного регулятора проводимости), характеризующееся поражением экзокринных желез жизненно важных органов и имеющее обычно тяжелое течение и прогноз. 1].
Муковисцидоз является важной медико-социальной проблемой:
- · Ежегодно проводятся Европейские, Северо-Американские Конференции и Международные Конгрессы, посвященные этому вопросу;
- · Прогресс в изучении муковисцидоза дает толчок развитию как фундаментальных, так и прикладных наук медицины, фармакологических и биотехнологических направлений;
- · Раньше это была проблема педиатров, в настоящее время все большее число специалистов разного профиля вовлекается в ее решение. Если в 50-годах более 60% больных МВ умирало в возрасте до 1 года, то в настоящее время более 32% наблюдаемых в США больных МВ старше 18 лет. 13] Имеется 50% вероятность того, что пациенты достигшие возраста 40 лет, доживут до 53 лет, и 35% вероятность достижения ими 60-ти летнего возраста.
Муковисцидоз (МВ) в последние годы находит определенное решение в РФ не только в ранней диагностике, лечении, реабилитации, но и в научном, учебно-методическом и организационном аспектах. Среди медико-социальных аспектов МВ следует отметить: низкую среднюю продолжительность жизни; раннюю инвалидизацию; необходимость постоянного проведения лечебных и реабилитационных мероприятий; необходимость активного диспансерного наблюдения; проблемы ранней диагностики; полимедикаментозное лечение; дороговизну жизненно важных медикаментов; обязательность обучающих программ.
После выделения муковисцидоза в отдельную нозологическую категорию его относили к разряду «фатальных» или «летальных» заболеваний, так как средняя продолжительность жизни не превышала 5 лет. В наши дни, благодаря расширению знаний о МВ и разработке эффективных методов терапии, заболевание диагностируется намного раньше, а средняя продолжительность жизни больных в развитых странах увеличилась, так по данным регистра США она в 1969 году составляла 14 лет, в 1990 году — 28 лет, в 1996 году — 31 год, в 2001 году — 32 года, в 2009 — 38 лет. [1.].
Историческая справка
Еще в средние века в преданиях европейских народов упоминалось, что ребенок, при поцелуе которого ощущается соленый привкус, обречен на скорую смерть. Причиной тому считалось колдовство ведьм (факт упомянут в словаре шведско-немецкого языка J. X. Pfyffer, 1848). Впервые заболевание описано в 1936 году швейцарским педиатром Гвидо Фанкони и соавторами. Они наблюдали ребенка с кистофиброзом поджелудочной железы в сочетании с бронхоэктазами, имел место семейный характер заболевания. 5].
В 1938 г. Патологоанатом Дороти Андерсен описала кистозную дегенерацию поджелудочной железы в сочетании с легочной патологией у маленьких детей. Тогда возникло английское название болезни — Cystic fibrosis (кистозный фиброз). В 1946 г. Farber предложил термин «муковисцидоз» (от лат. mucus — слизь, viscus — вязкий), указывая на роль повышения вязкости экскрета, выделяемого экзокринными железами. Однако еще раньше, в старинных немецких сказаниях, указывалось, что если во время обряда крещения при поцелуе ребенка ощущается соленый привкус кожи — священник делал вывод, что ребенок обречен. [11].
- Ш 1905 г. — Т. Landsteiner впервые описал у 2 детей с мекониальной непроходимостью кистозные изменения поджелудочной железы и высказал мысль об их причинной взаимосвязи.
- Ш 1938 г. — D. Andersen. Первая монография по МВ, где эта патология впервые выделена в самостоятельную нозологическую единицу под названием «кистозный фиброз поджелудочной железы». 1944 г. — S. Farber. Предложен термин «муковисцидоз».
- Ш 1953 г. — Di Sant Agnese с сотрудниками открыли феномен повышенной концентрации электролитов в поте у больных МВ.
- Ш 1959 г. — L.E. Gibson и R.E. Cooke предложили «потовый тест» для диагностики МВ. 1979 г. — в Новой Зеландии внедрен тест на иммунореактивный трипсин (ИРТ).
- Ш 1981 г.- M.R. Knowles был предложен метод измерения разности назальных потенциалов (РНП).
- Ш 1983 г.- D.J.H.Brock и соавторы показали достоверное снижение активности гаммаглутамилтранспептидазы, аминопептидазы и щелочной фосфатазы в амниотической жидкости плодов с МВ.
- Ш 1988 г. — В. Н. Горбунова, В. С. Баранов. Первый случай пренатальной диагностики МВ в России (биохимический метод).
- Ш 1989 г.- L.-Ch. Tsui, F. Collins, J. Riordan. Открытие гена CFTR.
- Ш 1989 г.- В. Н. Горбунова, Т. Э. Иващенко, В. С. Баранов. Внедрение молекулярно — генетического метода пренатальной диагностики МВ в России. 2]
Эпидемиология
Частота МВ колеблется среди представителей европеоидов от 1:600 до 1:17 000 новорожденных. В РФ частота муковисцидоза составляет, по данным ГУ МГНЦ РАМН, 1:12 000 новорожденных.
Средняя продолжительность жизни больного МВ в Москве и Санкт-Петербурге — равняется 35,2 годам. [12].
Этиология
На сегодняшний день выделено 1939 мутаций гена — трансмембранного регулятора проводимости муковисцидоза (МВТР), ответственных за развитие симптомов МВ. Среди них наиболее часто встречаются в России следующие мутации: ДF508 (53,2%), CFTRdele2,3(21kb) (5,5%), N1303K (2,7%), 2184insA (2%), 2143delT (2%), W1282Х (1,8%), G542Х (1,7%), 3849+10kbCT (1,7%), R334W (0,8%), S1196Х (0,6%). [12].
![Мутация гена МВТР в середине длинного плеча 7 аутосомы [2].](/img/s/9/06/2344106_1.jpg)
Рис. 1 Мутация гена МВТР в середине длинного плеча 7 аутосомы [2]
Патогенез
Ген МВ был изолирован в 1989 г., он расположен в середине длинного плеча 7 аутосомы, содержит 27 экзонов и охватывает 250 000 пар нуклеотидов. Он контролирует структуру и функцию белка, названного МВТР — трансмембранный регулятор МВ. МВТР локализуется в апикальной части мембраны эпителиальных клеток, выстилающих выводные протоки желез внешней секреции (в бронхах, поджелудочной железе, кишечнике, урогенитальном тракте), он регулирует транспорт электролитов (главным образом хлора) между этими клетками и межклеточной жидкостью. Последние исследования показали, что МВТР является собственно хлоридным каналом. Мутации гена МВ нарушают не только транспорт, но и секрецию ионов хлора. При затруднении их прохождения через клеточную мембрану увеличивается реабсорбция натрия железистыми клетками, нарушается электрический потенциал просвета, что вызывает изменение электролитного состава и дегидратацию секрета желез внешней секреции. В результате выделяемый секрет становится чрезмерно густым и вязким. При этом страдают легкие, желудочно-кишечный тракт, печень, поджелудочная железа, мочеполовая система (табл 2). [12].
Таблица 2.
Патогенез МВ.
Органы и системы. | Патологические процессы. | Конечный результат. | |
Легкие. | Бронхообструкция, снижение толерантности к инфекции, колонизация дыхательных путей Pseudomonas aeruginosa (P.aeruginosa)и другими патологическими микроорганизмами, хроническое воспаление дыхательных путей бронхоэктазы, деструкция паренхимы легких. | Дыхательная недостаточность, легочная гипертензия, сердечная недостаточность. | |
Поджелудочная железа. | Обструкция протоков железы, появление кист, недостаточность поджелудочной железы (внутреннеи внешнесекретор-ная),. кишечная мальабсорбция. | Нарушение стула, снижение нутритивного статуса (у детей — отста-вание в развитии),. авитаминозы, выпадения прямой киш-ки, сахарный диабет. | |
Печень. | Холестаз, холелитиаз. | Цирроз печени. | |
Кишечник. | Увеличение вязкости/адгезивности каловых масс. | Кишечная непроходимость. | |
Репродуктивная система. (у мужчин). | Обструкция и последующая атрезия выносящих протоков яичек, азооспермия. | Бесплодие. | |
![Схема нарушения функции бронхолегочной системы у больных МВ[6].](/img/s/9/06/2344106_2.jpg)
Рис. 2 Схема нарушения функции бронхолегочной системы у больных МВ[6]
Классификация муковисцидоза по МКБ — 10.
Муковисцидоз по МКБ имеет общий код заболевания Е84. При этом его различные мутации и подвиды представлены следующей системой кодировки:
Е84.0 — это шифр легочного фиброзного кистоза, который в 90% случаев из ста проявляется у детей на первом-втором году жизни. Характерными симптомами данной формы муковисцидоза являются приступообразный кашель, при котором затруднено выведение мокроты. Иногда такой кашель может сопровождаться кровянистыми выделениями;
Е84.1 — обозначение кишечного фиброзного кистоза, также проявляемого в раннем возрасте. Так, у 70% маленьких пациентов наблюдаются в кишечнике небольшие кисты в большом количестве, вздутие живота, учащение дефекации, сухость во рту, повышение вязкости слюны и другие признаки;
Е84.8 — муковисцидоз по МКБ данной формы предполагает другие проявления, которые чаще всего нетипичны при кишечном или легочном кистозе. В частности, данная форма обуславливает влияние заболевания на репродуктивную функцию, которая угнетается из-за обструктивной азооспермии, непроходимости семявыводящих каналов и придатков яичек;
Е84.9 обозначает, что у пациента диагностируется муковисцидоз неуточненный. Такая форма болезни характеризуется нарушением обмена веществ, что в свою очередь тянет за собой развитие массы более серьезных недугов со стороны ЖКТ, эндокринной системы и т. д. 4].
Клиническая классификация
Рабочая классификация муковисцидоза была предложена профессорами Рачинским С. В. и Капрановым Н. И. (2000 г.).
I. Формы муковисцидоза
- Ш Смешанная (легочно-кишечная) с поражением желудочно-кишечного тракта и бронхолегочной системы (в 75−80% случаев).
- Ш Легочная (в 15−20% случаев).
- Ш Кишечная (в 5% случаев).
II. Фаза и активность процесса
- Ш Фаза ремиссии
- — активность малая
- — средняя.
- Ш Фаза обострения
- — бронхит;
- — пневмония.
- Ш Основные осложнения МВ: ателектазы, абсцессы, пневмои пиопневмоторакс, «легочное сердце», кровохарканье, кровотечение легочное, кровотечение желудочное, гайморит, отечный синдром, цирроз печени, выпадение прямой кишки, отставание в физическом развитии, гиперреактивность бронхов, сахарный диабет и др.
- Ш В настоящее время выделяют еще несколько более редких форм муковисцидоза: сольтеряющая форма (псевдо-Барттера) синдром); атипичный муковисцидоз; неонатальная гипертрипсиногенемия.
Критерии обострения [12].
Таблица 3.
| |
Клиническая картина [11].
Таблица 4.
Клинические проявления, характерные для МВ.
Высокоспецифичные для МВ. | Менее специфичные для МВ. | |
Желудочно-кишечные:
| Желудочно-кишечные:
| |
Со стороны дыхательных путей:
| Со стороны дыхательных путей:
| |
Другое:
| Другое:
| |
В таблице 5 представлены особенности проявлений МВ в разные возрастные периоды. Знание этих особенностей помогает специалистам, наблюдающим пациента с теми или иными симптомами, включить МВ в перечень заболеваний для дифференциальной диагностики. Особенно это касается детей раннего возраста, когда клиническая картина еще может быть неполной, но на себя будут обращать внимание некоторые проявления, например мекониальный илеус при рождении или синдром потери солей, не имеющий связи с патологией почек. Диагноз в этом случае может быть установлен еще до рождения ребенка. В то же время этот признак не является высоко специфичным для МВ, может быть транзиторным явлением, а также связанным с другими патологическими состояниями.
Таблица 5.
Клинические особенности проявлений МВ в различные возрастные периоды [11,12].
0−2 года. | ||
|
| |
3−16 лет. | ||
|
| |
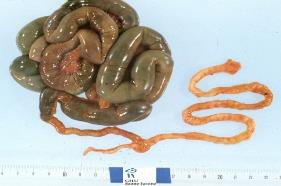
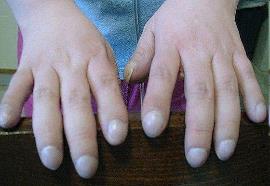
Рис. 3 мекониальный илеус Рис. 4 симптом «барабанных палочек»
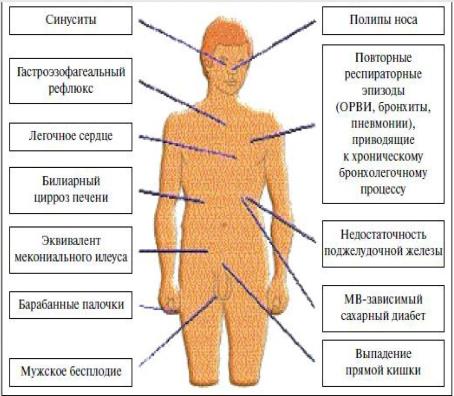
Основные клинически проявления муковисцидоза рис. 5.
Известные люди, больные муковисцидозом.
Британская поп-певица Элис Мартино родилась с генетическим заболеванием муковисцидоза. Несмотря на сильное ухудшение здоровья в начале 2000;х Мартино активно работала, давала концерты. В 2002 году она сообщила британской газете The Daily Telegraph, что ждёт тройной трансплантации (сердца, печени и лёгкого). 30-летняя Элис Мартино скончалась утром 6 марта 2003 года в своём доме, так и не дождавшись тройной трансплантации, которую ждала полтора года. Документальный фильм о певице «9 жизней Элис Мартино» был снят за несколько месяцев до её смерти и вышел на BBC вскоре после её кончины.
Канадской спортсменке Лизе Бентли диагноз муковисцидоз был поставлен в 1988 году. В тот день, когда она узнала об этом, Лиза решила взять себя в руки и показать всем, на что она способна. Лиза была полна решимости начать здоровую и успешную карьеру в спорте. Интенсивные тренировки (от 25 до 30 часов в неделю) дали результат — Лиза стала победительницей одиннадцати соревнований по триатлону, которые включают в себя плавание В каждом интервью Лиза утверждает, что самое главное при любой болезни — никогда не сдаваться".
Существует мнение ученых, что Фредерик Шопен мог умереть от муковисцидоза. Польские ученые добиваются разрешения на исследование тканей сердца Фредерика Шопена, которое в настоящее время хранится в варшавском костеле. Генетический анализ поможет уточнить причину смерти великого композитора: многие данные указывают на то, что он страдал тяжелым наследственным заболеванием — муковисцидозом. Шопен умер в возрасте 39 лет во Франции.
Диагностика.
Опорно — диагностические признаки [12]:
- 1. Семейный (генеалогический) анамнез
- 2. Начало заболевания в раннем возрасте
- 3. Прогрессирующее течение
- 4. Характерное поражение бронхолегочной и пищеварительной системы
- 5. Бесплодие или снижение фертильности
Пренатальная диагностика муковисцидоза:
Известно, что для аутосомно-рецессивных заболеваний риск рождения больного ребенка составляет 25% при каждой беременности. Если в семье был случай рождения ребенка, больного МВ, то еще до планирования следующей беременности необходимо проконсультироваться у врача — генетика.
При выявлении мутаций у обоих родителей и в гомозиготном состоянии у больного ребенка семья является полностью информативной. В этом случае, пренатальная диагностика проводится молекулярно-генетическим методом. Образцы ДНК плода для анализа выделяют, как правило, из биоптата ворсин хориона (на сроке 9−14 нед.). В случае невозможности проведения диагностики на этом сроке (позднее обращение семьи и.т.д.), возможно выделение ДНК плода из амниотической жидкости (на сроке 16−21 нед.) или крови плода, полученной путем кордоцентеза (после 21 нед.). Однако, с точки зрения безопасности прерывания беременности, оптимально проводить анализ на самом раннем сроке (9−10 нед.).
При выявлении мутации только у одного из родителей также рекомендуется пренатальная молекулярно-генетическая диагностика. Если у плода обнаруживается та же мутация, возникает необходимость дифференциальной диагностики между гетерозиготным бессимптомным носительством и гомозиготной инактивацией гена CFTR. Для этого проводится биохимическое исследование активности гамма-глютамилтранспептидазы, аминопептидазы и кишечной формы щелочной фосфотазы в амниотической жидкости (17−18 неделя беременности). Если у плода присутствует МВ, то активность перечисленных кишечных ферментов снижена, поскольку слизистые пробки препятствуют выделению содержимого кишечника плода в амниотическую жидкость.
Если в семье, где больной МВ ребенок уже умер, а мутации гена CFTR выявить не удается, семья считается неинформативной для пренатальной молекулярно-генетической диагностики. В таких семьях обследование плода выполняется биохимическими методами. Схема пренатальной диагностики МВ представлена на рисунке 8.
Отметим, что первая пренатальная диагностика МВ России была проведена в лаборатории пренатальной диагностики Института акушерства и гинекологи им. Д. О. Отта РАМН. Эта лаборатория до настоящего времени является ведущей в стране по разработке молекулярно — генетической и биохимической диагностики МВ. 20 [2].
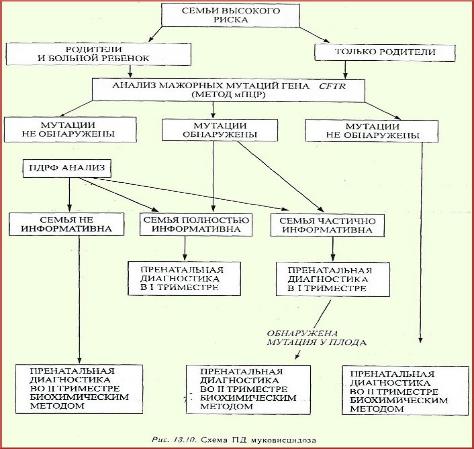
Рис. 8 Cхема пренатальной диагностики МВ (Т.Э Иващенко, В. С. Баранов, 2002)
Основные лабораторные методы диагностики МВ
1. Неонатальный скрининг:
С 2006 г. в ряде регионов, а с первого января 2007 г. во всех субъектах Российской Федерации (РФ) МВ был включен в перечень наследственных заболеваний, подлежащих обязательному неонатальному скринингу в рамках национального приоритетного проекта «Здоровье». [6].
На первом этапе в высушенном пятне крови оценивают содержание иммунореактивного трипсина (ИРТ). Образцы с повышенным содержанием ИРТ направляют на ДНК-типирование с целью обнаружения мутаций в гене МВТР. При выявлении 1 или 2 мутаций результаты скрининга считаются положительными и, больной направляется в Центр муковисцидоза для верификации диагноза. Если мутации не выявлены, а содержание ИРТ в крови высокое, проводят потовую пробу. Позитивный потовый тест у таких лиц так же расценивают как положительный результат скрининга, и больные направляются в Центр муковисцидоза. Протокол скрининга на МВ в России включает 4 этапа: ИРТ, повторный ИРТ, потовый тест и ДНК-диагностику, при этом только первые три являются обязательными. (табл. 6) [12].
Таблица 6.
Этапы неонатального скрининга в РФ.
I ЭТАП. | На 3−4 день у доношенного (7−8 — у недоношенного) определение ИРТ 1 в высушенной капле крови. | |
II ЭТАП. | При положительном результате (более 70 нг/мл) на 21−28 день — повторный тест — ИРТ 2. | |
III ЭТАП. | При положительном результате ИРТ 2 (более 40 нг/мл) — потовая проба. | |
IV ЭТАП. | При пограничном результате потовой пробы — ДНК-диагностика. | |
«Потовый тест».
Стандартная методика (метод по Гибсону-Куку) предусматривает использование ионофореза пилокарпина: с помощью слабого электрического тока препарат вводится в кожу и стимулирует потовые железы. Собранный пот взвешивается, затем определяют концентрацию ионов натрия и хлора. Для выполнения теста необходимо собрать минимум 100 мг пота. В настоящее время используют потовые анализаторы, например, «Макродакт», что упрощает метод. У здоровых детей концентрации натрия и хлора в секрете потовых желез не превышают 40 ммоль/л. В таблице 7 приведены состояния, которые влияют на уровень хлоридов пота. 14].
Таблица7.
Состояния, при которых потовая проба может быть ложноположительной или ложноотрицательной.
Ложноположительный потовый тест. | Ложноотрицательный потовый тест. | |
· Адреногенитальный синдром. | · Безбелковые отеки. | |
· ВИЧ-инфекция. | · Лечение антибиотиками (Клоксациллин). | |
· Гипогаммаглобулинемия. | ||
· Гипотиреоз. | ||
| ||
ДНК-диагностика Поскольку объектом исследования является непосредственно ДНК, то материалом для анализа могут быть любые клетки, из которых можно выделить ДНК, и диагностика может проводиться на любой стадии онтогенеза. Рутинно для исследования используют:
Образцы жидкой крови. Для проведения анализа достаточно 1 мл жидкой крови, взятой в пробирку с антикоагулянтом (ЭДТА или цитрат натрия). Использование гепарина недопустимо! При комнатной температуре кровь остается пригодной для проведения исследования в течение недели, при температуре — 20 С — несколько лет.
Сухие пятна крови на бумажном фильтре или марле. Забор крови производят на бумажный фильтр или марлевую салфетку (достаточно пятна диаметром 2 см), затем образцы высушивают при комнатной температуре. Хранение и транспортировку осуществляют в бумажных конвертах, что удобно для доставки материала из отдаленных районов. Такие образцы сухой крови остаются пригодными для проведения исследования несколько лет. [14].
Гистологические образцы. Используют в ситуации, когда для проведения анализа требуется исследование умершего члена семьи.
В настоящее время существуют два основных подхода к диагностике моногенных болезней:
- · Прямая диагностика, основанная на непосредственной идентификации мутаций в определенном гене.
- · Косвенная (непрямая) диагностика, в основе которой лежит анализ наследования генетических маркеров, сцепленных с геном болезни. Недостатком метода является необходимость наличия в семье больного ребенка, анализ ДНК которого позволяет установить молекулярный маркер для мутантной хромосомы родителей.
Большинство подходов основано на полимеразной цепной реакции (ПЦР), позволяющей в течение 2−3 часов получить несколько миллионов копий заданной последовательности. Для выявления наиболее типичных для популяции мутаций в гене CFTR разработаны специальные диагностикумы, позволяющие одновременно определять сразу несколько мажорных мутаций. Важную роль в постановке диагноза МВ играют данные дополнительных лабораторных и инструментальных методов обследования.
- 2. При МВ наблюдаются характерные изменения рентгенологической картины легких (эмфизема, расширение корней легких, деформация легочного рисунка в виде линейных или округлых кистозных изменений, инфильтрация).
- 3. При бронхографии выявляют обрывы заполнения бронхов, уменьшение числа разветвлений, цилиндрические или смешанные бронхоэктазы;
- 4. Бронхоскопии — диффузный гнойный эндобронхит, высоковязкий слизисто-гнойный секрет;
- 5. Спирографии — нарушение ФВД по обструктивно-рестриктивному типу;
- 6. В копрограмме — большое количество неперевариваемого жира.
- 7. При исследовании дуоденального содержимого выявляется снижение содержания или отсутствие ферментов поджелудочной железы в дуоденальном соке.
- 8. Для оценки экзокринной функции поджелудочной железы применяют тест на панкреатическую эластазу 1 в кале (E1). При МВ наблюдается значительное снижение содержания эластазы 1. Умеренное снижение концентрации E1 наблюдается при наличии недостаточности экзокринной функции поджелудочной железы, обусловленной хроническим панкреатитом, опухолью поджелудочной железы, холелитиазом или диабетом. Тест специфичен для человеческой панкреатической эластазы 1, поэтому нет необходимости прерывать лечение перед проведением исследования. Материал для определения Е1 может храниться в течение недели в холодильнике, что позволяет не ограничивать время доставки анализа в диагностическую лабораторию. Одного образца кала достаточно для постановки диагноза (нет необходимости собирать суточный кал). 2,14]
Лечение
ь Цели лечения
- 1. Обеспечивать максимально высокое качество жизни пациента.
- 2. Предупреждать и лечить обострения хронического инфекционно-воспалительного процесса в бронхолегочной системе.
- 3. Обеспечивать адекватный рацион и режим питания.
ь Обязательные составляющие лечения
- 1. Методики дренирования бронхиального дерева и лечебная физкультура.
- 2. Диетотерапия.
- 3. Муколитическая терапия.
- 4. Антибактериальная терапия.
- 5. Заместительная терапия недостаточности экзокринной функции поджелудочной железы.
- 6. Витаминотерапия.
Методики дренирования бронхиального дерева и лечебная физкультура Кинезитерапия (2C) — один из важных компонентов комплексного лечения МВ. Главная цель проведения кинезитерапии — очищение бронхиального дерева от скоплений вязкой мокроты, блокирующих бронхи и предрасполагающих к развитию инфекционных заболеваний бронхолегочной системы. [12].
Наиболее часто используют следующие методики кинезитерапии:
- — постуральный дренаж;
- — перкуссионный массаж грудной клетки;
- — активный цикл дыхания;
- — контролируемое откашливание.
Кинезитерапия показана всем новорожденным и детям первых месяцев жизни, больным МВ. У грудных детей обычно применяют пассивную технику кинезитерапии, включающую:
- — положения, в которых улучшается эвакуация слизи из легких;
- -контактное дыхание;
- — массаж с легкой вибрацией и поглаживанием;
- — занятия на мяче.
- — дренаж с помощью специального вибрационного жилета (Vest): у пациентов с муковисцидозом в любом возрасте (у новорожденного и взрослого).
Эффективность тех или иных методов варьирует в зависимости от индивидуальных особенностей пациентов с МВ. Чем младше ребенок, тем более пассивные методики дренирования следует использовать. Новорожденным выполняют только перкуссию и компрессию грудной клетки. По мере роста ребенка следует постепенно вводить более активные методики, обучая пациентов технике контролируемого откашливания.
Регулярные занятия лечебной физкультурой позволяют:
- — эффективно лечить и предупреждать обострения хронического бронхолегочного процесса;
- — формировать правильное дыхание;
- — тренировать дыхательную мускулатуру;
- — улучшать вентиляцию легких;
- -повышать эмоциональный статус ребенка. 12,14]
Выбор лекарственных средств: определяется индивидуально. В клинической практике применяется несколько классов муколитических препаратов:
ь тиолы, N-ацетилцистеин (код АТХ: R05CB01) — используется ингаляционно, внутрь, в/в и ректально, выпускается в виде гранул, таблеток, порошков, рас-творов, применяется из расчета 30мгкгсут в 2−3 приема (2С).
ь стимуляторы выработки легочного сурфактанта: амброксол гидрохлорид (код АТХ: R05CB) — используется внутрь 1−2мгкгсутки в 2−3 приема и в/в 3−5мгкгсутки, выпускается в виде сиропа, таблеток, растворов для вв введения (2С).
ь дорназа альфа (Пульмозим) (код ATX: R05CB13) — разрывает водородные связи молекул ДНК, которые являются основной составляющей гнойной мокроты (1А). Применяется ингаляционно в дозе 2,5 мг в сутки.
Выбор пути введения: предпочтение отдается ингаляционному введению муколитиков.
Оценка эффективности лечения: клинически (оценка суточного дебета мокроты, изменений ее консистенции, оценка уровня дыхательной недостаточности).
Оценка безопасности лечения: клинически (специальных процедур оценки безопаности этих лекарственных средств — не существует).
Дополнительные замечания: Все способы разжижения мокроты необходимо комбинировать с удалением ее из дыхательных путей, используя методы кинезитерапии. Перед сеансом кинезитерапии желательно, а при наличии бронхообструкции обязательно ингаляциям муколитиков должны предшествовать ингаляции бронхолитиков.
Бронхолитики.
Показания:
- — больные с легким течением МВ, у которых при проведении спирометрии выявлена бронхообструкция (одышка, сухие хрипы при аускультации, снижение величины ОФВ1 ме-нее 85% от должного значения);
- — больные с умеренным течением МВ.
- — больные с терминальным течением МВ.
Противопоказания: индивидуальная непереносимость.
Выбор лекарственных средств: при возникновении затрудненного дыхания и одышки назначается сальбутамол (Код АТХ: R03CC02) в режиме «по требованию» (2В); перед проведением кинезитерапии назначается сальбутамол (2B); при наличии обратимой бронхо-обструкции (прирост уровня ОФВ1 после ингаляции бронхолитика > 15%) назначается бе-та2-адреностимулятор (сальбутамол) в сочетании с М-холинолитикам (ипратропия бромид (Код АТХ: R03BB01)) (2В) или пролонгированные препараты — салметерол (Код АТХ: R03AK06) (2В), формотерол (Код АТХ: R03AC13) (2В), тиотропиум бромид (Код АТХ: 11 R03BB04) (2B); у больных с ночными эпизодами удушья и при невозможности регулярной ингаляционной терапии назначаются пролонгированные теофиллины внутрь;
Выбор пути введения: предпочтение отдается ингаляционному введению.
Оценка эффективности лечения: клинически (симптомы бронхообструкции) и по данным спирометрии.
Оценка безопасности лечения: клинически и по результатам объективного осмотра (число сердечных сокращений, сердечный ритм).
Дополнительные замечания: При назначении бронхолитиков детям до 10 лет и больным с тяжелой бронхообструкцией (ОФВ1<30% от должного) ингаляции должны проводиться при помощи небулайзера или через спейсер, оснащенный лицевой маской.
Антибактериальные препараты (АБП).
Показания: все больные с легочными проявлениями МВ, у которых отмечается обострение МВ или выявляются возбудители респираторной инфекции в количестве более 1034 колониеобразующих единиц при плановом микробиологическом исследовании, или при хроническом высеве P.aeruginosa (плановые курсы каждые 3 месяца, не зависимо от наличия или отсутствия обострения).
Противопоказания: определяются индивидуально и зависят от индивидуальной непереносимости (в том числе аллергия), характера сопутствующих заболеваний (главным образом заболевания печени и почек) и возраста больного.
Выбор лекарственных средств определяется: видом возбудителя, выявленного у больного; чувствительностью возбудителя (in vitro) к данному АБП; фазой заболевания (обострения — ремиссия); продолжительностью инфекционного процесса (хроническая инфекция — впервые выявленный возбудитель).
Выбор пути введения определяется: видом возбудителя, выявленного у больного; фазой заболевания (обострения — ремиссия); продолжительностью инфекционного процесса (хроническая инфекция — впервые выявленный возбудитель); местом оказания медицинской помощи (амбулаторная — стационарная); эффективностью предшествующей антибактериальной терапии.
Оценка эффективности лечения: клинически (симптомы инфекционного процесса — лихорадка, хрипы в легких), по данным лабораторных методов обследования (лейкоцитоз, уровень С-реактивного белка) и по данным микробиологического исследования (эрадикация возбудителя, персистирование, суперинфекция, снижение выделения возбудителя <104 колониеобразующих единиц. и т. д.).
Оценка безопасности лечения: зависит от применяемого лекарственного средства (ЛС) и проводится с учетом возможных нежелательных лекарственных реакций.
Дополнительные замечания:
- 1. При назначении АБП следует использовать комбинации ЛС с различным механиз-мом действия (например, в-лактамные антибиотики в комбинации с аминогликозидами). При выделении в мокроте больного одновременно двух микроорганизмов выбор АБП зависит от свойств более резистентного возбудителя.
- 2. Применение АБП в виде ингаляций через небулайзер:
- — может проводиться как в стационаре, так и в домашних условиях (при наличии небулайзера и соответствующих навыков у больного или его близких). Если нет условий для регулярного проведения ингаляции в домашних условиях, лучше перейти к приему АБП внутрь;
- — для решения вопроса о назначении ингаляционной терапии следует провести спирометрию до первой ингаляции антибиотика и через несколько минут после ингаляции (для выявления возможного бронхоспазма). У детей до 6 лет безопасность терапии оценивается исходя из наличия симптомов бронхообструкции (появление кашля или хрипы в легких);
- — перед ингаляцией АБП необходимо провести ингаляцию бронхолитиков (сальбутамол 2,5 мг через небулайзер за 15−30 минут до ингаляции антибиотика), муколитиков, а так же постуральный дренаж;
- — при ингаляции АБП в домашних условиях, если в одном помещении с больным проживают дети, необходимо использовать небулайзер, оснащенный фильтром для выдыхаемого воздуха;
- — при ингаляции АБП лучше применять мундштук (загубник), чем маску, за исключением детей до 3-х лет. Вдыхание препарата лучше осуществлять через рот, применение носовых зажимов во время ингаляции увеличивает эффективность лечения;
- — при проведении ингаляций в условиях ЛПУ, больные, инфицированные P. aeruginosa и особенно B. cepacia, должны пользоваться индивидуальным небулайзером.
- 3. Применение АБП внутрь используется для терапии обострений МВ в домашних условиях или для профилактического лечения больных, инфицированных P. aeruginosa;
- 4. Применение АБП внутривенно показано:
- — при тяжелых обострениях МВ (лечение в условиях ЛПУ);
- — для профилактического лечения больных, инфицированных P. aeruginosa, в тех случаях, когда применение АБП внутрь оказалось неэффективным (внутривенная терапия в домашних условиях);
- — при ухудшении течения заболевания и появлении новых симптомов у больных, получающих АБП внутрь (внутривенная терапия в домашних условиях);
Антибактериальная терапия при выявлении в мокроте S. aureus
муковисцидоз бронхолегочный антибактериальный терапия Выявление в мокроте S. aureus позволяет утверждать, что данное обострение инфекционно-воспалительного процесса в бронхолегочной системе вызвано именно данным видом микроорганизмов. Профилактические курсы противомикробных препаратов, действующих на S. aureus, следует проводить не реже 1−2 раза в год. Иногда течение заболевания требует проведения очень частых повторных курсов с короткими интервалами между ними. Для профилактики и лечения нетяжелых обострений наиболее эффективны следующие препараты и режимы приема:
Азитромицин (Код АТХ: J01FA10) (2В) принимают внутрь 1 раз в сутки в течение 3−5 дней из расчета:
- — детям старше 6 мес — по 10 мг/кг массы тела ребенка;
- — детям с массой тела 15−25 кг — по 200 мг;
- — детям с массой тела 26−35 кг — по 300 мг;
- — детям с массой тела 36−45 кг — по 400 мг;
- — старше 12 лет — по 500 мг.
Амоксициллин (Код АТХ: J01CA04) (2В) принимают внутрь в течение 3−5 дней из расчета:
- — детям — по 50−100 мг/кг массы тела ребенка в сутки в 3−4 приема;
- — старше 12 лет — по 1,0 г 4 раза в сутки.
Кларитромицин (Код АТХ: J01FA09) (2В) принимают внутрь в течение 3−5 дней из расчета:
- — детям с массой тела <8 кг — по 7,5 мг/кг массы тела ребенка 2 раза в сутки; Ванкомицин (Код АТХ A07AA09) (2В) вводят внутривенно в течение 14 дней из рас-ч?та:
- — детям — по 40 мг/кг массы тела ребенка в сутки, деля общую дозу на 4 введения;
- — старше 12 лет — по 1,0 г 2−4 раза в сутки.
Ванкомицин назначают в случаях, когда обострение инфекционно-воспалительного процесса в бронхол? гочной системе обусловлено инфицированием больного метициллинрезистентными штаммами S. aureus.
Антибактериальная терапия при выявлении в мокроте H. Influenzae.
Антибактериальную терапию противомикробными препаратами, активными в отношении H. influenzae, назначают для профилактики (при ОРВИ, обнаружении данного микроорганизма в мокроте) и лечения обострений хронического инфекционно-воспалительного процесса в бронхолегочной системе, обусловленного H. influenzae. Продолжительность стандартного курса антибактериальной терапии составляет 14 суток. Чаще назначают азитромицин (10 мг/кг/дн-2B), амоксициллин (50−100 мг/кг/дн-2B), кларитромицин (10−15 мг/кг/дн-2B).
Антибактериальная терапия при выявлении в мокроте P. Aeruginosa.
Показания к назначению противомикробных препаратов на фоне обнаружения P. aeruginosa в мокроте:
- — обострение хронического инфекционно-воспалительного процесса в бронхолегочной системе;
- — профилактика развития хронической инфекции (у больных без признаков обострения при впервые высеянном P. аeruginosa) и прогрессирования инфекционно-воспалительного процесса в бронхолегочной системе (больным с хронической колонизацией нижних дыхательных путей P. aeruginosa).
При обострении антибактериальную терапию начинают с внутривенного введения противомикробных препаратов в условиях стационара. При положительной клинической динамике лечение можно продолжить в амбулаторных условиях. Длительность антибактериальной терапии не должна быть меньше 14 сут.
Для эрадикации P. aeruginosa наиболее эффективны следующие препараты и режимы приема.
Азлоциллин (Код АТХ: J01CA09) (2C) вводят внутривенно, разделяя суточную дозу на 3−4 введения, из расчета:
— детям — по 300 мг/кг массы тела в сутки;
Колистин (код ATX: J01XB01) (1А).
- — В ингаляциях, проводимых 2 раза в сутки:
- — детям грудного возраста — по 500 000 ЕД;
- — детям 1−10 лет — по 1 000 000 ЕД;
- — детям старше 10 лет — по 2 000 000 ЕД.
Меропенем (Код АТХ: J01DH02) (1В) вводят внутривенно, разделяя общую дозу на 3 введения, из расчета:
— детям — по 60−120 мг/кг массы тела ребенка в сутки;
Пиперациллин (Код ATX: J01CA12) (1В) вводят внутривенно, разделяя общую дозу на 3 введения, из расчета:
— детям — по 200−300 мг/кг массы тела в сутки;
Пиперациллин с тазобактамом (Код ATX: J01CR05) (2В) вводят внутривенно, разделяя общую дозу на 3 введения, из расчета:
— детям — по 90 мг/кг массы тела ребенка в сутки;
Тобрамицин (Коды АТХ: J01GB01) (1А).
— В ингаляциях, проводимых 2 раза в сутки, 6 курсов в год по схеме 28 дней принимать, 28 дней перерыв: раствор 300 мг тобрамицина в 4 мл раствора или в виде порошкового ингалятора по 112 мг тобрамицина 2 раза в день.
Цефтазидим (Код АТХ: J01DD02) (1В).
- — Применяют в виде внутривенных инъекций, разделяя общую дозу на 2 введения, из расчета:
- — детям — по 150−300 мг/кг массы тела ребенка;
- — В ингаляциях по 1,0−2,0 г 2 раза в сутки.
Ципрофлоксацин (Код АТХ: J01MA02) (1В).
- — Принимают внутрь, разделяя суточную дозу на 2 приема, из расчета:
- — детям — по 15−40 мг/кг массы тела ребенка в сутки;
- — Вводят внутривенно, разделяя общую дозу на 2 введения, из расчета:
- — детям — по 10 мг/кг массы тела ребенка в сутки;
Одновременно назначают 2−3 противомикробных препарата из разных групп, что предотвращает развитие устойчивости P. aeruginosa и способствует достижению максимального клинического эффекта. Наиболее часто применяют комбинации аминогликозидов с цефалоспоринами 3−4 поколения. Целесообразно периодически менять комбинации антибиотиков, эффективных в отношении синегнойной палочки. Следует помнить, что лабораторное определение чувствительности микроорганизма к антибиотикам не всегда полностью совпадает с клиническим ответом на проводимую терапию.
Профилактические курсы антибактериальной терапии при хронической колонизации нижних дыхательных путей P. aeruginosa увеличивают продолжительность жизни пациентов. Вместе с тем проведение профилактических курсов антибактериальной терапии практически не сказывается на устойчивости штаммов микроорганизмов, но только при своевременной смене применяемых препаратов.
При частых обострениях инфекционно-воспалительного процесса в бронхолегочной системе следует увеличивать продолжительность курсов антибактериальной терапии до 3 недель, используя внутривенный способ введения, и (или) сокращать интервалы между курсами, и (или) между курсами принимать внутрь ципрофлоксацин.
В случае высевания из мокроты P. aeruginosa:
- — при первом высеве необходимо назначить ингаляции раствора тобрамицина в дозе 300 мг/5 мл дважды в день — курс 28 дней- (1А), альтернативой может служить схема терапии в течение 3 недели: ингаляции с колистином по 1 000 000 ЕД 2 раза в сутки совместно с приемом внутрь ципрофлоксацина из расчета 25−50 мг/кг массы тела пациента в сутки, разделяя общую дозу на 2 приема (1В);
- — при повторном высеве необходимо в течение 3 недель проводить ингаляции с колистином по 2 000 000 ЕД 2 раза в сутки совместно с приемом внутрь ципрофлоксацина из расчета 25−50 мг/кг массы тела пациента в сутки, разделяя общую дозу на 2 приема (1В);
- — более 3 раз за 6 мес. следует в течение 12 нед. проводить ингаляции с колистином по 2 000 000 ЕД 2 раза в сутки совместно с приемом внутрь ципрофлоксацина из расчета 25−50 мг/кг массы тела пациента в сутки, разделяя общую дозу на 2 приема.(1В)
При обнаружении в мокроте P. aeruginosa после получения отрицательных результатов бактериологического исследования в течение нескольких месяцев, пациентам, которым ранее проводили курсы антибактериальной терапии, используя внутривенный способ введения препаратов, следует в течение 12 недель проводить ингаляции с колистином по 2 000 000 ЕД 2 раза в сутки совместно с приемом внутрь ципрофлоксацина из расчета 25−50 мг/кг массы тела пациента в сутки, разделяя общую дозу на 2 приема (1В).
Антибактериальная терапия при выявлении в мокроте B. cepacia.
Пациентов, у которых в мокроте обнаружена B. cepacia, необходимо изолировать от других пациентов с МВ, что обусловлено отсутствием возможности предугадать случаи тяжелого и скоротечного развития инфекции B. cepacia, обусловленные устойчивостью данного возбудителя к большинству противомикробных ЛС.
В случае нетяжелого обострения наиболее эффективны следующие препараты и режимы приема:
Ко-тримоксазол (2С) принимают внутрь 2 раза в сутки в течение 14 дней из расчета:
- — детям 6 нед — 5 мес — по 120 мг;
- — детям 6 мес — 5 лет — по 240 мг;
- — детям 6−12 лет — по 480 мг;
- — детям старше 12 лет — по 960 мг.
Цефтазидим (2С) применяют в виде ингаляций по 1,0−2,0 г 2 раза в сутки в течение 14 дней.
При тяжелом обострении инфекционно-воспалительного процесса в бронхол? гочной системе, вызванном B. cepacia, необходимо сочетанно принимать 2 или 3 противомикробных препарата (фторхинолоны, цефалоспорины 3−4-го поколения, карбапенемы, хлорамфеникол).
Цефтазидим с ципрофлоксацином (2С) вводят внутривенно в течение 14 дней, разделяя суточную дозу на 2 введения, из расчета:
- — детям — по 150−300 мг/кг массы тела ребенка в сутки цефтазидима и по 10 мг/кг в сутки ципрофлоксацина;
- — страше 12 лет — по 6−9 г/сут цефтазидима и по 400 мг/сут ципрофлоксацина.
Меропенем (2С) вводят внутривенно в течение 14 дней, разделяя общую дозу на 3 введения, из расчета:
- — детям — по 60−120 мг/кг массы тела ребенка в сутки;
- — старше 12 лет — по 3−6 г/сут.
Панкреатические ферменты Заместительную терапию микросферическими панкреатическими ферментами следует назначать всем новорожденным с МВ, имеющим клинические проявления кишечного синдрома (49%) или низкую концентрацию эластазы-1 в кале. При проведении заместительной терапии необходимо контролировать:
- — показатели копрограммы;
- — частоту и характер стула;
- — ежемесячную прибавку массы тела и динамику роста пациента.
Для восстановления адекватной ассимиляции жира следует применять высокоэффективные панкреатические ферменты. При этом применении в большинстве случаев удается компенсировать стеаторею и уменьшить дефицит массы тела без применения специализированных биологически активных добавок к пище.
Показания: все больные с признаками недостаточности функции поджелудочной железы (стеаторея, снижение копрологической Эластазы 1 менее 200 мкг/г). [8].
Противопоказания: индивидуальная непереносимость.
Выбор лекарственных средств: препараты, выпускаемые в виде минимикросфер и микротаблеток с рН-чувствительным покрытием и желатиновой капсулой.
Выбор пути введения: внутрь до или во время еды.
Оценка эффективности лечения: к клиническим показателям адекватной дозировки панкреатических ферментов следует отнести: улучшение прибавки веса детей, уменьшение объема стула, уменьшение зловонного запаха, исчезновение болей в животе. Лабораторные показатели — уменьшение степени стеатореи.
Оценка безопасности лечения: по клиническим признакам.
Дополнительные замечания:
Подбор доз панкреатических ферментов проводится эмпирически.
ь Начальные дозы: дети грудного возраста: 3300−5000 Ед липазы на 100−150 мл. молока или молочной смеси;
ь дети старше 1 года — 2000;6000 Ед липазы /кг/сутки (500−1000 Ед липазы /кг на основной прием пищи и 250−500 Ед липазы на дополнительный прием пищи). Не следует повышать дозу ферментов до очень высокой (>18 000−20 000 Eд липазы / кг в сутки).
ь В дальнейшем доза подвергается коррекции на основе клинических симптомов и лабораторных данных. Следует помнить, что примерно у 10% больных недостаточность поджелудочной железы не поддается полной коррекции.
Панкреатические ферменты не следует назначать после еды. Капсулы, содержащие мелкие покрытые оболочкой таблетки и минимикросферы, можно вскрывать и принимать их содержимое одновременно с небольшим количеством пищи, или принимать целиком, не вскрывая, если ребенок уже достаточно большой и может проглотить капсулу.
Эффективность терапии панкреатическими ферментами иногда можно повысить при одновременном применении фамотидина (Код АТХ: A02BA03), ранитидина (Код АТХ: A02BA02), омепразола (Код АТХ: A02BC01) или эзомепразола (Код АТХ: A02BC05) (2C). Эти средства могут быть назначены в том случае, когда требуется достаточно высокое уве-личение доз панкреатических ферментов и/или при отсутствии их лечебного эффекта. 8].
Диета: Диета больных МВ должна быть максимально приближенной к нормальной, богатой белками и калориями, без ограничений в количестве жиров (убедительность A).
Считается, что количество калорий в рационе больного МВ должно составлять 120−150% от калоража, рекомендуемого здоровым детям того же возраста, 35−45% всей энергети-ческой потребности должно обеспечиваться жирами, 15% белком и 45−50% - углеводами.
Существуют довольно сложные формулы для расчета необходимых дополнительных калорий, однако в повседневной практике можно пользоваться следующими ориентирами: 1−2 года — 200 ккал, 3−5 лет — 400 ккал, 6−11 лет — 600 ккал, старше 12 лет — 800 ккал в сутки. [12].
Жирорастворимые витамины, А (1В), D (1В), Е (1В) и К (1В) и бета-каротин (1В) должны добавляться к пище ежедневно (табл 8).
Таблица 8.
Рекомендуемые суточные дозы жирорастворимых витаминов для больных МВ.
Витамин. | Возраст. | Суточная доза. | |
Витамин А. | Любой. | 4 — 10 тыс. ЕД. | |
Витамин D. | Любой. | 400 — 800 ЕД. | |
Витамин Е. |
старше 10 лет. |
| |
Витамин К. | 0−1 год Более 1 года. |
| |
Выбор пути введения: внутрь.
Оценка эффективности лечения: клинически и по данным УЗИ (1 раз в 6 месяцев).
Оценка безопасности лечения: необходим периодический (1 раз в год) контроль уровня трансаминаз крови.
Препараты других групп Для терапии МВ применяется ряд препаратов других фармакологических групп. Как правило, решение о назначении этих ЛС должно приниматься специалистами ЛПУ III уровня на основании индивидуальных показаний. К этим препаратом относятся:
Длительное применение системных глюкокортикоидов (1B) в малых дозах помогает не только стабилизировать состояние пациента, но и улучшить функциональные и клинические показатели. Чаще всего для поддерживающей терапии назначают преднизолон по 0,3−0,5 мг/кг массы тела пациента в сутки. Его следует принимать внутрь через сутки (постоянно). При использовании ингаляционных форм глюкокортикоидов медленнее и в меньшем количестве развиваются побочные эффекты.
Макролиды (кларитромицин, азитромицин) назначаются больным с хронической синегнойной инфекцией в качестве противовоспалительных и иммуномодулирующих ЛС, а также в качестве антиоксиданта (для азитромицина — 1А).
Нестероидные противовоспалительные препараты (НПВП) оказывают доста-точно выраженный противовоспалительный эффект, но при их длительном применении часто развиваются серь? зные осложнения. Обсуждается возможность длительного применения при МВ НПВП, селективно ингибирующих циклооксигеназу-2, однако их противовоспалительная активность ниже, чем у более ранних аналогов (2C).
Новые препараты для лечения муковисцидоза ь Новый препарат Kalydeco (ivacaftor, ивакафтор), разработанный американской фармкомпанией Vertex Pharmaceuticals, улучшает работу CFTR, в котором из-за мутации аминокислота глицин в 155-м положении заменена аспарагиновой кислотой (такой вариант белка обозначается G551D-CFTR). В частности, он повышает вероятность открытия этого ионного канала под действием циклического аденозинмонофосфата (цАМФ) и повышает ток хлора через мембраны, нарушенный при муковисцидозе. Экспериментальный курс ивакафтора улучшил у пациентов показатели функции легких в среднем на 10 процентов и помог им набрать вес (у больных муковисцидозом обычно наблюдается дефицит массы тела), а также значительно улучшил самочувствие. Kalydeco выпускается в виде таблеток, содержащих 150 миллиграммов действующего вещества и рассчитанных на прием дважды в сутки. FDA одобрило его к применению у взрослых и детей старше шести лет. Эффективность и безопасность лекарства у детей младшего возраста исследуется в настоящее время. Мутация, при которой активен ивакафтор, лежит в основе лишь четырех процентов случаев муковисцидоза, то есть из примерно 30 тысяч американцев, страдающих этим заболеванием, препарат может помочь лишь около 1200 (препарат будет назначаться только после выявления у пациента G551D-CFTR). Большинство случаев муковисцидоза связаны с мутацией, при которой в 508 положении CFTR отсутствует аминокислота фенилаланин (вариант белка CFTR-ДF508). Для этой формы заболевания Vertex разработала препарат VX-809, который пока проходит клинические испытания.
ь Брамитоб (Bramitob) — Раствор для ингаляций, активное вещество: тобрамицина сульфат в 1 ампуле 300 мг /4 мл. Антибиотик применяется для лечения инфекций дыхательных путей, особенно лечение инфекций дыхательных путей, вызванных Pseudomonas aeruginosa у больных с муковисцидозом.
ь Гианеб — р — р д/ ингаляций 5 мл № 30 фл. Производство — Италия. Ингаляции раствора ГИАНЕБ ускоряют отхождение вязкого секрета (мокроты) в дыхательных путях. ГИАНЕБ особенно показан пациентам с муковисцидозом и бронхоэктазами. Цена его колеблется в пределах 5000−5700.ГИАНЕБ — готовый к употреблению, содержащий разовые дозы, стерильный, не содержащий консервантов раствор является поистине инновационной технологией и теперь доступен для российских пациентов. Гианеб позволит добиться значительного прогресса в лечении муковисцидоза и бронхоэктазами, приблизить стандарт оказания лекарственной помощи больным этими патологиями на территории Российской Федерации до международного уровня, при этом обеспечить у таких пациентов существенное снижение числа осложнений, госпитализаций, увеличение продолжительности жизни и улучшение её качества.
Условия оказания медицинской помощи детям с МВ Больные МВ должны находиться на активном диспансерном наблюдении регионарного Центра МВ. По достижении возраста 1 года больных МВ необходимо обследовать 1 раз в 3 мес, что позволяет следить за динамикой заболевания (табл. 9) и своевременно корригировать терапию. [9].
Таблица 9.
Исследования, которые необходимо проводить при каждом приеме пациента (1 раз в 3 мес). Антропометрия (рост, масса тела, дефицит массы тела). Общий анализ мочи. Копрологическое исследование. Клинический анализ крови*. Бактериологическое исследование мокроты (при невозможности собрать мокроту — мазка с задней стенки лотки) на микрофлору и чувствительность к антибиотикам*. Исследование ФВД*. Определение SaO2*. | Обязательное ежегодное обследование Биохимическое исследование крови (активность печеночных фер-ментов, соотношение белковых фракций, электролитный состав, концентрация глюкозы). Компьютерная томография органов грудной клетки. Ультразвуковое исследование органов брюшной полости. ЭКГ. Осмотр отоларингологом. Тест на толерантность к глюкозе. | |
*Дополнительно исследование проводят при появлении признаков обострения инфекционно-воспалительного процесса в бронхол? гочной системе.
Прогноз МВ — хроническое неизлечимое заболевание, поэтому больные нуждаются в активном диспансерном наблюдении и непрерывном лечении. У одних пациентов, несмотря на своевременную диагностику и адекватную терапию, поражение бронхолегочной системы быстро прогрессирует, у других динамика изменений более благоприятна. Многие пациенты доживают до взрослого и даже зрелого возраста.
Точно оценить прогноз заболевания невозможно даже в случаях, когда точно установлен тип мутации. Факторы, влияющие на прогноз заболевания: нет.
- — качество проводимой терапии;
- — соблюдение предписанного режима лечения;
- — образ жизни;
- — количество перенесенных вирусных, бактериальных и грибковых инфекций;
- — режим питания;
- — экологическая обстановка, в которой проживает пациент. 12]
Библиография
- 1. Муковисцидоз (Современные достижения и актуальные проблемы) Методические рекомендации Москва, 2011; сотрудники Российского Центра Муковисцидоза: Капранов Н. И., Каширская Н. Ю., Шерман В. Д., Воронкова А. Ю., Шабалова Л. А., Никонова В. С., Кусова З. А., Пухальский А. Л., Шмарина Г. В. Под редакцией Капранова Н. И. и Каширской Н.Ю.
- 2. Муковисцидоз: генетика, клиника, патогенез, диагностика, лечение, профилактика. Методическое пособие. Авторы: В. Г. Вахарловский (СПбГПМА) Т. Е. Гембицкая (НИИ Пульмонологии СПб ГМУ им. академика И.П.Павлова) И. В. Двораковская (НИИ Пульмонологии СПб ГМУ им. академика И.П.Павлова) В. С. Круглова (СПбГПМА) А. Г. Черменский (НИИ Пульмонологии СПб ГМУ им. академика И.П.Павлова) Н. Ю. Цыбакова (СПбГПМА) Е. Н. Имянитов (СПбГПМА).
- 3. Газета «Новости медицины и фармации», аллергология, пульмонология и иммунология. Муковисцидоз у детей. Авторы: Т.В. ЛЕНАРТ, заведующая пульмонологическим отделением, Областная детская клиническая больница, г. Донецк, Н.Е. МОНОГАРОВА, доцент, Донецкий национальный медицинский университет им. М. Горького.
- 4. Педиатрия. Национальное руководство. Краткое издание / под ред. А. А. Баранова. М.: ГЭОТАР-Медиа, 2014. 768 с.: ил.
- 5. Клиническая генетика: учебник/ Н. П. Бочков, В. П. Пузырен,?С. А. Смирнихина; под ред. Н. П. Бочкова, 4-е изд., доп. и перераб. М.: ГЭОТАР-Медиа, 2011. 592 с: ил.
- 6. Капранов Н. И., Каширская Н. Ю. Монография «Муковисцидоз» Медпрактика 2014 г.
- 7. Infection Control Guidance for Patients with Cystic Fibrosis Ratified by Infection Control & Decontamination Assurance Group: 8th April 2014.
- 8. «Регистр больных муковисицидозом в Российской Федерации.2013г» ИД"Медпрактика-М", 2015, 64 с.
- 9. Муковисцидоз (клиническая картина, диагностика, лечение, реабилитация, диспансеризация): учебное пособие для врачей / А. В. Орлов, О. И. Симонова, Е. А. Рославцева, Д. И. Шадрин. — СПБ.: Изд — во СЗГМУ им. И. И. Мечникова, 2014. 160 с.: ил.
- 10. Журнал медицинский вестник. Конспект врача. Муковисцидоз: история, клиника (дополнено) Вадимир Бобровничий, доцент 2-й кафедры детских болезней БГМУ, главный внештатный детский пульмонолог Минздрава, руководитель Республиканского центра пульмонологии и муковисцидоза, кандидат.мед. наук. 16 декабря 2015 г.
- 11. Журнал «Практика педиатра»; март — апрель; 2015; стр. 20 — 27. Актуальные вопросы диагностики муковисцидоза. Е. И. Кондратьева, д. м. н., профессор, В. Д. Шерман, к. м. н., Н. И. Капранов, д. м. н., профессор, Н. Ю. Каширская, д. м. н., профессор, НКО муковисцидоза ФГБНУ «МГНЦ», ГБУЗ «ДГКБ № 13 им. Н. Ф. Филатова ДЗМ», г. Москва.
- 12. Клинические рекомендации по оказанию медицинской помощи детям с муковисцидозом. Данные клинические рекомендации рассмотрены и утверждены на заседании Исполкома профессиональной ассоциации детских врачей Союза педиатров России на XVII Съезде педиатров России «Актуальные проблемы педиатрии» 15 февраля 2013 г.
- 13. Dodge, J.A., Lewis, P.A., Stanton, M., and Wilsher, J. «Cystic fibrosis mortality and survival in the UK: 1947;2003». Eur Respir. 2007; 29: 522−526.
- 14. Клинический протокол диагностики и лечения муковисцидоза у детей. Утверждено на Экспертной комиссии по вопросам развития здравоохранения Министерства здравоохранения Республики Казахстан протокол № 10 от «04» июля 2014 года.