Электролиз.
Методические указания и контрольные задания по химии

Составляем условную схему электролиза (аналогичную схеме в задаче № 1), на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. К катоду подходят катионы Ni2+ и молекулы воды, ориентированные положительным полюсом к поверхности катода; к аноду подходят анионы Clи молекулы воды, ориентированные отрицательным полюсом к поверхности анода… Читать ещё >
Электролиз. Методические указания и контрольные задания по химии (реферат, курсовая, диплом, контрольная)
Электролиз — это совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую энергию.
Электролиз проводят в электролизере, который представляет собой емкость, заполненную раствором или расплавом электролита, в который погружены два электрода (например, графитовые) — катод и анод. Катод подсоединяют к отрицательному полюсу внешнего источника тока, а анод — к положительному. Таким образом, катод — отрицательно заряженный электрод, а анод — положительно заряженный электрод. На катоде происходит процесс присоединения электронов катода (от внешнего источника тока) катионами, атомами, молекулами. На аноде происходит процесс отдачи электронов аноду (во внешнюю цепь) анионами, атомами, молекулами. Таким образом, на катоде протекает процесс восстановления, на аноде — процесс окисления.
Рассмотрим механизм электролиза на примере расплава соли фторида натрия NaF. Расплавы солей являются сильными электролитами, поэтому при высоких температурах полностью диссоциируют на ионы в соответствии с уравнением процесса:
NaF = Na+ + F.;
Под действием электрического тока ионы приобретают направленное движение: катионы будут двигаться к катоду, а анионы — к аноду. Достигнув электродов, ионы начнут разряжаться на их поверхности. На катоде будет происходить процесс восстановления ионов Na+, а на аноде — процесс окисления ионов F-. Запишем электронные уравнения этих процессов и просуммируем их:
- (К-): Na+ + e > Na0 2 — процесс восстановления
- (A+): 2F- - 2e > F2 1 — процесс окисления
- 2Na+ + 2F- > Na0 + F2^
Суммарное молекулярное уравнение электролиза:
Электролиз водных растворов электролитов осложняется участием в электродных процессах молекул воды. Алгоритм рассмотрения электролиза водных растворов солей приведен в примерах решения задач.
При электролизе водных растворов электролитов необходимо учитывать особенности катодных и анодных процессов:
- 1. Катионы металлов от Li+ до Al3+ включительно (Е0Меn+/Ме0 < - 1,66 В) не восстанавливаются на катоде, вместо них на катоде восстанавливаются молекулы воды в соответствии с уравнением реакции: 2Н2О + 2е- = Н2 + 2ОН-
- 2. Катионы металлов от Mn2+ до H, восстанавливаются на катоде вместе с молекулами воды: Меn+ + ne- = Me0; 2Н2О + 2е- = Н2 + 2ОН-
- 3. Катионы металлов от Cu2+ до Au3+ полностью восстанавливаются на катоде в соответствии с уравнением реакции: Меn+ + neMe0
Если водный раствор электролита содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения значений стандартных электродных потенциалов металлов.
- 4. На практике используют два типа анодов: инертные или нерастворимые (уголь, графит, золото, платина) и активные или растворимые (Cu, Ag, Ni, Zn и др). Инертные электроды не участвуют в процессе электролиза. Активные аноды сами участвуют (окисляются) в процессе электролиза в соответствии с уравнением реакции: Ме0 — ne- = Men+.
- 5. Анионы кислородсодержащих кислот (SO42-, NO3-, CO32-, PO43-), в которых центральный атом (S+6, N+5, C+4, P+5).находится в высшей степени окисления, а также ионы Fникогда не окисляется на аноде из водных растворов электролитов. Вместо них окисляются молекулы воды: 2Н2О — 4е- = О20 + 4Н+
Количественные соотношения между массой выделившихся на электродах веществ и количеством прошедшего электричества через раствор или расплав электролита выражают законом Фарадея:
где m — масса вещества, выделившегося на электроде;
Э — его химический эквивалент;
Q — количество электричества (Кл);
F — число Фарадея (F= 96 500 Кл).
Q = I· t, где I — сила тока (А), t — время электролиза ©.
Э=А/n, где, А — атомная масса элемента; n — степень окисления его в соединении.
Тогда выражение (31) примет вид:
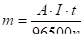
(33).
При электролизе в реальных условиях масса выделившегося вещества (его практический выход) всегда меньше массы вещества, рассчитанной по закону Фарадея. Это объясняется тем, что наряду с основными электродными процессами протекают побочные процессы, на которые расходуется часть количества электричества. Поэтому вводится понятие «выход по току»:
Впт =mпр/mтеорЧ100%,(33).
где mпр — масса вещества, практически полученного в процессе электролиза;
mтеор — масса вещества, теоретически рассчитанная по закону Фарадея.
Примеры решения задач Пример 1. Составить схему электролиза нитрата свинца с угольными электродами.
Р е ш е н и е. 1) Определим состав электролита. Для этого запишем уравнение электролитической диссоциации соли Pb (NO3)2:
Pb (NO3)2 = Pb2+ + 2NO3;
(nH2O) (nH2O).
То есть в растворе присутствуют гидратированные ионы Pb2+и NO3-, а также молекулы воды, представляющие собой диполи Н± ОН-.
- 2) Составляем условную схему электролиза, на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. При прохождении тока через раствор положительно заряженные ионы будут двигаться к катоду, отрицательно заряженные — к аноду; молекулы воды будут определенным образом ориентироваться у поверхности электродов: положительно заряженным полюсом диполя у катода, а отрицательно заряженным полюсом — у анода. Таким образом, у поверхности каждого из электродов на электродах будут скапливаться два сорта частиц: у катода — катионы Pb2+ и молекулы воды, а у анода — анионы NO3- и молекулы воды. Следовательно, на каждом из электродов будут протекать два конкурирующих процесса.
- 3) На основании сравнения значений стандартных электродных потенциалов определяем частицы, участвующие в катодном процессе (восстановления): Е0Pb2+/Pb0 = - 0,13 B > Е0Н2О/Н2= -0,41 (-0,83) В, следовательно, ионы Pb2+ обладают большей окислительной активностью и поэтому они участвуют в катодном процессе в соответствии с уравнением реакции: Pb2+ + 2e- = Pb0
- 4) Определяем частицы, участвующие в анодном процессе (окисления).
Вспоминаем, что нитрат-ион относится к числу кислородсодержащих ионов, в котором центральный атом (N+5) находится в высшей степени окисления, поэтому ион NO3- не будет окисляться на аноде, вместо него окисляются молекулы воды: 2Н2О — 4е- = О20 + 4Н+.
- 5) Составляем суммарное ионное, а затем — суммарное молекулярное уравнения процесса электролиза:
- (K-): Pb2+ + 2e- > Pb0 2
- (A+): 2Н2О — 4е- = О20 + 4Н+ 1
- 2Pb2+ + 2Н2О = 2Pb0 + О20 + 4Н+
- 2Pb (NO3)2 + 2Н2О = 2Pb0 + О20 + 4НNO3
Таким образом, при электролизе водного раствора Pb (NO3)2 с угольными электродами в процессе электролиза участвует как сам электролит, так и молекулы воды. Основными продуктами электролиза являются атомы свинца и молекулярный кислород, побочным продуктом является азотная кислота, накапливающаяся в прианодном пространстве.
Пример 2. Раствор содержит ионы Fe2+, Ag+, Bi3+, и Pb2+ одинаковой концентрации. В какой последовательности будут разряжаться эти катионы при электролизе, если напряжение достаточно для выделения любого металла?
Р е ш е н и е. При электролизе катионы разряжаются на катоде, где происходит процесс восстановления. Восстанавливаются ионы, обладающие окислительной активностью, которая тем выше, чем больше значение стандартного электродного потенциала. Следовательно, необходимо сравнить значения стандартных электродных потенциалов заданных ионов металлов:
Е0Fe2+/Fe0 = - 0,44 В, Е0Ag+/Ag0 = 0,8 В, Е0Bi3+/Bi0 = 0,21 В, Е0Pb2+/Pb0 = - 0,13 В Сравниваем эти значения: Е0Ag+/Ag0 > Е0Bi3+/Bi0 > Е0Pb2+/Pb0 > Е0Fe2+/Fe0. Следовательно, в ряду Ag+ - Bi3+ - Pb2+ - Fe2+ окислительная активность уменьшается, поэтому легче всего восстанавливаются ионы Ag+, затем ионы Bi3+, далее — ионы Pb2+ и в последнюю очередь — ионы Fe2+. Восстановление ионов Fe2+ будет происходить совместно с молекулами воды.
Запишем электронные уравнения процессов, протекающих на катоде:
Ag+ + e- > Ag0, Bi3+ + 2e- > Bi0, Pb2+ + e- > Pb0, Fe2+ + 2e- > Fe0.
Пример 3. Написать уравнения реакций, протекающих на электродах при электролизе водного раствора хлорида никеля с никелевым анодом.
Р е ш е н и е. 1) Определяем состав электролита. Записываем уравнение электролитической диссоциации хлорида никеля: NiCl2 = Ni2+ + Cl;
- (nH2O) (nH2O)
- 2) Составляем условную схему электролиза (аналогичную схеме в задаче № 1), на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. К катоду подходят катионы Ni2+ и молекулы воды, ориентированные положительным полюсом к поверхности катода; к аноду подходят анионы Clи молекулы воды, ориентированные отрицательным полюсом к поверхности анода.
- 3) Определяем, какие частицы будут участвовать в катодном процессе на основании сравнения значений стандартных электродных потенциалов:
- (K-) Е0Ni2+/Ni0 = - 0,25 B, Е0Н2О/Н2 = - 0,41 (-0,83)В
Е0Ni2+/Ni0 > Е0Н2О/Н2, следовательно, ионы Ni2+ обладают большей окислительной активностью и поэтому они участвуют в катодном процессе в соответствии с уравнением реакции: Ni2+ + 2e- = Ni0.
- 4) Определяем, какие частицы будут участвовать в анодном процессе. Для этого выписываем значения стандартных электродных потенциалов трех частиц: Cl-, H2O и Ni, поскольку материал анода также является химически активным:
- (А+): Е0Cl2/2Cl- = + 1,36 В, Е0О2 / 2Н2O = + 1,23 ч (1,8),, Е0Ni2+/Ni0 = - 0,25 B.
Сравнение значений Е0 показывает, что Е0Ni2+/Ni0 < Е0Cl2/2Cl-< Е0О2 / 2Н2O, поэтому большей восстановительной активностью обладают атомы никеля. Следовательно, сам никелевый анод будет участвовать в процессе окисления:
Ni0 — 2e- = Ni2+.
- 5) Объединяем уравнения катодного и анодного процессов:
- (K-) Ni2+ + 2e- = Ni0
- (А+) Ni0 — 2e- = Ni2+
При суммировании получается 0 = 0, что лишено физического смысла. Поэтому рассмотрение электролиза завершают на этом этапе.
Таким образом, электролиз водного раствора NiCl2 с никелевым анодом сводится к анодному окислению атомов никеля (Ni0) и катодному восстановлению ионов никеля (Ni2+), т. е. переносу никеля с анода на катод. При этом количество электролита в растворе остается неизменным.