Элементы химической термодинамики и термохимии

В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции зависит только от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути реакции, т. е. числа промежуточных стадий. Закон Гесса констатирует тот факт, что U и H являются функциями состояния системы, т. е. их изменение (?U и? H) зависит только от начального и конечного… Читать ещё >
Элементы химической термодинамики и термохимии (реферат, курсовая, диплом, контрольная)
Химическая термодинамика — это часть термодинамики, рассматривающая превращения энергии и работы при химических реакциях. Термохимия — раздел химической термодинамики в приложении к тепловым эффектам химических реакций.
Тепловой эффект химической реакции — это количество теплоты, которое выделяется или поглощается при реакции. При этом происходит изменении внутренней энергии системы (U) — суммы кинетической и потенциальной энергий всех частиц, составляющих систему: ?U = U2 — U1 (U1 — начальное состояние системы, U2 — конечное состояние системы).
В соответствии с первым законом термодинамики (законом сохранения энергии) изменение внутренней энергии закрытой системы определяется количеством теплоты Q, полученной системой из окружающей среды, и работой A, произведенной системой над окружающей средой:
?U = Q — A, (1).
где A = P? V — механическая работа расширения.
Для изобарных процессов (Р = const, ?V? 0) в термодинамике вводится новая функция энтальпия H = U + PV и Q определяется как изменение энтальпии? H = H2 — H1:
QP = ?H,(2).
где ?H — тепловой эффект химической реакции при P = const.
Реакции, протекающие с выделением теплоты, называются экзотермическими. В экзотермических реакциях внутренняя энергия и энтальпия системы уменьшаются, ?H 0.
В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции зависит только от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути реакции, т. е. числа промежуточных стадий. Закон Гесса констатирует тот факт, что U и H являются функциями состояния системы, т. е. их изменение (?U и? H) зависит только от начального и конечного состояния системы.
Следствие из закона Гесса:
Тепловой эффект химической реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ:
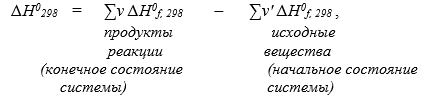
где н и н' - стехиометрические коэффициенты в уравнении реакции;
?H0f, 298 — стандартная энтальпия образования вещества, кДж/моль.
Стандартная энтальпия образования вещества (?H0f, 298) — это тепловой эффект образования одного моля данного вещества из простых веществ в стандартных условиях (Т = 298К, Р = 1 атм.). Значения? H0f, 298 приводятся в справочной литературе (см. табл. 2). Для простых веществ? H0f, 298 = 0.
Наблюдения показывают, что самопроизвольно, т. е. без затраты работы извне, могут идти как экзотермические, так и эндотермические реакции, если последние сопровождаются увеличением неупорядоченности системы (например, реакции, в которых из твердых веществ образуются газообразные вещества).
Степень неупорядоченности системы выражается термодинамической величиной — энтропией S. Чем выше неупорядоченность системы, тем больше ее энтропия. S также, как U и H, является функцией состояния системы. Для вычисления изменения энтропии (?S =S2 — S1) в химических реакциях используют следствие из закона Гесса:
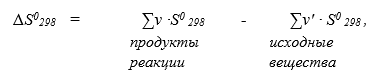
где ?S0298 — изменение энтропии реакции при стандартных условиях, Дж/моль;
н и н' - стехиометрические коэффициенты в уравнении реакции;
S0 298 — стандартная энтропия вещества, Дж/моль· К.
Известны абсолютные значения энтропии веществ, они приводятся в справочной литературе (см. табл. 2).
Термодинамическая величина, связанная с энтальпией и энтропией, называется энергией Гиббса (изобарно-изотермическим потенциалом) и обозначается буквой G: G = H — T· S. В изобарно-изотермических условиях.
?G = ?H — T? S (5).
Величина ?G является критерием направления и предела самопроизвольного протекания химических реакций в закрытых системах при Р, Т = const: ?G = 0.
Если ?G < 0, то реакция протекает самопроизвольно в прямом направлении (ему отвечает убыль энергии G2 < G1); если? G > 0, то самопроизвольно протекает обратная реакция (G2 > G1); если? G = 0, то система находится в состоянии равновесия, при котором G = Gmin. Так как G является функцией состояния системы, то для стандартных условий изменение энергии Гиббса химической реакции? G0298 рассчитывается следующим образом:

где н и н' - стехиометрические коэффициенты в уравнении реакции;
?G0f, 298 — стандартная энергия Гиббса образования вещества, кДж/моль.
Стандартная энергия Гиббса образования вещества (?G0f, 298) — это изменение энергии Гиббса при реакции образования одного моля вещества из простых веществ при стандартных условиях. Значения? G0f, 298 — это справочные данные, для простых веществ? G0f, 298 = 0 (см. табл. 2). Для расчета? G при температуре, отличающейся от стандартной (Т? 298К), используется соотношение:
?GТ = ?H0298 — T? S0298,(7).
где ?H0298 — тепловой эффект химической реакции при стандартных условиях, энтальпийный фактор; ?S0298 — изменение энтропии химической реакции при стандартных условиях; T? S0298 — энтропийный фактор.
Знак и величина? G, а, следовательно, и возможность самопроизвольного протекания процесса при заданных температуре и давлении зависят от соотношения энтальпийного и энтропийного факторов.
Примеры решения задач.
Пример 1. Рассчитайте тепловой эффект реакции образования оксида железа (III) из простых веществ при стандартных условиях и стандартную энтальпию образования оксида железа (III), используя следующие термохимические уравнения:
- 2 Fe (т) + O2 (г) = 2FeO (т), ?H01 = - 527,4 кДж (а)
- 4FeO (т) + O2(г) = 2Fe2O3(т), ?H02 = -587,9 кДж (б)
Р е ш е н и е. 1) Записываем термохимическое уравнение образования оксида железа (III) из простых веществ:
4 Fe (т) + 3O2(г) = 2Fe2O3(т), ?H03 = ?, (в) где? H03 — тепловой эффект этой реакции.
- 2) Для расчета? H03 необходимо провести такую комбинацию уравнений (а) и (б), которая позволит получить уравнение реакции (в). На основании закона Гесса с термохимическими уравнениями можно оперировать также, как с алгебраическими. Для получения искомого результата следует уравнение (а) умножить на 2, а затем суммировать с уравнением (б):
- 4Fe + 2O2 + 4FeO + O2 = 4FeO + 2Fe2O3
- 4Fe + 3O2 = 2 Fe2O3
- 3) Тепловые эффекты реакции являются составной частью термохимических уравнений, поэтому с ними проведем аналогичные преобразования: 2· ?H01 + ?H02 = ?H03
- 4) Рассчитываем? H03 — тепловой эффект реакции (в):
- ?H03 = 2(-527,4) + (-587,9) = -1054,8 — 587,9 = - 1642,7 кДж.
- 5) Определяем стандартную энтальпию образования Fe2O3 (?H0f, 298).
Согласно уравнению (в) в результате реакции образуются 2 моль Fe2O3, поэтому.
?H0f, 298 (Fe2O3) = ?H03 /2 = - 1642,7 / 2 = - 821,35 кДж/моль.
Правильность расчета проверяем, сравнивая полученное значение со справочными данными табл. 2.
Пример 2. Определите возможность самопроизвольного протекания реакции восстановления оксида хрома (III) углеродом при 298К и 1500К.
Р е ш е н и е. 1) Записываем уравнение этой реакции с указанием агрегатного состояния реагирующих веществ: Cr2O3 (т) +3C (т) = 2Cr (т) + 3CO (г).
- 2) Согласно условию задачи необходимо ответить на вопрос: будет ли данная реакция протекать в прямом направлении? Критерием направленности химической реакции является изменение энергии Гиббса, а условием самопроизвольного протекания реакции в прямом направлении является соотношение? G < 0. Поэтому для решения задачи необходимо определить величину? G.
- 3) Определяем, будет ли данная реакция осуществляться при Т=298К, отвечающей стандартным условиям. Рассчитываем? G по уравнению (6), которое для данной реакции имеет вид:
- ?G0298 = (2?G0f, 298Cr + 3? G0f, 298 CO) — (?G0f, 298 Cr2O3 + 3? G0f, 298C)
Для расчета используем значения? G0f, 298 приведенные в табл.2.
Так как? G0f, 298 простых веществ Cr и С равны нулю, то уравнение упрощается:
?G0298 = 3 моль (-137,3 кДж/моль) — 1 моль (-1046,8 кДж/моль)== -411,9 кДж + 1046,8 кДж = 634,9 кДж.
Вывод: ?G0298 > 0, поэтому в стандартных условиях невозможно самопроизвольное протекание процесса в прямом направлении, т. е. при 298К невозможно восстановить Cr2O3 до Cr.
- 4) Выясняем, возможна ли данная реакция при 1500К. В условиях, отличающихся от стандартных, величина? G0Т рассчитывается по уравнению (7):?GТ = ?H0298 — T? S0298. Рассчитаем тепловой эффект химической реакции при стандартных условиях, используя уравнение (3) и значения? H0f, 298 из табл.2.
- ?H0298 = (2?H0f, 298 Cr + 3? H0f, 298 CO) — (?H0f, 298 Cr2O3 + 3· ?H0f, 298 С).
Но ?H0f, 298 Cr = 0 и? H0f, 298 С = 0, поэтому имеем.
- ?H0298 = 3· ?H0f, 298 CO — ?H0f, 298 Cr2O3,
- ?H0298 = 3 моль (-110,5 кДж/моль) — 1 моль· (-1141,0 кДж/моль) == -331,5 кДж + 1141,0 кДж = 809,5 кДж, ?H0298 > 0, значит реакция эндотермическая.
Определим изменение энтропии реакции при стандартных условиях. Для расчета используем уравнение (4) и значения S0 298 из табл.2.
- ?S0298 = (2S0 298 Cr + 3S0 298 CO) — (S0 298 Cr2O3 + 3S0 298 С),
- ?S0298 = (2 моль23,8 Дж/моль· К + 3 моль197,4 Дж/моль· К) — (1 моль81,1 Дж/моль· К + 3 моль5,7 Дж/моль· К) = 639,8 — 98,2 = 541,6 Дж/К.
- ?S0298 > 0, т. е. реакция сопровождается увеличением энтропии.
Рассчитаем энергию Гиббса химической реакции при Т = 1500К, т. е. величину? G1500: ?G1500 = ?H0298 — 1500? S0298,
?G1500 = 809,5 кДж — 1500К541,6 Дж/К = 809,5 кДж — 1 500 541,6 Дж.
Как видно, члены этого уравнения имеют разную размерность, поэтому приводим их к одной размерности 1 Дж = 1· 10-3 кДж и тогда имеем.
?G1500 = 809,5 — 1 500 541,6/1000 = 809,5 — 812,4 = -2,9 кДж.
Вывод: ?G1500 < 0, значит при 1500К данная реакция протекает самопроизвольно, и при этих условиях можно получить металлический хром.
Таблица 2. Термодинамические величины некоторых веществ в стандартных условиях: ?H0f, 298 кДж/моль, S0 298 Дж/моль· К, ?G0f, 298 кДж/моль.
Вещество. | ?H0f 298. | S0 298. | ?G0f, 298. | Вещество. | ?H0f, 298. | S0 298. | ?G0f, 298. | |
Al (т). | +23,3. | HCl (г). | — 92,3. | +187,6. | — 95,3. | |||
Al2O3(т). | — 1677,0. | +50,9. | — 1576,4. | H2S (г). | — 20,2. | +205,6. | — 33,0. | |
Al2(SO4)3(т). | — 3434,0. | +239,2. | — 3091,9. | H2Se (г). | +86,0. | +221,0. | +71,0. | |
C (т). | +5,7. | H2Te (г). | +154,0. | +234,0. | +138,0. | |||
CO (г). | — 110,5. | +197,4. | — 137,3. | Mg (т). | +32,0. | |||
CO2(г). | — 393,0. | +214,0. | — 394,0. | MgO (т). | — 601,2. | +26,9. | — 569,6. | |
Cl2(г). | +223,0. | MgCO3(т). | — 1096. | +65,7. | — 1029. | |||
CaO (т). | — 635,1. | +29,7. | — 604,2. | MgCl2(т). | — 645,0. | +90,0. | — 595,0. | |
Ca (OH)2(т). | — 966,2. | +83,4. | — 896,8. | N2(г). | +191,5. | |||
CaCO3(т). | — 1206,0. | +92,3. | — 1128,8. | NH3(г). | — 46,2. | +192,5. | — 16,6. | |
Cr (т). | +23,8. | NO (г). | +90,4. | +210,6. | +86,7. | |||
Cr2O3(т). | — 1141,0. | +81,1. | — 1046,8. | NO2(г). | +33,9. | +240,5. | +51,8. | |
Cu (т). | +33,0. | NH4Сl (т). | — 315,4. | +94,5. | — 343,6. | |||
CuO (т). | — 156,0. | +43,0. | — 127,0. | O2(г). | +205,0. | |||
Fe (т). | +27,2. | SO2(г). | — 296,9. | +248,1. | — 300,4. | |||
Fe2O3(т). | — 821,3. | +90,0. | — 741,0. | SO3(г). | — 395,2. | +256,2. | — 370,4. | |
H2(г). | +130,6. | S (т). | +31,9. | |||||
H2O (г). | — 241,8. | +188,7. | — 228,8. | Ti (т). | +31,0. | |||
H2O (ж). | — 285,8. | +70,0. | — 237,5. | TiCl4(г). | — 759,0. | +353,1. | — 714,0. | |