Работа 17.6.2. Определение содержания щелочи в растворе

Следовательно, на титрование половины Na2C03 израсходовано 12,30 — 11,60 = 0,70 мл, а на титрование всего карбоната натрия — 0,70 • 2 = 1,40 мл раствора кислоты. Тогда на титрование NaOH израсходовано 12,30 — 1,40 = 10,90 мл раствора кислоты. Эти данные позволяют вычислить молярную концентрацию эквивалентов анализируемого раствора по NaOH и Na2C03, а также содержание их в растворе. После этого… Читать ещё >
Работа 17.6.2. Определение содержания щелочи в растворе (реферат, курсовая, диплом, контрольная)
Стандартизированный раствор хлороводородной кислоты служит для определения содержания щелочей (их концентрации) в растворах.
Ход определения. В мерную колбу вместимостью 100 мл берут для анализа немного раствора щелочи (NaOH или КОН), доводят объем раствора дистиллированной водой до метки и тщательно перемешивают.
Готовят бюретку, как описано выше (см. работу 17.6.1), для титрования щелочи кислотой. Пипетку промывают анализируемым раствором щелочи, затем 10,0 мл исследуемого раствора переносят пипеткой в коническую колбу, прибавляют каплю метилового оранжевого и титруют раствором кислоты до перехода желтой окраски индикатора в бледно-розовую от одной капли кислоты. Из сходящихся результатов титрования находят среднее. Вычисляют сначала молярную концентрацию эквивалентов щелочи, а затем ее массу в 100 мл анализируемого раствора по формуле.
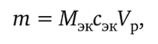
где сэк — молярная концентрация эквивалентов щелочи, моль/л; Мэк — молярная масса эквивалентов щелочи, г/моль; Ур — объем анализируемого раствора, л.
Работа 17.6.3. Определение гидроксида и карбоната натрия при их совместном присутствии в растворе
Гидроксид натрия, как и другие щелочи, поглощает из воздуха оксид углерода (IV) и частично превращается в карбонат натрия:
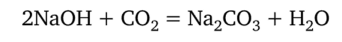
Поэтому нередко определяют содержание NaOH и Na2C03 при совместном присутствии их в растворе. Титрование такого раствора кислотой можно рассматривать как процесс, протекающий в две стадии:
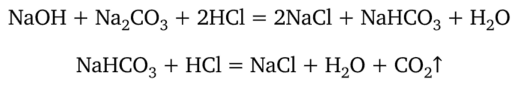
Первая стадия завершается при pH 8,31, когда изменяет окраску фенолфталеин, а вторая — при pH 3,84, т. е. в области перехода окраски метилового оранжевого.
Из уравнений реакции очевидно, что с фенолфталеином оттитровывается весь NaOH и половина карбоната натрия. Оставшуюся половину карбоната натрия дотитровывают с метиловым оранжевым. Точность этого метода, основанного на определении двух точек эквивалентности, не превышает 1%. Объясняется это тем, что в процессе титрования раствор может поглощать оксид углерода (ГУ) из воздуха и часть NaOH будет превращаться в карбонат натрия. Чтобы свести к минимуму это нежелательное явление, соблюдают следующие правила. Раствор щелочи разбавляют водой, свободной от оксида углерода (1У), т. е. прокипяченной и охлажденной в сосуде, имеющем поглотительную трубку с натронной известью. Раствор быстро переносят пипеткой в коническую колбу и тотчас титруют его кислотой, избегая сильного перемешивания (усиливающего поглощение С02 из воздуха). Для титрования приходится брать довольно много (4—5 капель) фенолфталеина, так как небольшие количества его могут обесцвечиваться еще до точки эквивалентности (под действием оксида углерода). Заканчивая титрование раствора с фенолфталеином, кислоту прибавляют медленно, осторожно, чтобы вместо гидрокарбоната натрия не получилась угольная кислота.
Ход определения. В мерную колбу вместимостью 100 мл переносят немного анализируемого раствора, разбавляют его до метки свежей прокипяченной дистиллированной водой и тщательно перемешивают. Отмеряют пипеткой 10,0 мл полученного раствора в коническую колбу и прибавляют 4—5 капель фенолфталеина, который окрасит жидкость в малиновый цвет. Титруют ее раствором НС1 до обесцвечивания, которое должно произойти от одной избыточной капли кислоты. Затраченный объем кислоты соответствует всему определяемому гидроксиду натрия и половине карбоната натрия — УДНС1).
После этого прибавляют к титруемому раствору 1—2 капли метилового оранжевого, в результате чего содержимое колбы окрасится в желтый цвет. Не доливая кислоту в бюретку, продолжают титровать раствор до перехода желтой окраски в бледно-розовую. Записывают второй отсчет — У2(НС1). Расход кислоты на титрование половины карбоната натрия равен: У2(НС1) — У2(НС1).
Точное титрование с фенолфталеином и метиловым оранжевым повторяют 2—3 раза и из сходящихся отсчетов находят средние данные. Вычисляют массы NaOH и Na2C03 в анализируемом растворе.
Допустим, что после титрования раствора с фенолфталеином отсчет объема кислоты оказался равен 11,60 мл (УД, а после титрования с метиловым оранжевым — 12,30 мл (У2).
Следовательно, на титрование половины Na2C03 израсходовано 12,30 — 11,60 = 0,70 мл, а на титрование всего карбоната натрия — 0,70 • 2 = 1,40 мл раствора кислоты. Тогда на титрование NaOH израсходовано 12,30 — 1,40 = 10,90 мл раствора кислоты. Эти данные позволяют вычислить молярную концентрацию эквивалентов анализируемого раствора по NaOH и Na2C03, а также содержание их в растворе.
Например, молярная концентрация эквивалентов раствора по карбонату натрия равна:
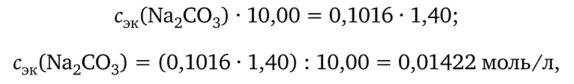
где 0,1016 — молярная концентрация эквивалентов НС1 в растворе, моль/л.
Остается вычислить массу карбоната натрия, содержащуюся в 0,1 л анализируемого раствора:
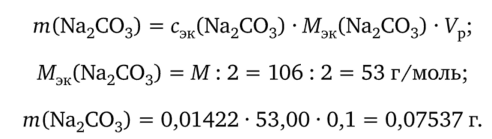
Аналогичным образом вычисляют молярную концентрацию эквивалентов раствора по гидроксиду натрия и его массу в 100 мл раствора.