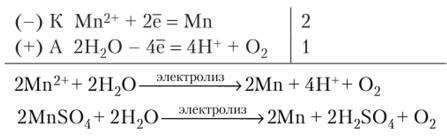Образцы решения задач

Составляем уравнения реакций, протекающих при электролизе водного раствора сульфата марганца (П) с инертными электродами. На катоде восстанавливаются ионы марганца (Н) (восстановлением воды можно пренебречь), на аноде окисляются молекулы воды: Пример 3. Объясните, почему диоксид марганца обладает окислительно-восстановительной двойственностью. Напишите уравнения соответствующих реакций методом… Читать ещё >
Образцы решения задач (реферат, курсовая, диплом, контрольная)
Пример 1. Рассчитайте количество вещества и массу иода (моль, г), образовавшегося по реакции между иодидом калия и перманганатом калия в присутствии серной кислоты, если израсходовано 0,2 л 0,2 н. раствора восстановителя. Уравнение напишите методом ионно-электронного баланса. Укажите окислитель и восстановитель, тип ОВР.
Решение. Напишем уравнение реакции, учитывая, что иодидиои, являясь восстановителем, окислится до свободного иода, а перманганат-ион восстановится до катиона Мп2+:
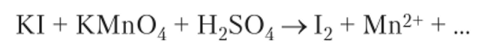
Запишем полуреакции, просуммируем их, допишем недостающие ионы и составим окончательное уравнение: 
Тип ОВР — реакция межмолекулярного окисления-восстановления.
Согласно условию задачи израсходовано 0,2 л 0,2 и. раствора восстановителя (K.I). Учитывая, что См(KI) =, и для К1.
См — - С", находим.
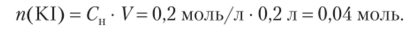
С зачетом коэффициентов из уравнения реакции следует: 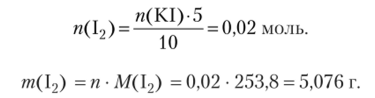 Ответ'. 0,02 моль, 5,076 г.
Ответ'. 0,02 моль, 5,076 г.
Пример 2. Марганец получают электролизом водного раствора сульфата марганца (П) с инертными электродами. Определите массу марганца, который будет получен, если на аноде выделится кислород объемом 56 л (н.у.). Следует учесть, что массовая доля выхода кислорода составляет 100%, а металла — 80%.
Решение.
1. Вычисляем количество вещества кислорода, полученного при электролизе:
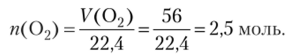
2. Составляем уравнения реакций, протекающих при электролизе водного раствора сульфата марганца (П) с инертными электродами. На катоде восстанавливаются ионы марганца (Н) (восстановлением воды можно пренебречь), на аноде окисляются молекулы воды:
4. Рассчитаем массу марганца (wzTeop), при количественном (100%) выходе металла:
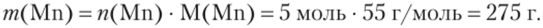
5. Учитывая массовую долю выхода металла, находим массу реально полученного марганца (тр):
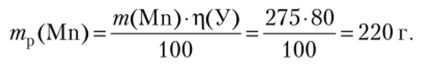
Пример 3. Объясните, почему диоксид марганца обладает окислительно-восстановительной двойственностью. Напишите уравнения соответствующих реакций методом ионно-электронного баланса. Укажите окислитель и восстановитель, тип ОВР.
Решение. Поскольку марганец в диоксиде имеет промежуточную степень окисления +4, он может принимать электроны, понижая при этом свою степень окисления. Чаще всего реакции протекают в кислой среде, и марганец при этом приобретает степень окисления +2. С другой стороны, марганец в диоксиде может повышать свою степень окисления до +6 в щелочной среде с образованием манганатов. Для доказательства окислительных свойств необходимо провести реакцию с типичным восстановителем, например галогенидили халькогенид-ионами. Для доказательства восстановительных свойств необходимо провести реакцию с типичным окислителем, например галогенами, кислородсодержащими ионами галогенов, нитрат-ионами. Напишем уравнения реакций взаимодействия диоксида марганца с бромидом натрия в кислой среде и с хлоратом калия в щелочной среде. В первой реакции Мп02 — окислитель, во второй — восстановитель.
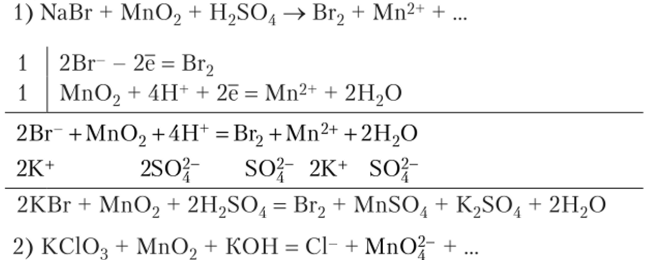
Запишем полуреакции, просуммируем их, допишем недостающие ионы, сократим подобные члены и составим окончательное уравнение:
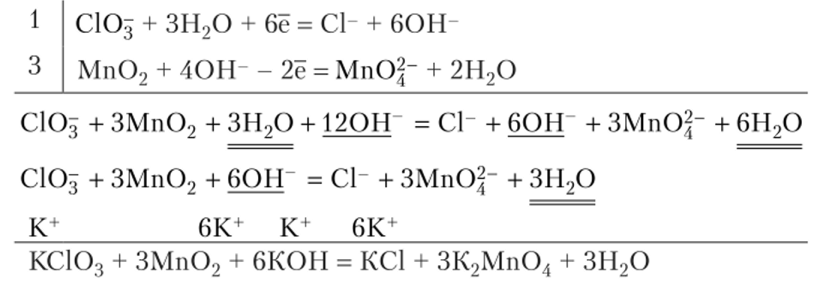
- [1] Из уравнения реакции следует, что