Фазовые равновесия и фазовые переходы
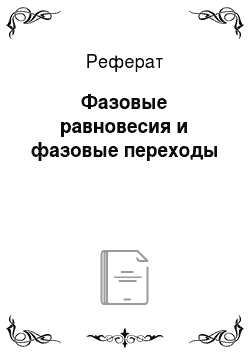
Из диаграммы (рис. 12.1) следует, что жидкая фаза может находиться в равновесии при давлениях не меньше, чем давление в тройной точке. Например, в случае углекислоты () =5,11 атм, поэтому при атмосферном давлении (1 атм.) углекислота может существовать только в твёрдом и газообразном состояниях. Твёрдая углекислота (называемая сухим льдом) на воздухе сублимирует, а не тает (переход 4−5). Для… Читать ещё >
Фазовые равновесия и фазовые переходы (реферат, курсовая, диплом, контрольная)
Фазы вещества. Равновесие фаз. Фазовая диаграмма (диаграмма состояния). Тройная точка. Уравнение Клайперона-Клаузиуса.
Фазой называется макроскопическая физически однородная часть вещества, отделённая от остальных частей системы поверхностью раздела. Фазовое равновесие — одновременное существование фаз в многофазной системе (без изменения одной фазы за счет другой).
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь друг с другом. Такое равновесие наблюдается лишь в ограниченном интервале температур, причём каждому значению температуры соответствует своё значение давления, при котором возможно равновесие. Совокупность состояний равновесия 2-х фаз изображается на диаграмме линией. Три фазы одного и того же вещества (твёрдая, жидкая и газообразная или жидкая и две твёрдых или три твёрдых) могут находиться в равновесии только при единственных значениях температуры и давления, которые на диаграмме соответствует точка, называемая тройной.
В термодинамике доказывается, что равновесие более чем 3-х фаз одного и того же вещества невозможно (и это подтверждено экспериментально).
Диаграмма состояния. (рис. 12.1).
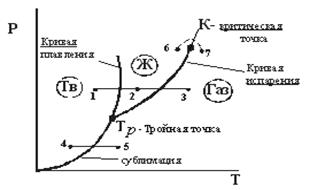
Рис. 12.1. 1-2−3 переход кристалл жидкость газ 4−5 кристалл газ 6−7 переход из жидкости в газ без расслоения на фазы.
Определение. Сублимация (возгонка) — непосредственный (без плавления) переход из кристаллического состояния в газообразное.
Из диаграммы (рис. 12.1) следует, что жидкая фаза может находиться в равновесии при давлениях не меньше, чем давление в тройной точке. Например, в случае углекислоты () =5,11 атм, поэтому при атмосферном давлении (1 атм.) углекислота может существовать только в твёрдом и газообразном состояниях. Твёрдая углекислота (называемая сухим льдом) на воздухе сублимирует, а не тает (переход 4−5). Для большинства же обычных веществ значительно меньше атмосферного давления (например, для =4,58 мм. рт. ст.), поэтому переход из кристаллического состояния в газообразное осуществляется через жидкую фазу.
Кривая испарения заканчивается в критической точке К. Поэтому возможен процесс в обход критической точки К. в этом случае переход из жидкого состояния в газообразное совершается непрерывно (процесс) без расслаивания на две фазы. При температурах выше критической вещество не может быть сжижено никаким сжатием.
Фазовые переходы с поглощением или выделением скрытой теплоты перехода называются фазовыми переходами первого рода. Например, в процессах плавления или кристаллизации. Фазовые переходы, не связанные со скрытой теплотой перехода, называются фазовыми переходами второго рода. Например, переход парамагнетик — ферромагнетик.
Уравнение Клапейрона — Клаузиуса (без вывода).
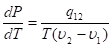
теплота фазового перехода, температура, и объёмы обеих фаз. (и, относятся к одному и тому же количеству вещества, например, к 1 молю или 1 кг, т. е. является удеальными).
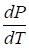
определяет наклон фазовой кривой фазового равновесия Р (Т). Уравнение Клапейрона — Клаузиуса даёт изменение температуры фазового перехода при изменении давления.
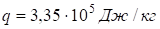
Пример. Для воды (льда) теплота плавления. Разница удельных объёмов льда и воды при 0.
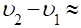
(легко найти из соответствующих плотностей).
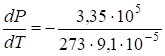
.
То есть, с увеличением давления на одну атмосферу точка плавления льда понижается примерно на 0,0075 град.
Опыт. Если на брусок льда, лежащий своими концами на неподвижных опорах, накинуть проволочную петлю, и к ней подвесить тяжёлый груз, то лёд под проволокой плавится. Вода выдавливается из-под проволоки и замерзает над ней. Проволока постепенно проходит через брусок, однако брусок остаётся неразрезанным.