Особенности локального атомного окружения и электронной структуры иона меди Cu2+ в водных растворах

Где — концентрация раствора в (моль/л); — объем раствора, задаваемый в нашем случае объемом мерного стаканчика, в котором приготовляется раствор (использовались два мерных стаканчика объемом 0,025 и 0,100 л);- молярная масса растворяемого вещества. В результате получаем в граммах. ионный раствор медь спектроскопия Растворы были приготовлены следующим образом: половина необходимого объема… Читать ещё >
Особенности локального атомного окружения и электронной структуры иона меди Cu2+ в водных растворах (реферат, курсовая, диплом, контрольная)
В настоящей статье речь пойдет об исследовании окружения иона меди Cu2+ в водных растворах методами рентгеновской спектроскопии поглощения (XAS — X-ray Absorption Spectroscopy). Данная задача была поставлена с целью отладки методики расчетов околопороговой тонкой структуры спектров рентгеновского поглощения (далее XANES — X-ray Absorption Near Edge Structure) за K-краем Cu (8979 эВ для медной фольги) в координационных комплексах иона Cu2+.
Результаты этой работы, в частности, будут в дальнейшем использованы для структурного XANES-анализа центра связывания Cu2+ в в-амилоиде [1,2].
Однако, необходимо отметить, что эта задача несомненно представляет и самостоятельный интерес. В настоящее время хорошо установлено, что для глубокого понимания многих химических свойств ионных растворов необходимо точное знание их координационной структуры.
Данной тематике посвящено большое количество работ [3, 4], и для многих ионов металлов структура первой, а в некоторых случаях и второй гидратационных оболочек достаточно хорошо известна. В противоположность этому, геометрия окружения иона Cu2+ в водном растворе не вполне понятна и является предметом современных исследований. Повышенный интерес обусловлен также тем, что медь является одним из наиболее важных переходных металлов в биологических системах.
Перед тем, как начать обзор литературы по структурным исследованиям аквакомплексов иона Cu2+ в водных растворах, необходимо сказать несколько общих слов о стереохимии соединений двухвалентной меди вообще.
В природе в подавляющем числе случаев встречается три типа координации Cu2+: Ян-Теллеровски искаженная октаэдрическая координация с 4 короткими (экваториальными) и 2 длинными (осевыми) междуатомными расстояниями, плоская квадратная координация и тетраэдрическая [5].
Плоское квадратное окружение можно рассматривать как предельный случай искаженного октаэдрического с бесконечно длинными осевыми расстояниями. Тетраэдрические же соединения малочисленны, поэтому основным типом координации Cu2+ является искаженная октаэдрическая.
Необходимо отметить, что этот тип окружения является отличительным свойством меди, выделяющим ее в ряду двухвалентных ионов других 3d-металлов, таких как Co, Zn, Ni, обладающих регулярной октаэдрической координацией с шестью одинаковыми расстояниями.

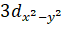
В случае же иона меди Cu2+ в регулярном октаэдрическом поле дублет электронных состояний должен быть заполнен тремя электронами, что можно сделать двумя способами: 2 электрона на и 1 на, или наоборот.
Таким образом, энергетический терм является вырожденным, и в результате эффекта Яна-Теллера происходит искажение окружения, понижающее симметрию до D4h и снимающее это вырождение.
В соответствии с вышесказанным на протяжении последних 50 лет предполагалось, что ионы Cu2+ в водных растворах представлены в основном 6-координированными аквакомплексами Cu (H2O)62+ с Ян-Теллеровски искаженной октаэдрической симметрией.
Однако, результаты, получаемые с помощью различных экспериментальных методов, такие как рентгеновская дифракции (XRD), дифракция нейтронов (ND) и спектроскопия рентгеновского поглощения (XAS) приводили к различным значениям длин связи. Так, например, расстояние до осевых атомов кислорода варьировалось от 2,1 до 2,6 Е [6], что с химической точки зрения является очень большой неопределенностью.
Одной из причин, осложняющих определение структурных параметров, является тот факт, что структура аквакомплексов не статична и может иметь несколько различных конфигураций, в которых анионы растворяемых солей замещают одну или несколько молекул воды из гидратационной оболочки иона.
Таким образом, при структурном анализе приходится учитывать все возможные варианты. В некоторых случаях, как например, в водных растворах хлорида меди CuCl2, ион хлора может вытеснить молекулу воды из осевого узла, образуя хлорокупратный аквакомплекс Cu (H2O)52+Cl-. При этом расстояниеR (Cu-Clax) близко к расстояниям R (Cl-H2O) иR (H2O — H2O), что существенно затрудняет извлечение структурной информации из данных XRD [7] и ND [8].
Более того, существует возможность уменьшить влияние конфигураций, содержащих анионы солей, исследуя растворы маленькой концентрации. Однако, это также осложняет дифракционные исследования в связи с возрастающим соотношением сигнал/шум и не имеет смысла в тех случаях, когда представляет интерес некоторая определенная концентрация.
В этом плане спектроскопия XAS является очень перспективным методом, так как она обладает элементной чувствительностью и позволяет исследовать локальную геометрическую вокруг интересующих атомов, а так же и электронную структуру. При этом с использованием синхротронного излучения становится возможным исследовать растворы в широком диапазоне концентраций растворенного вещества, включая сильно разбавленные растворы с молярностью порядка 1 mM [9].
Экспериментальная часть
Было приготовлено шесть образцов:
- 1. Водный раствор CuCl2*2(H2O) с концентрацией 0,1 M;
- 2. Водный раствор CuCl2*2(H2O) с концентрацией 1,0 M;
- 3. Водный раствор CuCl2*2(H2O) с концентрацией 1,9 M;
- 4. Раствор CuCl2*2(H2O) в ацетоне (C3H6O) с концентрацией? 0,1 M;
- 5. Раствор CuCl2*2(H2O) в водном растворе этилового спирта с концентрацией 0,1 M;
- 6. Порошок 2-водного кристаллогидрата CuCl2*2(H2O).
Растворы 1−5 были получены путем растворения необходимого количества 2-водного кристаллогидрата хлорида меди (II) CuCl2*2(H2O) в соответствующих растворителях при комнатной температуре и нормальном атмосферном давлении.
Масса растворяемого порошка, необходимого для получения раствора заданной концентрации (молярности), рассчитывалась по формуле (1):
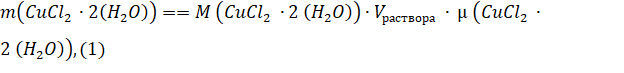
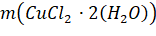
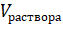
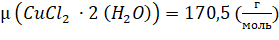
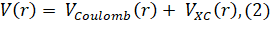
где — концентрация раствора в (моль/л); - объем раствора, задаваемый в нашем случае объемом мерного стаканчика, в котором приготовляется раствор (использовались два мерных стаканчика объемом 0,025 и 0,100 л);- молярная масса растворяемого вещества. В результате получаем в граммах. ионный раствор медь спектроскопия Растворы были приготовлены следующим образом: половина необходимого объема растворителя помещалась в мерную колбу, на аналитических весах отбиралась необходимая масса растворяемого вещества и в мерной колбе смешивалась с растворителем до полного растворения. Далее мерная колба заполнялась растворителем до необходимого объема.
Для образов, описанных выше, были получены экспериментальные XANES спектры за K-краем меди. Измерения проводились на синхротроне национального исследовательского центра «Курчатовский институт» на станции «Структурное материаловедение» (СТМ).
Все спектры были измерены в диапазоне энергий рентгеновского фотона от 8750 эВ (? 229 эВ до K-края медной фольги) до 9875 эВ (? 896 эВ за K-краем медной фольги, длина волны фотоэлектрона? 15 Е-1).
Измерения спектров растворов 2, 3 (водные растворы CuCl2*2(H2O) с концентрациями 1,0 и 1,9 M соответственно) и порошка 2-водного кристаллогидрата CuCl2*2(H2O) проводились в режиме «на прохождение». Растворы были помещены в узкие кюветы (шириной до 1 мм) заклеенные с двух сторон каптоновым скотчем.
Для контроля энергии фотонов, отраженных от кристалла-монохроматора, при каждой регистрации спектра образца измерялся спектр стандарта (медной фольги).
При обработке спектров положению CuK-края медной фольги приписывалось табличное значение 8979 эВ, что позволяло получить спектры в абсолютной шкале энергии фотонов. Для каждого образца было измерено по одному спектру (по одному «проходу»).
Измерение спектров растворов 1, 4 и 5 (? 0,1 M растворы CuCl2*2(H2O) с различными растворителями: вода, ацетон и водный раствор этилового спирта соответственно) проводилось с помощью регистрации флуоресцентного излучения. Образцы находились в пробирках Эппендорфа. В связи с сильным поглощением рентгеновского излучения, проходящего через образец, спектры стандартов измерить не удалось.
Однако, обработка спектров растворов 2, 3 и образца 6, показала, что сдвиг энергетической шкалы при проведении серии измерений составляет не более 0,2 эВ, что позволяет представить результаты для образцов 1, 4 и 5 так же в абсолютной шкале энергии.
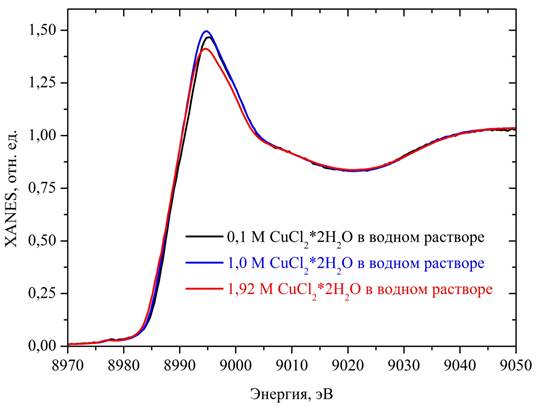
Рис. 1. — Экспериментальные XANES спектры CuK-края водных растворов CuCl2· 2(H2O) различной концентрации: 0,1 М (черные линии), 1,0 М (синие линии) и 1,9 M (красные линии).
На рис. 1 представлены XANES спектры для водных растворов CuCl2*2(H2O) различных концентраций: наблюдаются небольшие отличия в области «белой линии».
Они более отчетливо видны на графике производных спектров (Рис. 2): с увеличением концентрации раствора от 0,1 до 1,0 М наблюдается перераспределение интенсивностей максимумов a и b (a — уменьшается, b — увеличивается, становится шире и сдвигается в сторону меньших энергий).
При концентрации 1,9 М говорить о наличии двух максимумов a и b сложно из-за относительно большого шума. Однако, в этом случае наблюдается особенность a' (эту ситуацию можно интерпретировать как переход a > a' + уширение и сдвижка в область меньших энергий максимума b).

Рис. 2. — Первая производная коэффициента рентгеновского поглощения экспериментальныхXANES спектров заK-краемCu водных растворов CuCl2· 2(H2O) различной концентрации: 0,1 М (черные линии), 1,0 М (синие линии) и 1,9 M (красные линии).
Отладка методики расчета спектров XANES и оптимизация неструктурных параметров
Расчеты спектров XANES CuK-края для аквакомплексов меди проводились в программном коде FDMNES[10].
Эффективный одноэлектронный потенциал (2), используемый в FDMNES, состоит из двух частей:
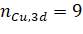
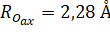
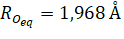
Кулоновской и обменно-корреляционной .
Кулоновская часть находится из уравнения Пуассона для суперпозиции электронных плотностей изолированных атомов с контролируемыми числами заполнения орбиталей (3):
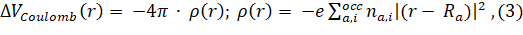
Для обменно-корреляционной части используется формулировка Хедина-Ландквиста[11]. Очень важной особенностью программного комплекса FDMNES является возможность проводить расчеты в полном потенциале, т. е. без использования маффинтин приближения. Эта возможность реализуется в методе конечных разностей. Необходимо отметить, что расчеты методом конечных разностей очень трудоемкие и требуют значительно больше вычислительного времени.
Отладка методики расчета спектров состояла из «оптимизации» чисел заполнения атомных состояний, которые используются для построения электронной плотности (см. формулу (3)).
Для этого были проведены расчеты для различных электронных конфигураций иона меди Cu2+. Изолированный атом меди имеет электронную конфигурацию [Ar]3d104s1, ион Cu2+ — [Ar]3d9.

Однако формальный заряд иона меди как в аквакомплексе, так и в других ионных соединениях, может сильно отличаться от реального. В случае ионных соединений 3d-переходных металлов разработчики программы FDMNES рекомендуют для имитирования переноса заряда использовать число заполнения 3d орбиталей такое же, как при формальном заряде (в нашем случае), но сохранить нейтральность атома, разместив соответствующее число электронов на 4s— и 4p-орбитали, имеющие большие радиусы.
Были проведенырасчёты следующих конфигураций:
- 1. [Ar]3d94s04p0 (медь имеет заряд +2);
- 2. [Ar]3d94s04p2;
- 3. [Ar]3d94s14p1;
- 4. [Ar]3d94s24p0;
- 5. [Ar]3d94s04p0 с использованием процедуры самосогласования.
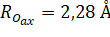
В качестве модели аквакомплекса использовалась структура, полученная в работе [12] - медь + первая гидратационная оболочка, представляющая Ян-Теллеровски искаженный кислородный октаэдр с расстояниями и и атомами водорода в так называемой дипольной конфигурации. Молекулы воды ориентированы, как показано на рис. 3.
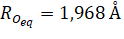
Точечная группа аквакомплекса — D2h.
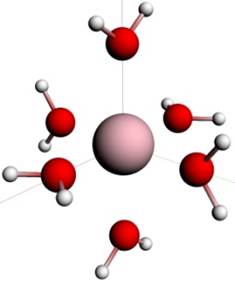
Рис. 3. — Модель аквакомплекса иона меди Cu2+.
Расчет сечений проводился с учетом электрических дипольных и квадрупольных переходов методом конечных разностей в полном потенциале с обменно-корреляционной частью в виде потенциала Хедина-Ландквиста. Потенциал остовной вакансии на 1s-уровне был учтен искусственным перебросом остовного электрона на первую не полностью заполненную орбиталь (3d). Результаты расчетов представлены на рис. 4.
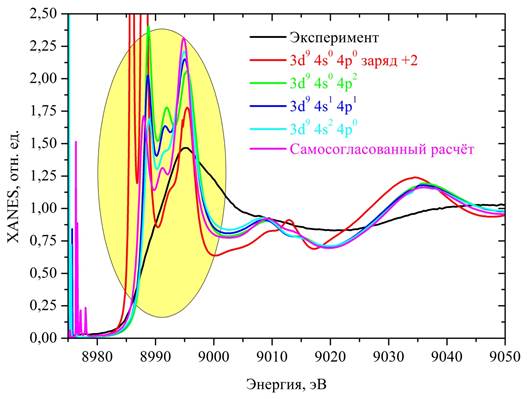
Рис. 4. — XANES спектры CuK-края аквакомплексов меди: черная линия — экспериментальный спектр водного раствора CuCl2*2(H2O) концентрации 0,1 М, красная линия — теоретический спектр для 3d94s04p0 электронной конфигурации меди, зеленая линия — теоретический спектр для 3d94s04p2 электронной конфигурации меди, синяя линия — теоретический спектр для 3d94s14p1— электронной конфигурации меди, голубая линия — 3d94s24p0электронной конфигурации меди, розовая линия — теоретический расчет с учетом самосогласования
На Рис. 4 представлены XANES спектры CuK-края аквакомплексов меди: черная линия — экспериментальный спектр водного раствора CuCl2*2(H2O) концентрации 0,1 М, цветные линии — теоретические спектры, полученные при использовании различных электронных конфигураций иона меди (см. подписи на картинке).
Теоретические спектры представлены без учёта экспериментального уширения, уширения внутреннего уровня и уширения связанного со временем жизни остовной вакансии.
Из качественного сравнительного анализа теоретических и экспериментальных спектров на рис. 5 видно, что лучшее согласие с экспериментом достигается при использовании электронных конфигураций, соответствующих нейтральному атому меди, и при самосогласованном расчете. Чувствительность же спектров к различным электронным конфигурациям 4s— и 4p-орбиталей проявляется главным образом в области основного максимума (белой линии, 8985−9000 эВ).
Рис. 5 показывает область белой линии XANES спектров Cu K-края аквакомплексов меди: черная линия — экспериментальный спектр водного раствора CuCl2*2(H2O) концентрации 0,1 М, цветные линии — теоретические спектры, полученные при использовании различных электронных конфигураций иона меди (см. подписи на картинке).
При «перебросе» электронов с 4s на 4p наблюдается увеличение интенсивностей пиков A' и А" и уменьшение пика А. Поскольку в эксперименте в области энергий, соответствующей пику A", наблюдается лишь слабовыраженное плечо S, значительно уступающее в интенсивности главному максимуму, то ясно, что расчетный спектр для электронной конфигурации [Ar]3d94s24p0 лучше остальных соответствует эксперименту.
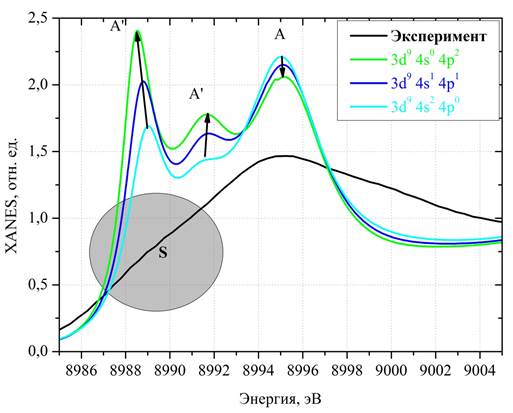
Рис. 5. — XANES спектры CuK-края аквакомплексов меди: черная линия — экспериментальный спектр водного раствора CuCl2*2(H2O) концентрации 0,1 М, зеленая линия — теоретический спектр для 3d94s04p2электронной конфигурации меди, синяя линия — теоретический спектр для 3d94s14p1-электронной конфигурации меди, голубая линия — 3d94s24p0электронной конфигурации меди
Заключение
По итогам проведенного исследования, можно сделать вывод, что более правильным подходом является использование самосогласованного потенциала.
Однако, процедура самосогласования, реализованная в коде FDMNES, использует МТ-приближение, не вполне обоснованное для рассматриваемой нами задачи.
В связи с этим, а также с тем, что различие между спектрами, полученными для самосогласованного потенциала и для электронной конфигурации [Ar]3d94s24p0, незначительны, подход, основанный на искусственном перебросе электрона на 4s-орбиталь является вполне приемлемым, и дальнейшие расчеты будут проводиться в его рамках.
Благодарность: Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 14−02−31 790 мола и Совета по грантам Президента Российской Федерации (стипендия для молодых учёных СП-2373.2013.5).
Авторы благодарны Я. В. Зубавичусу и коллективу станции Структурное материаловедение Курчатовского института за помощь в проведении экспериментов и В. Н. Дацюкуза выделение компьютерного времени вычислительного кластера ЮГИНФО для проведения расчётов.
- 1. V. A. Streltsov, S. J. Titmuss, V. C. Epa, K. J. Barnham, C. L. Masters, andJ. N. Varghese // Biophysical Journal.2008. № 95. p. 3447.
- 2. А. P. Chaynikov, M. A. Soldatov, V. Streltsov, and A. V. Soldatov// Journal of Physics: Conference Series.2013. № 430.p. 12 042.
- 3. Кременная М. А., Солдатов М. А., Чайников А. П., Подковырина Ю. С., Бугаев А. Л., Ломаченко К. А., Кравцова А. Н. Рентгеноспектральное исследование и компьютерное моделирование локальной атомной структуры центра связывания иона меди в бета амилоиде // Инженерный вестник Дона, 2013, № 2, URL: ivdon.ru/ru/magazine/archive/n2y2013/1640.
- 4. Положенцев О. Е., Гуда А. А., Сафонова О. В., Ван Бокховен Д.А.и Солдатов А. В. Методика in-situ исследования катализаторов с помощью спектроскопии рентгеновского поглощения// Инженерный вестник Дона, 2013, № 2, URL: ivdon.ru/ru/magazine/archive/n2y2013/1649.
- 5. L. E. OrgelandJ. D. Dunitz // Nature. 1957. № 179. p. 462.
- 6. H. OhtakiandT. Radnai // ChemicalReviews. 1993. № 93. p. 1157.
- 7. M. Magini //The Journal of Chemical Physics. 1981. № 74. p. 2523.
- 8. S. Ansell, R. H. Tromp, and G. W. Neilson // Journal of Physics: Condensed Matter. 1995. № 7. p. 1513.
- 9. M. Benfatto, P. D’Angelo, S. Della Longa, and N. Pavel // Physical Review B. 2002. № 65.p.174 205.
- 10. O. Bunгu and Y. Joly // Journal of Physics: Condensed Matter. 2009. № 21. p. 345 501.
- 11. L. Hedin and B. I. Lundqvist //Journal of Physics C: Solid State Physics. 1971. № 4. p. 2064.
- 12. P. D’Angelo, E. Bottari, and M. R. Festa // The Journal of Chemical Physics. 1997. № 107. p. 2807.
References
- 1. V. A. Streltsov, S. J. Titmuss, V. C. Epa, K. J. Barnham, C. L. Masters, andJ. N. Varghese. Biophysical Journal. 2008. № 95. p. 3447.
- 2. А. P. Chaynikov, M. A. Soldatov, V. Streltsov, and A. V. Soldatov. Journal of Physics: Conference Series. 2013. № 430. p. 12 042.
- 3. Kremennaja M.A., Soldatov M.A., Chajnikov A.P., PodkovyrinaJu.S., Bugaev A.L., Lomachenko K.A., Kravcova A.N. Inћenernyj vestnik Dona (Rus), 2013, № 2, URL: ivdon.ru/ru/magazine/archive/n2y2013/1640.
- 4. Polozhencev O.E., Guda A.A., Safonova O.V., Van Bokhoven D.A. and Soldatov A.V. Inћenernyj vestnik Dona (Rus), 2013, № 2, URL: ivdon.ru/ru/magazine/archive/n2y2013/1649.
- 5. L. E. OrgelandJ. D. Dunitz.Nature. 1957. № 179. p. 462.
- 6. H. OhtakiandT. Radnai.ChemicalReviews. 1993. № 93. p. 1157.
- 7. M. Magini. The Journal of Chemical Physics. 1981. № 74. p. 2523.
- 8. S. Ansell, R. H. Tromp, and G. W. Neilson. Journal of Physics: Condensed Matter. 1995. № 7. p. 1513.
- 9. M. Benfatto, P. D’Angelo, S. Della Longa, and N. Pavel. Physical Review B. 2002.№ 65.p. 174 205.
- 10. O. Bunгuand Y. Joly. Journal of Physics: Condensed Matter. 2009. № 21. p. 345 501.
- 11. L. Hedin and B. I. Lundqvist. Journal of Physics C: Solid State Physics. 1971. № 4. p. 2064.
- 12. P. D’Angelo, E. Bottari, and M. R. Festa. The Journal of Chemical Physics. 1997. № 107. p. 2807.
Аннотация
Особенности локального атомного окружения и электронной структуры иона меди Cu2+в водных растворах. М. А. Солдатов, М. А. Кременная, Южный федеральный университет, Ростов-на-Дону. А. П. Чайников, Ростовский государственный университет путей сообщения Исследование окружения иона меди Cu2+ в водных растворах было проведено методами рентгеновской спектроскопии поглощения. Были измерены спектры рентгеновского поглощения для различных концентраций водных растворов CuCl2.
Была проведена отладка методики расчётов околопороговой тонкой структуры спектров рентгеновского поглощения за K-краем Cu в координированных комплексах иона Cu2+ методом конечных разностей для решения уравнения Шредингера. Проведены расчеты для различных электронных конфигураций иона меди Cu2+. Предложена модель локального окружения иона меди Cu2+в водных растворах.
Ключевые слова: спектроскопия рентгеновского поглощения, ионы 3dметаллов, водные растворы, локальное окружение, метод конченых разностей, координационные комплексы.