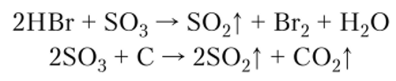Сера.
Общая и неорганическая химия для фармацевтов

Химические свойства. Серный ангидрид — одно из самых реакционноспособных соединений. S03 бурно растворяется в воде с выделением больтого количества теплоты и образованием сильной серной кислоты, проявляет все свойства кислотных оксидов: Растворы сульфитов подвергаются сильному гидролизу с образованием щелочной среды, что объясняет выпадение основных солей при осаждении раствором Na2S03 сульфитов… Читать ещё >
Сера. Общая и неорганическая химия для фармацевтов (реферат, курсовая, диплом, контрольная)
Сера S — твердое хрупкое вещество желтого цвета, не растворяется в воде, растворяется в сероуглероде (CS2), бензоле. Сера имеет три аллотропные модификации: две из них — кристаллические вещества (ромбическая и моноклинная сера имеют одинаковый состав молекул S8, но различные структуры кристаллов), а третья (пластическая сера) — неустойчивое, аморфное вещество. Ромбическая и моноклинная сера являются примером полиморфизма — явления, при котором молекулы одного состава имеют разное кристаллическое строение.
Получение. В промышленности серу добывают из природных месторождений элементарной серы, а также получают частичным окислением H2S при недостатке 02: 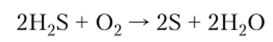
Химические свойства. Сера соединяется практически со всеми металлами и неметаллами.
1. Взаимодействие с неметаллами:

2. Взаимодействие расплавленной 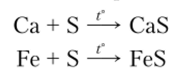 серы с металлами:
серы с металлами:
Взаимодействие со ртутью протекает при комнатной температуре:
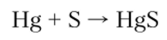
3. Атомы серы из простого вещества способны присоединяться к сере из сложного вещества, образуя полисульфидные цепочки:
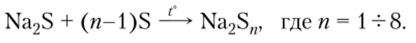
4. В реакциях с сильными окислителями сера проявляет восстановительные свойства:
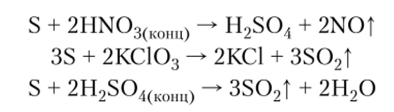
5. В растворах щелочей диспропорционирует:
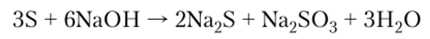
Сероводород.
Сероводород H2S — ядовитый бесцветный газ с запахом тухлых яиц, хорошо растворяется в воде. Для серы свойственно также образование полисульфанов H2Sп. Соединения с числом атомов серы п = 2-^8 выделены в индивидуальном состоянии, более высокие гомологи существуют в виде смесей. Полисульфаны неустойчивы и легко диспропорционируют на сероводород и свободную серу.
Получение. В промышленности сероводород образуется при взаимодействии серы с водородом, часто является нежелательным продуктом химического производства: 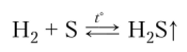
В лаборатории сероводород получают в аппарате Киппа при взаимодействии сульфидов металлов и кислоты:
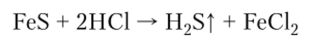
Химические свойства сероводорода заключаются в следующем.
1. Раствор сероводорода в воде — слабая двухосновная кислота; ее средние соли называются сульфидами:
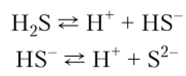
2. С избытком кислорода газ образует взрывчатую смесь:
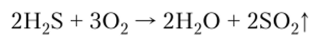
При недостатке 02 наблюдается осаждение вещества желтого цвета:
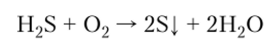
3. Сероводород реагирует со щелочами с образованием кислых или средних солей:

4. Способность сероводорода осаждать сульфиды из растворов солей используется в аналитической химии как качественная реакция на катионы:
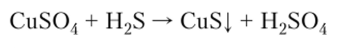
Большинство сульфидов нерастворимо в воде, цвет осадков нерастворимых сульфидов: CuS — коричневый, ZnS — белый, PbS — черный, HgS — красный.
5. Растворимые сульфиды в водных растворах легко подвергаются гидролизу по аниону с образованием щелочной среды:
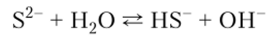
6. Сероводород и все сульфиды являются сильными восстановителями, в растворах окисляются до серы или сульфат-аниона: 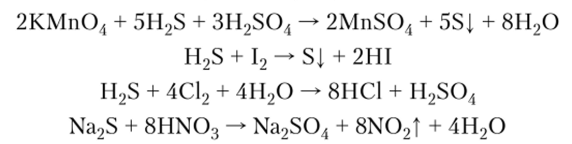
7. Реакция сероводорода с диоксидом серы имеет практическое применение для регенерации серы из отходящих газов металлургического производства:
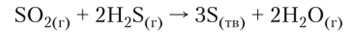
Кислородсодержащие соединения серы приведены в табл. 16.4.
Таблица 16.4
Кислородсодержащие соединения серы.
Степень окисления. | (+4). | (+6). |
Оксид. | so2 | SO;,. |
Кислота (соль). | H2SO:) сернистая (сульфит). | H2so< серная (сульфат). |
Соединения серы (1У) Диоксид серы (или сернистый газ) S02 — бесцветный токсичный газ с резким удушливым запахом, хорошо растворим в воде. Молекула S02 изоэлектропна молекуле озона и также имеет угловую форму, но кратность связи равна двум (рис. 16.2).
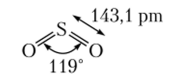
Рис. 16.2. Химическое строение молекулы сернистого газа.
Угловое строение и локализация электронной пары на атоме серы объясняют полярность молекулы и высокую реакционную способность.
В промышленности S02 получают при сжигании самородной серы:
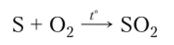
а также обжигом руд, содержащих серу:
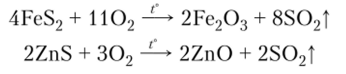
Возможные лабораторные способы получения:
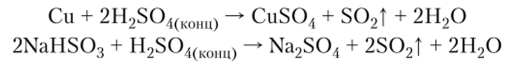
Химические свойства диоксида серы заключаются в следующем.
1. Сернистый газ — кислотный оксид, с характерными для таких оксидов свойствами:
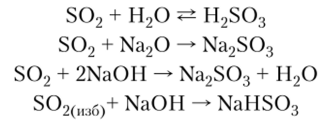
2. S02 может активно реагировать с галогенами:
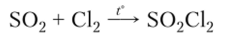
диоксодихлорид серы (1У), или хлористый тионил.
3. Проявляет восстановительные и окислительные свойства:
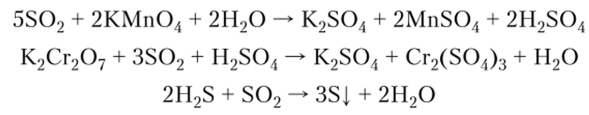
4. Сернистая кислота H2S03 — неустойчивое соединение, двухосновная кислота средней силы (по первой ступени):

Сернистая кислота является фактически водным раствором оксида серы (1У), поэтому ее химические свойства идентичны свойствам водного раствора S02.
Как двухосновная кислота H2S03 образует соли — сульфиты и гидросульфиты (Na2S03, NaHS03), которые являются хорошими восстановителями:
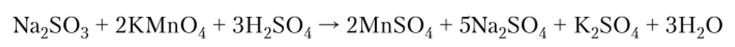
При нагревании сульфиты металлов разлагаются:

Растворы сульфитов подвергаются сильному гидролизу с образованием щелочной среды, что объясняет выпадение основных солей при осаждении раствором Na2S03 сульфитов многовалентных металлов, например NaMg2(OH)(S03)2:
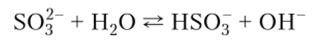
Гидросульфиты существуют только в водных растворах.
При восстановлении сульфитов получают соли дитионистой кислоты H2S204 — дитиониты:
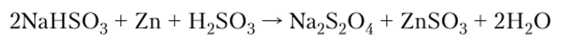
Соединения серы (У1).
Триоксид серы, или серный ангидрид. Шестивалентное состояние атома серы возможно только с кислородом и фтором.
S03 при обычных условиях — бесцветная жидкость (?кип = 45°С), которую получают в промышленных масштабах в процессе производства серной кислоты:
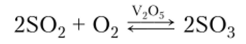
Молекулы S03 имеют форму правильного треугольника с нулевым дипольным моментом.
Химические свойства. Серный ангидрид — одно из самых реакционноспособных соединений. S03 бурно растворяется в воде с выделением больтого количества теплоты и образованием сильной серной кислоты, проявляет все свойства кислотных оксидов:
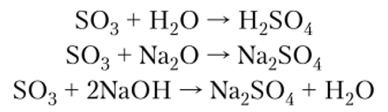
S03 является сильным окислителем: