Электропроводность ионообменных мембран в растворах карбоновых кислот
В работе впервые приводятся экспериментальные результаты изучения концентрационной зависимости электропроводности гетерогенных ионообменных мембран, находящихся в контакте с растворами слабых электролитов — карбоновых кислот. Показано, что в этом случае удельная электропроводность мембран выше, чем электропроводность раствора, при этом электропроводность катионообменных мембран практически… Читать ещё >
Электропроводность ионообменных мембран в растворах карбоновых кислот (реферат, курсовая, диплом, контрольная)
Ионообменные мембраны и процессы с их использованием находят широкое применение: в водоподготовке (питьевая вода, высокоочищенная вода для ТЭЦ и химических производств), в пищевой промышленности (переработка молочных продуктов, соков, вина), в энергетике (топливные элементы, обратный электродиализ), в новых направлениях «зеленой химии» — разделении продуктов ферментации биомассы (аминокислоты, биотопливо, молекулы для производства пластиков, в том числе биоразлагаемых); в аналитической химии (предконцентрирование растворов, мембранные сенсоры), в медицине и др. [1].
Традиционной областью применения ионообменных мембран является водоподготовка [1]. Электродиализ, как метод опреснения, используются с 1950 г. для получения чистой воды и концентрата из солоноватых вод. Однако, на сегодняшний день, за редким исключением [2], электродиализ вытеснен с данного рынка обратным осмосом [3]. В связи с этим, появляется всё больше работ, посвящённых применению электромембранных процессов в растворах, содержащих органические вещества или растворители. Большое число работ в этом направлении посвящено применению биполярного электродиализа для выделения органических кислот: уксусной, лимонной, молочной и др. [4]. Традиционным путём получения этих кислот в промышленности является ферментация мелассы, сахаров или продуктов гидролиза крахмала. На дальнейших стадиях в ферментированную массу добавляют серную кислоту, что приводит к снижению растворимости органических кислот с последующим их осаждением. Полученный раствор отфильтровывают для выделения кислоты. Недостатком данного метода является образование большого количества побочных веществ с высоким содержанием солей, порождающих проблему их утилизации.
С другой стороны, электродиализ находит своё применение при переработке амфолит содержащих растворов, таких как вино (при этом удаляется гидротартрат калия) [5], природная вода (как правило содержащая гидрокарбонат ионы) [6], растворы аминокислот [7].
В случае, когда речь идёт о применении электродиализа для переработки растворов содержащих органические растворители список известных работ гораздо меньше. Стоит отметить работы, в которых изучалось поведение индивидуальных ионообменных мембран в растворах, содержащих диметилацетамид, воду и хлорид лития [8], а также электродиализной переработке схожего по составу раствора [9].
Наиболее перспективные мембраны для конкретных электромембранных технологий выбираются путем изучения их основных физико-химических свойств. Одной из наиболее важных характеристик ионообменных мембран является их удельная электропроводность. Изучение концентрационной зависимости электропроводности позволяет получить основную информацию для расчета транспортно-структурных свойств мембран [10]. электропроводность инообменный мембрана карбоновый Целью данной работы являлось изучение концентрационной зависимости электропроводности ионообменных мембран в растворах некоторых карбоновых кислот и их солей, а также расчёт траспортно-структурных параметров мембран, на основании этой зависимости.
Объекты исследования В качестве объектов исследования были выбраны гетерогенные ионообменные мембраны МК-40, МА-41 (Щёкиноазот, Россия) [11] и Ralex CM, Ralex AMH (Mega a.s., Чехия) [12].
Все изучаемые гетерогенные мембраны получены методом горячего прессования (МК-40, МА-41) или вальцевания (Ralex CM, Ralex AMH) термопластичной смеси, состоящей из тонкодисперсного порошка ионита и полиэтилена, в примерной пропорции 2:1. Ионит, использованный при производстве мембран МК-40, МА-41, Ralex CM и Ralex AMH относятся к классу полимеров, полученных сополимеризацией полистирола с дивинилбензолом. По природе ионогенных групп мембраны МК-40 и Ralex CM — сильнокислотный катионообменные с сульфокислотными ионогенными группами, МА-41, Ralex AMH — сильноосновные анионообменные с четвертичными аммониевыми основаниями.
Физико-химические характеристики мембран, предоставленные изготовителями приведены в таблице 1 [11, 12].
Таблица 1.
Физико-химические параметры исследуемых мембран.
Мембрана. | Ralex CM. | Ralex AMH. | MK-40. | MA-41. | |
Ионогенная группа. | — SO3- | — N+(CH3)3 | — SO3- | — N+(CH3)3 | |
Ионит. | ; | ; | КУ-2−8. | АВ-17−8. | |
Инертное связующее. | Полиэтилен. | ||||
Армирующая ткань. | Полиэстер | Капрон. | |||
Ионообменная ёмкость*, ммоль/г-наб. | 1.12. | 0.86. | 1.08. | 0.91. | |
Число переноса, %. | >0.95. | >0.95. | |||
Влагосодержание W, %. | |||||
Толщина в набухшем состоянии*, мкм. | |||||
Перед исследованиями все мембраны подвергались стандартной предподготовке [13]. Данная процедура предусматривает: обработку поверхности четыреххлористым углеродом для обезжиривания; выдерживание в этиловом спирте, в течение 6 часов для удаления остатков мономеров и олигомеров из ионообменной смолы; перевод в солевую форму ионогенных групп мембраны, выдерживание мембраны в избыточном объёме (?20 объёмов мембраны) 1 М раствора рабочего реагента в течении 24 ч; отмывку полученных мембран деионизованной водой до постоянного значения электропроводности промывной воды.
Мембраны, подготовленные указанным способом, уравновешивались с рабочим раствором, в котором хранились до проведения исследования.
Изучение электропроводности ионообменных мембран
Для изучения электропроводности мембран применялся ртутно-контактный метод [14]. В данном методе мембрана заключается между двумя электродами, выполненными из металлической ртути благодаря чему, достигается идеальное прилегание поверхности электрода к мембране. Собственное сопротивление ртути ничтожно мало, по сравнению с сопротивлением мембраны, что позволяет отнести всю измеренную величину к сопротивлению только мембраны. Кроме того, в данном методе исследованная мембрана находится в воздушно-сухом состоянии, таким образом исключается образование границ электрод/раствор и раствор/мембрана, имеющих не омическую природу.
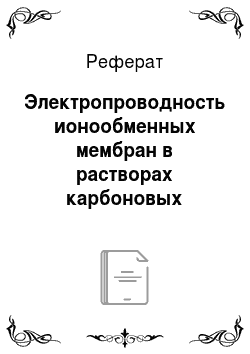
Для получения значения сопротивления ртутно-контактную ячейку с мембранной подключали к измерителю импеданса PARSTAT 4000 (рис. 1 а). Подключение проводилось по двухэлектродной схеме.
а) б).
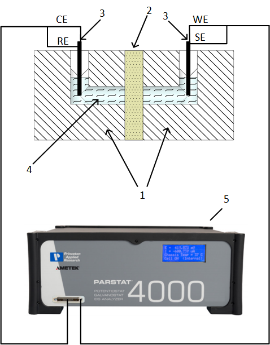
Рисунок 1 Схема экспериментальной ячейки (а) и пример частотного спектра электрохимического импеданса (б). 1 — Ртутно-контактная ячейка, 2 — исследуемая мембрана, 3 — платиновые электроды, 4 — ртуть, 5 — измеритель импеданса
Спектр электрохимического импеданса мембраны (рис. 1 б) снимался в диапазоне частот от 500 кГц до 10 Гц при нулевой постоянно токовой составляющей и амплитуде переменно токового сигнала 100 мкА.
Экстраполяция линейного участка спектра в высокочастотной области позволяет получить значение активного (омического) сопротивления мембраны (рис. 1 б). Расчёт электропроводности материала производили по формуле:
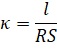
где к — удельная электропроводность, См/см; R — сопротивление мембраны, Ом; l — толщина образца, см; S — площадь образца, см2.
Результаты измерения электропроводности изучаемых мембран в растворах хлорида натрия приведены на рисунке 2.
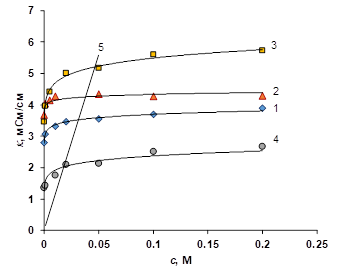
Рисунок 2 Концентрационная зависимость электропроводности ионообменных мембран в растворе NaCl. 1 — Ralex CM, 2 — Ralex AMH, 3 — МК-40, 4 — МА-41, 5 — раствор NaCl.
Из концентрационной зависимости электропроводности мембран в растворе хлорида натрия видно, что в каждой паре мембран (МК-40, МА-41 и Ralex CM, Ralex AMH) лучшую электропроводность показывают анионообменные мембраны. Это связано с большей подвижностью хлорид-иона, по сравнению с ионом натрия (коэффициенты диффузии равны 2.034· 10-5 и 1.334· 10-5 см2/c, соответственно). Заниженные значения электропроводности мембраны МА-41, по сравнению с известными в литературе данными [888], видимо связаны со спецификой конкретной партии мембран. Также видно, что зависимость электропроводности для мембран МК-40 и МА-41 носит более выраженный характер, в то время как для мембран Ralex с увеличением концентрации электропроводоность практически не изменяется. Этот эффект вызван более гомогенной структурой мембран Ralex, на что уже указывали авторы [15]. Транспортно-структурные параметры, найденные из концентрационной зависимости электропроводности мембран, в рамках расширенной трёхпроводной модели подтверждает это предположение (табл. 1).
Таблица 1.
Параметры расширенной трёхпроводной модели найденные из концентрационной зависимости электропроводности ионообменных мембран в растворе хлорида натрия.
Параметры трёхпроводной модели. | Ralex CM. | Ralex AMH. | МК-40. | МА-41. | |
a | 0.15. | 0.10. | 0.30. | 0.29. | |
b | 0.85. | 0.90. | 0.68. | 0.69. | |
c | 0.00. | 0.00. | 0.02. | 0.02. | |
d | 0.34. | 0.25. | 0.48. | 0.15. | |
e | 0.66. | 0.75. | 0.52. | 0.85. | |
f | 0.95. | 0.97. | 0.84. | 0.86. | |
? | 0.321. | 0.239. | 0.461. | 0.126. | |
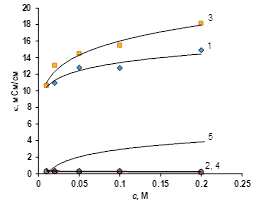
При переходе к растворам содержащим органические ионы электропроводность катионообменных мембран становится выше, по сравнению с анионообменными. Это особенно ярко проявляется в растворах орагнических кислот (рис. 3).
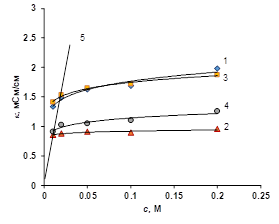
а б.
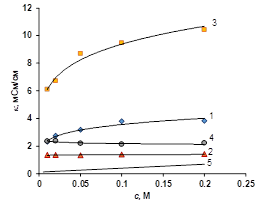
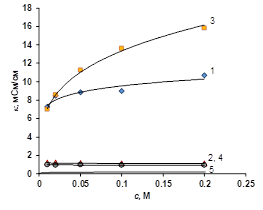
в г.
Рисунок 3 Концентрационная зависимость электропроводности ионообменных мембран в растворе ацетата натрия (а), уксусной кислоты (б), янтарной кислоты (в), лимонной кислоты (г). 1 — Ralex CM, 2 — Ralex AMH, 3 — МК-40, 4 — МА-41, 5 — раствор электролита
В растворах органических кислот можно наблюдать, что электропроводность мембран выше, чем электропроводность чистого растворителя. Это явление объясняется тем, что органические кислоты — слабые электролиты, их степень диссоциации во всем изученном концентрационном интервале меньше 10%. Это означает, что большая часть вещества в растворе представлена нейтральными молекулами, которые не проводят электричество. С другой стороны, из-за электростатических взаимодействий между ионами электролита и фиксированными группами внутри мембраны степень диссоциации органической кислоты существенно увеличивается. В результате внутри мембраны равновесие смещенно в сторону ионов — продуктов диссоциации органической кислоты. Это особенно хорошо проявляется для катиообменных мембран, электропроводность которых обуславливается ионами водорода, имеющими высокую подвижность, в результате электропроводность катионообменных мембран на порядок больше электропроводности чистого раствора (рис. 3 б, в, г).
Другой особенностью, которая проявляется в растворах органических кислот является инверсия зависимости электропроводности анионообменных мембран от концентрации — при уменьшении концентрации раствора электропроводность мембраны незначительно увеличивается (рис. 4).
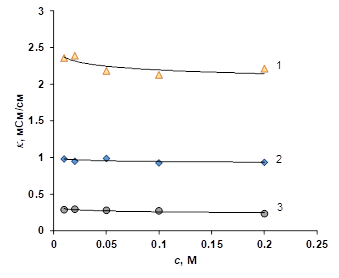
Рисунок 4 Концентрационная зависимость электропроводности ионообменной мембраны МА-41 в растворах: 1 — уксусной кислоты; 2 — янтарной кислоты; 3 — лимонной кислоты Ранее [5] такое поведение наблюдалось у анионообменных мембран в растворах винной кислоты. Авторы [5] объясняли такое поведение переходом мембраны в более проводящую двухзаряженную форму тартрат иона. В частности авторами [5] полученно выражение для описания отношения электропроводности мембраны в форме двухи однозаряженных ионов:
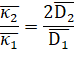
где индексы 1 и 2 относятся к однои двузаряженной форме.
Принимая, что соотношение коэффициентов диффузии внутри мембраны остается приблизительно таким же, как и в растворе видно, что электропроводность мембраны в форме двузаряженного иона должна быть выше. Однако данное соотношение непременимо к случаю когда мембрана уравновешена с раствором уксусной кислоты, у которой нет двузаряженной формы.
Найти структурные параметры ионообменных мембран при их контакте с растворами органических кислот в рамках известных моделей (микрогетерогенной или расширенной трёхпроводной) в настоящий момент не прелдставляется возможным, поскольку для расчётов по этим моделям требуется знать координаты точки «изоэлектропроводности». Однако, как видно из рисунка 3, в случае слабых электролитов такую точку найти невозможно.
Заключение
В работе впервые приводятся экспериментальные результаты изучения концентрационной зависимости электропроводности гетерогенных ионообменных мембран, находящихся в контакте с растворами слабых электролитов — карбоновых кислот. Показано, что в этом случае удельная электропроводность мембран выше, чем электропроводность раствора, при этом электропроводность катионообменных мембран практически на порядок больше электропроводности анионообменных мембран. Этот факт необходимо учитывать при проектировании реальных электродиализных процессов переработки растворов, содержащих органические ионы.
В работе обнаружена необходимость развития современных представлений о транспортно-структурной организации ионообменных материалов, для описания структуры ионообменных мембран, находящихся в контакте с растворами слабых электролитов.
- 1. Strathmann H. Electrodialysis, a mature technology with a multitude of new applications // Desalination. 2010. Vol. 264. № 3. P. 268−288.
- 2. Valero F., Arbуs R. Desalination of brackish river water using Electrodialysis Reversal (EDR). Control of the THMs formation in the Barcelona (NE Spain) area // Desalination. 2010. Vol. 253. P. 170.
- 3. Fritzmann C., Lцwenberg J., Wintgens T., Melin T. State-of-the-art of reverse osmosis desalination // Desalination. 2007. Vol. 216. № 1−3. P. 1−76.
- 4. Huang C., Xu T., Zhang Y., Xue Y., Chen G. Application of electrodialysis to the production of organic acids: State-of-the-art and recent developments // J. Memb. Sci. 2007. Vol. 288. P. 1−12.
- 5. Sarapulova V., Nevakshenova E., Pismenskaya N., Dammak L., Nikonenko V. Unusual concentration dependence of ion-exchange membrane conductivity in ampholyte-containing solutions: Effect of ampholyte nature // J. Memb. Sci. 2015. Vol. 479. P. 28−38.
- 6. Eliseeva T. V., Shaposhnik V.A. Transport of carbonates through an anion exchange membrane in electrodialysis // Russ. J. Electrochem. 2000. Vol. 36. P. 902.
- 7. Eliseeva T.V., Shaposhnik V.A., Krisilova E.V., Bukhovets A.E., Transport of basic amino acids through the ion-exchange membranes and their recovery by electrodialysis // Desalination. 2009. Vol. 241. P. 86−90.
- 8. Demina O.A., Demin A.V., Zabolotskii V.I., Berezina N.P. The effect of aprotic solvent on the selectivity of ion-exchange membranes // Rus. J. Electrochem. 2011. Vol. 47. № 7. P. 759−767.
- 9. Заболоцкий В. И., Шельдешов Н. В., Бессмертная О. Н., Мельников С. С., Лакунин В. Ю., Ведёхин В. В., Склярова Г. Б., Ткачёва Л. В. Безреагентная нейтрализация технологического раствора на основе диметилацетамида и изобутилового спирта, образующегося при производстве ароматических полиарамидных волокон электродиализом с биполярными мембранами // Известия высших учебных заведений. Северокавказский регион. Серия: технические науки. 2013. № 1. С. 112−116.
- 10. Gnusin N.P., Berezina N.P., Kononenko N.A., Dyomina O.A. Transport structural parameters to characterize ion exchange membranes // J. Memb. Sci. 2004. Vol. 243. P. 301−310.
- 11. Гетерогенные ионообменные мембраны [Электронный ресурс]. Режим доступа: http://n-azot.ru/download/product/product165.pdf.
- 12. Heterogenous ion-exchange membranes RALEX. URL: http://www.mega.cz/heterogenous-ion-exchangemembranes-ralex.html. Дата обращения: 10.06.2014.
- 13. Полянский Н. Г., Горбунов Г. В., Полянская Н. Л. Методы исследования ионитов. М.: Химия, 1976. 208 с.
- 14. Карпенко Л. В., Демина О. А., Дворкина Г. А., Паршиков С. Б., Ларше К., Березина Н. П. Сравнительное изучение методов определения удельной электропроводности ионообменных мембран // Электрохимия. 2001. Т. 37, № 3. С. 328−335.
- 15. Melnikov S., Loza S., Sharafan M., Zabolotskiy V. Electrodialysis treatment of secondary steam condensate obtained during production of ammonium nitrate. Technical and economic analysis // Separ. Purif. Technol. 2015. Vol. 157. P. 179−191.