Системное использование препаратов на основе бактерий и грибов в защите растений и улучшении микробиологического состава почв

Полученные данные подтверждают, что A. chroococcum требователен к условиям окружающей среды и мало распространён в почве (отсутствие его в образце почвы, где не применялась обработка баковой смесью). Но эти данные одновременно доказывают, что применение в защите растений (пшеницы) обработок микробиологическими препаратами позволяет обогатить их почвенной микрофлорой. При этом использование одного… Читать ещё >
Системное использование препаратов на основе бактерий и грибов в защите растений и улучшении микробиологического состава почв (реферат, курсовая, диплом, контрольная)
Использование в защите растений пестицидов в течение последних лет привело к снижению числа полезных микроорганизмов в почве и заставляет задуматься о необходимости улучшения её микробиологического состава путём внесения биопрепаратов. Ухудшающаяся экологическая обстановка агробиоценоза требует уменьшения доли использования химических препаратов и увеличения доли микробиологических [1, 2, 5]. Скептически относящиеся к микробиологическим средствам защиты растений, и отдающие предпочтение химическим методам, агротехнологи отрицают целесообразность такого обогащения почв микроорганизмами, ссылаясь на то, что рН почв, недостаток влаги, изменения и колебания температуры, использование пестицидов и гербицидов в конечном итоге всё равно приведут к гибели почвенных микроорганизмов. Вместе с тем используемый нами комплекс биопрепаратов для защиты посевов от болезней и вредителей хотя и показал позитивное влияние на плодородие почвы — увеличение содержания гумуса на 0,16% (ООО «Аксайская земля» Ростовской области), воздействию на микробиологический состав почвы детально не проверялся, это и стало основной целью исследований.
Материал и методы исследований. В качестве объектов исследования в работе были использованы образцы почв с полей отобранных в ООО СПК «Темижбекское» (Ставропольский край). Вариант с внесением баковой смеси микроорганизмов при обработках посевов для защиты растений и вариант без их внесения.
Почвы были исследованы на наличие следующих микроорганизмов: бактерий Azotobacter chroococcum и гриба Trichoderma viride. Выбор даныых микроорганизмов для исследования обусловлен тем, что эти микроорганизмы входят в состав баковой смеси, разработанной ООО МИП «Кубанские агротехнологии» при Кубанском госагроуниверситете, рекомендуемой для защиты растений (в. т. ч. пшеницы), выращиваемой в условиях Юга России [1, 2, 6, 7]. ООО СПК «Темижбекское» применяет это способ защиты растений в течение трех с половиной лет. Отбор почв был произведен в сентябре 2014 года.
Бактерии рода Azotobacter используются в качестве аналога азотных удобрений. Эти бактерии синтезируют и продуцируют биологически активные вещества, потребляемые растениями. Среди них биотин, гетероауксин, гиббереллин, никотиновая и пантотеновая кислоты [4 ]. Кроме того, выявлена их антагонистическая активность в отношении возбудителей заболеваний растений, встречающихся на семенах и в почве (грибов родов Fusarium, Alternaria, Penicillium, Helminthosporium), благодаря способности выделять фунгицидные вещества группы анисомицина. Azotobacter требователен к условиям питания. При этом в почвах, богатых перегноем, а так же при ограниченном количестве растительных остатков размножение Azotobacter затруднено [4]. Хорошо развивается при температуре 25−28оС и рН 6,8−7,2.
Trichoderma viride, являясь антагонистом, в процессе развития выделяет в окружающую среду антибиотики (глиотоксин, виридин, триходермин, алпметицин, сацукациллин, дермадин), обеззараживающие почву и подавляющие более 60 видов фитопатогенных бактерий и грибов, в том числе: Fusarium, Phytophthora, Alternaria, Pythium, Botrytis, Phoma [3, 5, 6 ]. Кроме того T. viride препятствует развитию возбудителей ржавчины и мучнистой росы, антракноза, вилта, макроспориоза. T. viride способна уничтожать даже зимующие и покоящиеся стадии патогенов, улучшает структуру почвы, повышая её плодородие, стимулирует корневое питание. Она продуцирует фермент целловиридин, в результате работы которого происходит активное разложение высокомолекулярных полисахаридов до полисахаридов с меньшой молекулярной массой, при этом T. viride обеспечивает питание своим симбионтам, а так же в случае разложения полисахаридов до дии моносахаров, обеспечивает питание растениям. Благодаря тому, что скорость разложения почвенных питательных субстратов и компонентов, T. viride высока, гиперпаразитическая активность в отношении медленно растущей микрофлоры, проявляется быстро, на 3−4 сутки, и за счёт действия хемотаксиса и питания поврежденными тканями больного участка растения обеспечивается защита растений от гнили, корневых инфекций [5]. Оптимальные условиия для её развития: рН 4,0−6,5 и температура 22−28оС.
Для получения накопительной культуры A. chroococcum использовали жидкую среду Бейеринка с маннитом и добавлением в неё микроэлементов по Федорову [3]. В подготовленную питательную среду вносили по 10 г образцов почвы. После чего поместили в термостат и инкубировали в течение 5 суток при температуре 25±3 оС.
Для получения культуры Trichoderma viride использовали бульон и агар Чапека.
Результаты исследований. После этого в образце, отобранного на поле, на котором применялась обработка посевов пшеницы баковой смесью микроорганизмов и её послеуборочных остатков, на поверхности среды Бейеринка появилась характерная слизистая пленка и пристеночное кольцо, образованное A. chroococcum (рис. 1). А в образце почвы, взятой с поля, где такая обработка не применялась, и микроорганизмы не вносились, ни пленки, ни пристеночного кольца, связанных с развитием бактерий не наблюдалось (рис. 2), хотя считается, что A. chroococcum является почвенной микрофлорой и встречается в ней.

Рисунок 1. Рост A. chroococcum на среде Бейеринка, из образца почвы с применением обработки баковой смесью микроорганизмов (фото Н. В. Седининой, 2014).

Рисунок 2. Отсутствие признаков роста A. chroococcum на среде Бейеринка, из образца почвы, где не применялась обработка баковой смесью микроорганизмов (фото Н. В. Седининой, 2014).
В дальнейшем, сделанный «слепой пересев» микробиологической петлей из обоих образцов почвы на агаризованную среду Эшби, так же показал рост A. chroococcum, в образцах той почве, где применялась обработка баковой смесью, и отсутствие роста этих бактерий в почве, где такая обработка не применялась.
При проведении количественной оценки A. chroococcum, из ряда разведений (от 10−1 до 10−6) из образцов, культивируемых на среде Бейеринка и посева их на среду Эшби (рис.3) был получен положительный результат в виде присутствия роста A. chroococcum в образце почвы, где обработка применялась, и отсутствия роста (даже в разведениях 10−2, 10−3) в образце почвы, где обработка не применялась, что подтверждает полученные ранее нами данные. Результаты исследования приведены в таблице 1.

Рисунок 3. Рост A. chroococcum на среде Эшби (левая чаша Петри) и его отсутстствие (правая чашка Петри) в образцах почв (фото Н. В. Седининой, 2014).
Микроскопия полученных клеток бактерий, показала наличие клеток бактерий в форме кокков, в основном соединенных попарно, одиночных в меньшем количестве. При окраске по Граму большинство клеток было окружено слизистой капсулой (хотя обычно, капсула у A. chroococcum хорошо просматривается только при окраске тушью), внутри клеток просматривалась зернистость (рис. 4).
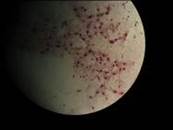
Рисунок 4. Микроскопия A. chroococcum (1000х), выделенный из почвы, с применением микроорганизмов в защите растений (фото Н. В. Седининой, 2014).
Избирательность применяемых сред, а так же результаты микроскопии устанавливают принадлежность выделенной культуры к A. chroococcum.
Полученные данные подтверждают, что A. chroococcum требователен к условиям окружающей среды и мало распространён в почве (отсутствие его в образце почвы, где не применялась обработка баковой смесью). Но эти данные одновременно доказывают, что применение в защите растений (пшеницы) обработок микробиологическими препаратами позволяет обогатить их почвенной микрофлорой. При этом использование одного препарата на основе бактерий A. chroococcum нами считается недостаточным и приводит только к кратковременному 2-х недельному улучшению азотного питания в ризосферной зоне растений. Это объясняется тем, что A. chroococcum является культурой, которая плохо переносит изменение внешних условий среды, не образует споры, а из средств защиты своей клетки способна только к образованию капсулы. При этом единственным способом поддержания её в почве является питание. Поэтому, нами рекомендуется, одновременно с A. chroococcum применять фосформобилизирующие микроорганизмы Bacillus megaterium, так же входящие в состав баковой смеси, рекомендуемой ООО МИП «Кубанские агротехнологии» для защиты растений, и являющиеся продуцентами доступного фосфора, в котором нуждается A. chroococcum. Их совместимость подтверждена проведенным нами исследованием и доказывается одновременным ростом этих бактерий на питательной среде без зоны антагонирования и задержки роста друг друга. Поэтому препараты на основе A. chroococcum целесообразно использовать и для обработок в период вегетации растений, и для стерневой (послеуборочной) обработки, т. к. эти бактерии хорошо разлагают продукты распада целлюлозы. Важно одновременно с A. chroococcum использовать грибы T. viride (при обработках в период вегетации) и/или lignorum (при стерневых послеуборочных обработках), обладающие способностью расщеплять целлюлозу и лигнин.
При исследовании тех же самых образцов почвы на наличие грибов рода Trichoderma spp были сделаны посевы из разведений от 10−1 до 10−6 на агаризованную среду Чапека. Однако данная часть исследования была затруднена по причине того, что для грибов рода Trichoderma не существует селективных сред. А на среде Чапека растёт вся грибная микрофлора, содержащаяся в почве. В результате в течение двух суток исследования обоих образцов был обнаружен рост гриба Rhizopus (рис. 5), из-за которого затруднялась идентификация грибов Trichoderma. Поэтому наличие или отсутствие в образцах почв грибов рода Trichoderma было решено устанавливать по растительным остаткам, взятым из этих образцов почв после их промывания в течение двух часов в проточной водопроводной воде.

Рисунок 5. Развитие Rhizopus в исследуемых образцах почв.
(фото Н. В. Седининой, 2014).
Затем растительные остатки были помещены на питательную среду Чапека. В образцах растительных остатков, взятых из почвы, на которой применялась обработка баковой смесью микроорганизмов, были обнаружены грибы рода Trichoderma. Что подтверждалось микроскопией (рис.6). Видовая принадлежность их нами не устанавливалась. В образцах растительных остатков, взятых из почвы без внесения микроорганизмов в виде баковой смеси грибы рода Trichoderma обнаружены не были (табл. 1).
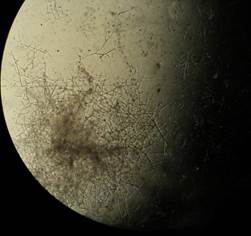
Рисунок 6. Грибы Trichoderma spp (200х), обнаруженные на растительных остатках, взятых из почвы с обработкой микроорганизмами в баковой смеси (фото Н. В. Седининной, 2014).
Полученные в результате исследований данные в отношении грибов рода Trichoderma spp подтверждают наличие этого гриба в образцах с применением обработок микробиологическими препаратами, что в дальнейшем подтверждает факт обогащения почвы этими грибами.
Таблица1 — Результаты микробиологической оценки почв ООО ОПХ «Темижбекское».
Наименование культуры микроорганизмов. | Количество (или присутствие) микроорганизмов, (КОЕ/1г). | ||
Образец почвы с внесением баковой смеси микроорганизмов при обработках пшеницы. | Образец почвы без внесения в баковой смеси микроорганизмов. | ||
A. chroococcum. | 3х104. | <10. | |
Trichoderma spp. | обнаружены. | не обнаружены. | |
Таким образом, итоговый результат применения в течение трёх с половиной лет микробиологической защиты растений, и проведённого нами исследования (таблице 1), на примере A. chroococcum и Trichoderma spp показал, что применение биологической защиты растений от болезней дополнительно способствует созданию почвенной микрофлоры. Кроме того, микроорганизмы, вносимые в почву, в дальнейшем способствуют накоплению биомассы и накоплению гумуса улучшению уровня рН.
- 1. Особенности малотоннажного производства микробиологических препаратов для защиты растений и его оптимизация / Котляров В. В., Сединина Н. В. // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) [Электронный ресурс]. — Краснодар: КубГАУ, 2014. — № 06(100). — IDA [article ID]: 1 001 406 050. — Режим доступа: http://ej.kubagro.ru/2014/06/pdf/50.pdf
- 2. Котляров В. В., Сединина Н. В., Котляров Д. В., Донченко Д. Ю. Экологизация и биологизация сельского хозяйства на примере технологии производства и применения бакового средства для защиты растений от болезней и насекомых-вредителей // Материалы 2-ой международной научно-практической конференции «Наука в современном информационном обществе» Москва. 2013. С. 142−144.
- 3. Практикум по микробиологии: Учебное пособие для вузов / Е. З. Тепер, В. К. Шильникова, Г. И. Переверзева; Под ред. В. К. Шильниковой. — 5-е изд., перераб и доп. — М.: Дрофа, 2004. — 256 с.
- 4. Мосичев, С. М. Общая технология микробиологических производств / С. М. Мосичев, А. А. Складнев, В. Б. Котов М.: Легкая и пищевая пром-сть, 1982. — 264с.
- 5. Биологическая защита растений / М. В. Штерншис, Ф. С. -У. Джалилов, И.В.
Андреева, О. Г. Томилова; Под ред. М. В. Штерншис. — М.: КолосС, 2004. — 264с.
6. Применение физиологически активных веществ в агротехнологиях /В.В. Котляров, Ю. П. Федулов, К. А. Доценко, Д. В. Котляров, Е. К. Яблонская. — Краснодар: КубГАУ, 2013 — 169с.