Нитраты металлов.
Теория горения и взрыва

Кратко рассмотрим процесс термического разложения, широко применяющегося в пиротехнике нитрата натрия. Большинство исследователей считают, что в изотермических условиях нитрат натрия начинает разлагаться при температуре 320 °C. При скорости нагревания 2,5°С/мин разложение нитрата в серебряном тигле становится заметным при 530° С. Увеличение скорости нагревания до 4,2°С/мин приводит к тому, что… Читать ещё >
Нитраты металлов. Теория горения и взрыва (реферат, курсовая, диплом, контрольная)
Процесс распада нитратов щелочных и щелочноземельных металлов многостадиен. Па первой стадии нитраты теряют кислород и образуют нитриты. При более высоких температурах происходит разложение нитритов. Термическая стабильность нитритов металлов возрастает в ряду Li, Na, Rb, К и Cs [11,33]. Разложение идет в расплаве (температура плавления 254, 308, 310, 337 и 414 °C соответственно) и на начальном этапе сопровождается накоплением нитритов этих металлов. Для указанных нитратов температура, при которой в расплаве образуется 0,05% нитрита, равна соответственно 430, 510, 512, 530 и 555 °C. Рост температуры разложения связывается с ростом степени ионности в ряду нитратов.
Кратко рассмотрим процесс термического разложения, широко применяющегося в пиротехнике нитрата натрия [11, с. 785]. Большинство исследователей считают, что в изотермических условиях нитрат натрия начинает разлагаться при температуре 320 °C. При скорости нагревания 2,5°С/мин разложение нитрата в серебряном тигле становится заметным при 530° С. Увеличение скорости нагревания до 4,2°С/мин приводит к тому, что температура начала разложения нитрата (в платиновом тигле) возрастает до 584 °C. Дальнейшее повышение скорости нагревания до 15°С/мин (тигель из нержавеющей стали) приводит к еще большему увеличению температуры начала активного разложения, вплоть до 740 °C.
Единственными продуктами начального разложения являются нитрит натрия и кислород. Их образование идет по следующей обратимой реакции:
2NaNO3 (ж.)> 2КаНO2(ж.) + O2 (г.) — 213,5 кДж/моль. (1.82).
Образующийся нитрит натрия растворяется или гомогенно смешивается с нитратом натрия.
С увеличением температуры в конденсированных продуктах разложения наряду с нитритом натрия появляется оксид натрия, а в газовой фазе, кроме кислорода, появляются азот и его оксиды (NO — в инертной среде, NO и NO2 — в активной среде). По литературным данным, температура появления этих продуктов составляет 550 °C при изотермическом разложении нитрата в тигле из платины и серебра или при нагревании нитрата со скоростью 2,5°С/мин в тигле из серебра, 598 °C при нагревании нитрата со скоростью 4,2°С/мин в тигле из платины и 740 °C при нагревании его со скоростью 15°С/мин в тигле из нержавеющей стали. На основе анализов полученных результатов предложена схема разложения, объясняющая экспериментальные данные. При разложении нитрита могут иметь место следующие реакции:
разложение нитрита с выделением кислорода и оксида азота:
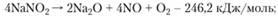 (1.83).
(1.83).
реакция кислорода с нитритом:
 (1.84).
(1.84).
реакция взаимодействия нитрита с N0:
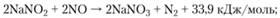 (1.85).
(1.85).
взаимодействие оксида азота с оксидом натрия:
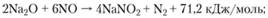 (1.86).
(1.86).
разложение нитрита с выделением кислорода и азота:
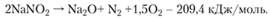 (1.87).
(1.87).
Основными реакциями разложения нитрита натрия являются реакции (1.82), (1.83), (1.87). Реакции (1.84), (1.85), (1.86) происходят при разложении нитрита в ограниченном объеме.
В продуктах разложения нитрата натрия содержится и перекись натрия [1]. Ее образование и разложение может происходить по реакциям.
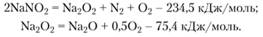
Появление при высоких температурах среди продуктов разложения NO2 может быть объяснено протеканием реакции.
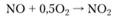
Образующийся в процессе разложения оксид натрия при высоких температурах (близких к температуре кипения l350°C) может в расплаве частично диссоциировать:
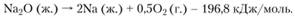
В табл. 1.15 и 1.16 приведены данные из разных источников о характерных температурах и кинетических характеристиках термического разложения неорганических окислителей. Следует иметь в виду, что данные о температуре начала разложения являются относительными, так как зависят от условий проведения эксперимента, влажности и чистоты образца, а также точности метода.
Таблица 1.15
Температура плавления и разложения неорганических окислителей
Окислитель. | t.° c. | |
плавления. | разложения. | |
UNO2. |
|
|
NH4NO. |
|
|
NaNO3,. | н/д.
|
|
KNO3. | н/д.
|
|
RbNO3. | 3401 5122 5603. | |
CsNO3. |
| 4401 5552 5753 584. |
Ca (NO3)2. | 480−500. | |
Sr (NO3)2. |
|
|
Ва (NО3)2. | н/д.
|
н/д. |
NH4C1O4. | н/д н/д н/д. |
|
LiC1O4. | н/д. |
|
LiC1O4−3H2O. | 3104 4125 5046. | |
NaClO. |
|
|
KClO. |
|
|
Примечания:
- 1. Выделяется 0,002%.
- 2. Выделяется 0,05% нитритов.
- 3. Выделяется 0,1% нитритов
- 4. Легкое кипение.
- 5. Кипение.
- 6. Сильное кипение.
- 7. Легкое выделение нитрозных паров.
- 8. Быстрое выделение нитрозных паров.
* Температура превращения перхлоратов аммония, натрия и калия 240, 313 и 299,5°С соответственно, нитрата аммония 32,1; 84,2; 125,2°С.
Таблица 1.16
Кинетические характеристики термического разложения неорганических окислителей
Окислитель. | Еакт, кДж/моль. | с-1. | t,°С. |
NH4NO3. | |||
| 13,8. | 343−361. | |
NH4ClO4. | >240. | ||
н/д. | <240. | ||
400−440. | |||
LiClO4. | |||
13,43. | 319−415. | ||
16,20. | |||
NaClO4. | н/д. | н/д. | |
KClO4. | |||
14,0. | 536−617. | ||
295'. | 13,4. | 556−582. | |
295 В. | 15,1. | 556−582. | |
Примечания:
- 1 Разложение, сопровождаемое автокаталитическим действием LiCl.
- 2 Автокаталитическая реакция, пока разложение не завершится на 40%.
- 3 Нормальный процесс первого порядка; смесь насыщается LiCl.
- 4 Низкие температуры.
- 5 Твердая фаза.
- 6 Жидкая фаза.