Адиабатическая температура сгорания

Термодинамический расчет продуктов горения и адиабатической температуры горения является одним из основных при конструировании реактивных двигателей, двигателей внутреннего сгорания, топок и других энергетических установок. Из-за сложности вычислений широко применяются ЭВМ, для которых созданы специальные программы термодинамических расчетов для широкого класса топлив. Разработаны также… Читать ещё >
Адиабатическая температура сгорания (реферат, курсовая, диплом, контрольная)
Как рассчитывать разогрев газа, в котором происходит экзотермическая химическая реакция? Пусть в исходной горючей смеси газов заданного состава при постоянном давлении происходит химическая реакция (3.2). Согласно первому началу термодинамики (3.25) при проведении изобарического процесса теплосодержание смеси не меняется в течение всего процесса. Приравняем значение полной энтальпии смеси в некоторый момент времени ее значению в исходной смеси, т. е. при температуре газа Т = Т0 и начальном составе, содержащем  молей исходных веществ А,•, вступающих в реакцию, и
молей исходных веществ А,•, вступающих в реакцию, и 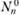 молей инертных в химическом отношении веществ, не участвующих в химической реакции, и выразим количества образовавшихся веществ через количество одного из прореагировавших веществ, например A1 (Я. Б. Зельдович, 1980):
молей инертных в химическом отношении веществ, не участвующих в химической реакции, и выразим количества образовавшихся веществ через количество одного из прореагировавших веществ, например A1 (Я. Б. Зельдович, 1980):
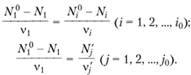 (3.32).
(3.32).
Используя определение частоты реакции (3.30), получим:
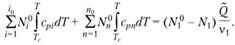 (3.33).
(3.33).
Введем средние значения теплоемкостей по интервалу температур от Т0 до Т и среднюю молярную теплоемкость при постоянном давлении:
 (3.34).
(3.34).
 (3.35).
(3.35).
Тогда из (3.33) следует соотношение.
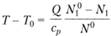 (3.36).
(3.36).
(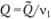 - теплота реакции на моль вещества A1), устанавливающее связь между разогревом смеси на величину (Т — Т0) и количеством прореагировавшего вещества А1. Смысл соотношения (3.36) очевиден. На каждый прореагировавший моль вещества А1 выделяется тепло Q так что если прореагировало
- теплота реакции на моль вещества A1), устанавливающее связь между разогревом смеси на величину (Т — Т0) и количеством прореагировавшего вещества А1. Смысл соотношения (3.36) очевиден. На каждый прореагировавший моль вещества А1 выделяется тепло Q так что если прореагировало 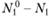 молей вещества А[ то общее количество выделившегося тепла равно
молей вещества А[ то общее количество выделившегося тепла равно  . Это тепло полностью идет на разогрев смеси, поэтому его нужно приравнять величине
. Это тепло полностью идет на разогрев смеси, поэтому его нужно приравнять величине 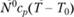 , что и приводит к (3.36). Соотношение (3.36), связывающее температуру реагирующей смеси с израсходованием горючего компонента и его теплотворной способностью, носит приближенный характер: при абстрагировании от кинетики процесса необходимо задавать приближенное, осредненное по всему температурному интервалу значение теплоемкости.
, что и приводит к (3.36). Соотношение (3.36), связывающее температуру реагирующей смеси с израсходованием горючего компонента и его теплотворной способностью, носит приближенный характер: при абстрагировании от кинетики процесса необходимо задавать приближенное, осредненное по всему температурному интервалу значение теплоемкости.
Если в исходной смеси вещество А (находилось в недостатке, то максимально возможный разогрев можно получить, подставив в (3.36) N1 = 0, тогда оно примет вид.
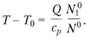 (3.37).
(3.37).
Рассмотренный приближенный расчет температуры горения приводит к сс завышению, потому что нс учитывает характера химического равновесия при высокой температуре и, в частности, диссоциацию молекул воды, углекислого газа и других основных продуктов горения на более простые соединения, которая идет с затратой значительного количества тепла.
Приближенный расчет становится тем более неточным, чем выше температура горения и ниже давление, т. е. чем благоприятнее условия для сильной диссоциации продуктов горения. Так, при горении в кислороде углеводородных или других высококалорийных топлив температура горения оказывается весьма высокой, и расчет по приближенной формуле (3.37) приводит к большим ошибкам. Проиллюстрируем это примером. Предположим, что химическая реакция горения протекает полностью и продуктами реакции являются нары воды Н2O, углекислый газ СO2 или, при недостатке кислорода, оксид углерода СО. Будем считать, что теплоемкости этих газов постоянны и равны теплоемкости их при начальной температуре смеси, приближенно оценим их значения как ср = 3,5R для СО и Н2 и ср = 4R для Н2O и СO2. Для стехиометрической водородно-кислородной (гремучей) горючей смеси делением теплоты образования водяного пара 242,44 кДж/моль на теплоемкость 150 Дж/(моль-К) получим температуру горения 7250 К. Для случая полного сгорания твердого углерода в кислороде (С (тв) + O2 = СO2 + 392 кДж/моль) получим температуру горения еще больше, 11 750 К. Температуры такого же порядка получаются и для других углеводородных топлив. Приведенные здесь фантастически высокие температуры горения относятся к плазменному состоянию вещества, они не осуществляются в действительности; температуры горения кислородных смесей лежат в пределах 3000−4000 К.
Главная причина такого сильного отличия заключается в том, что при температурах свыше 3000 К становится весьма существенной диссоциация продуктов горения с затратой энергии. Наряду с обратными реакциями горения 2Н2O > 2Н2 + O2,2СO2 > 2СО + O2, 2СО > 2С (тв) + O2 в диссоциации большую роль играют реакции с образованием свободных атомов и радикалов Н2 U 2Н — 484 кДж/моль, Н2O U? + ОН — 453 кДж/моль, которые, как видно, идут с большими затратами тепла:
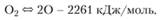 (3.38).
(3.38).
Как точно рассчитать равновесный состав и адиабатическую температуру горения? Для этого нужно совместно решить уравнения химической термодинамики — уравнения локального термодинамического равновесия и сохранения элементарного состава и уравнение сохранения энергии условие равенства исходной полной энтальпии ее конечному значению. Практически расчет можно проводить следующим образом. Задавшись некоторым значением Тb, по исходному составу реагирующей смеси из уравнений равновесия и сохранения числа атомов определяют ее равновесный состав, соответствующий выбранному значению Тb, а затем подсчитывают полную энтальпию системы. Такой расчет проводится для нескольких температур, так что можно построить кривую зависимости теплосодержания продуктов горения от Тb. То значение температуры Тb, при котором теплосодержание продуктов горения равно начальному, и есть искомая адиабатическая температура сгорания.
Практическое проведение расчета термодинамического состава обычно приходится выполнять на электронно-вычислительной машине — аналитическое решение основной сложной нелинейной системы уравнений удается получить лишь в случае самых простых химических превращений. При этом важно правильно построить вычислительный итерационный процесс, поскольку среди большого количества присутствующих в системе соединений далеко не все играют одинаковую роль. Так, например, температуры горения углеводородно-воздушных смесей таковы, что при термодинамическом равновесии концентрации стабильных продуктов горения СO2, Н2O, СО, N2, O2, Н2 значительно превышают концентрации атомов и радикалов (см. [26, 29]). Поэтому основной реакцией термодинамического равновесия является так называемая реакция водяного пара.
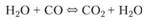 (3.39).
(3.39).
и в первом приближении можно начинать расчет равновесного состава, считая, что концентрации таких компонентов, как О, Н, ОН и других, равны нулю. После этого, в следующем приближении, определяются концентрации свободных атомов и радикалов при данных количествах конечных продуктов.
При горении кислородных смесей температуры горения могут быть выше (более 3000 К), концентрации активных компонентов становятся сравнимыми с концентрациями устойчивых соединений и расчет следует вести с самого начала для полного набора компонентов продуктов горения.
Как уже говорилось, если реакция проводится при постоянном объеме (изохорический процесс) в адиабатически изолированном сосуде, то приток тепла является уже не дифференциалом энтальпии, а дифференциалом внутренней энергии системы Е; тепловой эффект при постоянном объеме равен уменьшению внутренней энергии системы.
В этом случае все полученные формулы не изменятся, если заменить ср на теплоемкость при постоянном объеме сv = cpR.
В частности, вместо соотношений (3.36) и (3.37) будем иметь.
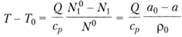 (3.40).
(3.40).
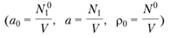
и.
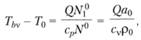 (3.41).
(3.41).
т.е. Т1л, (температура при постоянном объеме (изохорический процесс)) больше, чем в случае изобарического процесса. Разница между Тb и Тbv, объясняется тем, что в изобарическом процессе часть энергии, выделившейся в результате реакции, расходуется на работу расширения газов.
При расчете по точным термодинамическим соотношениям разница в температурах сгорания, подсчитанных при постоянном давлении и постоянном объеме с тем же уровнем начального давления, еще больше, в связи с тем что повышение давления в закрытом сосуде подавляет диссоциацию. Влияние давления па температуру горения является важным фактором в теории распространения пламени, в котором основное химическое превращение происходит при температурах, близких к температуре горения.
Термодинамический расчет продуктов горения и адиабатической температуры горения является одним из основных при конструировании реактивных двигателей, двигателей внутреннего сгорания, топок и других энергетических установок. Из-за сложности вычислений широко применяются ЭВМ, для которых созданы специальные программы термодинамических расчетов для широкого класса топлив. Разработаны также упрощенные методы термодинамических расчетов (см. [31]), которые отличаются простотой и вместе с тем во многих случаях обеспечивают достаточную точность расчета температуры горения и других теплотехнических величин.