Абсолютное значение энтропии
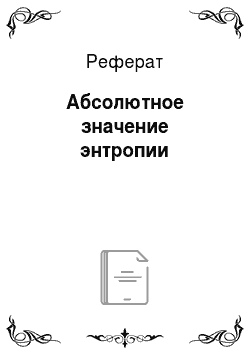
Это положение не относится к стеклам, растворам, дефектным кристаллам, но и для них энтропия при О К обычно очень мала. Таким образом, за начало отсчета энтропии можно принять нуль по шкале Кельвина. Здесь Ткнп — температура кипения вещества; Д<2К1Ш — мольная теплота кипения вещества; сркр — мольная теплоемкость газообразного вещества в интервале температур от Tкип до Т. Здесь Тпл — температура… Читать ещё >
Абсолютное значение энтропии (реферат, курсовая, диплом, контрольная)
Постулат Планка (третий закон термодинамики)
В отличие от внутренней энергии и энтальпии, для энтропии можно определить абсолютные значения. Эта возможность появляется при использовании постулата Планка, который еще называется третьим началом термодинамики. М. Планк (1912 г.) обратил внимание на связь энтропии с температурой и выдвинул постулат, именуемый третьим законом термодинамики: энтропия любой системы, тела при температуре абсолютного нуля равна нулю.
Энтропия является мерой «бесполезного» тепла, мерой обесцененной, «связанной» энергии. Если мы хотим, чтобы какая-то система (или машина) совершала работу, то за это необходимо заплатить не только расходом внутренней энергии, но и возрастанием энтропии, теплового запаса системы. Энергию можно вернуть, отдав обратно полученную работу, но возросшую энтропию системы уменьшить (без дополнительной работы) нельзя. В нашем мире любой выигрыш в работе приведет обязательно к увеличению энтропии.
Опытные данные показывают, что теплоемкости ср всех веществ при температуре, стремящейся к нулю по шкале Кельвина, резко падают до ничтожно малых величин. Отношение ср/Т тоже резко уменьшается (ср падает быстрее Т).
М. Планк в 1911 г. сформулировал постулат: энтропия совершенного кристалла при О К равна нулю (постулат Планка).
Это положение не относится к стеклам, растворам, дефектным кристаллам, но и для них энтропия при О К обычно очень мала. Таким образом, за начало отсчета энтропии можно принять нуль по шкале Кельвина.
Для вычисления абсолютного значения энтропии надо знать теплоемкости, определенные до наиболее низких температур, и теплоты фазовых переходов.
Уравнение для вычисления абсолютного значения энтропии кристаллического вещества 5, ф при температуре Т имеет вид.

Здесь ср кр — мольная теплоемкость кристаллического вещества в интервале температур от 0 до Т.
Если в твердом состоянии вещество имеет более одной модификации, необходимо добавить соответствующие дополнительные слагаемые в правую часть уравнения.
Уравнение для вычисления абсолютного значения энтропии жидкого вещества 5Ж при температуре Т имеет вид.

Здесь Тпл — температура плавления вещества; AQ,-, — мольная теплота плавления вещества; срж — мольная теплоемкость жидкого вещества в интервале температур от Twt до Т.
Уравнение для вычисления абсолютного значения энтропии газообразного вещества SГ при температуре Т имеет вид.

Здесь Ткнп — температура кипения вещества; Д<2К1Ш — мольная теплота кипения вещества; сркр — мольная теплоемкость газообразного вещества в интервале температур от Tкип до Т.
В термодинамических таблицах обычно приводятся величины абсолютных энтропий веществ при стандартных условиях и Т = 298 К.
Величина энтропии зависит: от молекулярной массы (для родственных веществ увеличивается с ее ростом); агрегатного состояния (увеличивается при переходе от твердого к жидкому и от жидкого к газу); кристаллического строения (графит, алмаз); изотопного состава, от особенностей структуры молекул и т. д.
Изменение энтропии в химической реакции А5Х р можно рассчитать, зная энтропии всех участвующих в реакции веществ:

Здесь v — стехиометрические коэффициенты реакции. Индексы j и і относятся соответственно к продуктам реакции и исходным веществам.
Следовательно, в стандартных условиях изменение энтропии рассчитывается следующим образом:
 (3.7).
(3.7).
Изменение энтропии в химической реакции при температуре, отличной от стандартной (ДSХ р)г, рассчитывается как.
 (3.8).
(3.8).
где Аср — изменение изобарной теплоемкости в химической реакции (см. уравнение (2.16)), АS^р — стандартное изменение энтропии при температуре 298 К.
При Аср= const эту величину можно вынести за знак интеграла. Проинтегрировав это выражение, получаем.
