Кинетика двусторонних (обратимых) реакций
Преодоление барьера активации при взаимодействии молекул может осуществляться путем подачи энергии системе в виде квантов света. Реакции, в которых активация частиц является результатом их взаимодействия с квантами света видимой области спектра, называют фотохимическими реакциями. Для всех фотохимических процессов выполняется закон Гротгуса: химическое превращение вещества может вызвать только… Читать ещё >
Кинетика двусторонних (обратимых) реакций (реферат, курсовая, диплом, контрольная)
Химические реакции часто являются двусторонними (обратимыми), т. е. могут протекать при данных условиях в двух противоположных направлениях (понятие обратимая реакция следует отличать от термодинамического понятия обратимый процесс; двусторонняя реакция обратима в термодинамическом смысле лишь в состоянии химического равновесия). Рассмотрим элементарную двустороннюю реакцию.
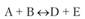
Скорость уменьшения концентрации вещества, А при протекании прямой реакции определяется уравнением (15.28).
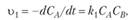 (15.28).
(15.28).
а скорость возрастания концентрации вещества, А в результате протекания обратной реакции уравнением (15.29).
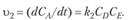 (15.29).
(15.29).
Общая скорость двусторонней реакции в любой момент времени равна разности скоростей прямой и обратной реакции.
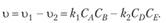 (15.30).
(15.30).
По мере протекания двусторонней реакции скорость прямой реакции уменьшается, скорость обратной реакции — увеличивается; в некоторый момент времени скорости прямой и обратной реакции становятся равными и концентрации реагентов перестают изменяться. Таким образом, в результате протекания в закрытой системе двусторонней реакции система достигает состояния химического равновесия; при этом константа равновесия будет равна отношению констант скоростей прямой и обратной реакции:
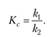 (15.31).
(15.31).
Кинетика гетерогенных химических реакций
Когда реакция совершается между веществами, находящимися в разных фазах гетерогенной системы, основной постулат химической кинетики становится неприменимым. В гетерогенных реакциях роль промежуточных продуктов обычно играют молекулы, связанные химическими силами с поверхностью раздела фаз (химически адсорбированные на поверхности). Во всяком гетерогенном химическом процессе можно выделить следующие стадии:
- 1. Диффузия реагентов к реакционной зоне, находящейся на поверхности раздела фаз.
- 2. Активированная адсорбция частиц реагентов на поверхности.
- 3. Химическое превращение адсорбированных частиц.
- 4. Десорбция образовавшихся продуктов реакции.
- 5. Диффузия продуктов реакции из реакционной зоны.
Стадии 1 и 5 называются диффузионными, стадии 2, 3 и 4 — кинетическими. Универсального выражения для скорости гетерогенных химических реакций не существует, поскольку каждая из выделенных стадий может являться лимитирующей. Как правило, при низких температурах скорость гетерогенной реакции определяют кинетические стадии (так называемая кинетическая область гетерогенного процесса; скорость реакции в этом случае сильно зависит от температуры и величины площади поверхности раздела фаз; порядок реакции при этом может быть любым). При высоких температурах скорость процесса будет определяться скоростью диффузии (диффузионная область гетерогенной реакции, характеризующаяся, как правило, первым порядком реакции и слабой зависимостью скорости процесса от температуры и площади поверхности раздела фаз).
Фотохимические реакции
Преодоление барьера активации при взаимодействии молекул может осуществляться путем подачи энергии системе в виде квантов света. Реакции, в которых активация частиц является результатом их взаимодействия с квантами света видимой области спектра, называют фотохимическими реакциями. Для всех фотохимических процессов выполняется закон Гротгуса: химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом.
Излучение, отраженное веществом, а также прошедшее сквозь него, не вызывает никаких химических превращений. Иногда фотохимические процессы происходят под действием излучения, которое не поглощается реагирующими веществами; однако в таких случаях реакционная смесь должна содержать сенсибилизаторы. Механизм действия сенсибилизаторов заключается в том, что они поглощают свет, переходя в возбужденное состояние, а затем при столкновении с молекулами реагентов передают им избыток своей энергии. Сенсибилизатором фотохимических реакций является, например, хлорофилл (см. ниже).
Взаимодействие света с веществом может идти по трем возможным направлениям.
1. Возбуждение частиц (переход молекул вещества в возбужденное состояние):
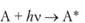
2. Ионизация частиц за счет отрыва электронов:

3. Диссоциация молекул с образованием свободных радикалов (гемолитическая) либо ионов (гетеролитическая):
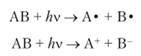
Между количеством энергии света, поглощенной молекулами вещества, и количеством прореагировавших молекул существует соотношение, выражаемое законом фотохимической эквивалентности Штарка — Эйнштейна: число молекул, подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов света.
Поскольку фотохимическая реакция, как правило, включает в себя и вторичные процессы (например, в случае цепного механизма), для описания реакции вводится понятие квантового выхода фотохимической реакции: квантовый выход фотохимической реакции у есть отношение числа частиц, претерпевших превращение, к числу поглощенных веществом квантов света.
Квантовый выход реакции может варьироваться в очень широких пределах: от 10 3 (фотохимическое разложение метилбромида) до 10е (цепная реакция водорода с хлором). В общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция.
Самой важной реакцией для всего живого на Земле является реакция фотосинтеза. Эта фотохимическая реакция протекает в растениях с участием хлорофилла. Структура молекулы хлорофилла приведена на рис. 15.12.
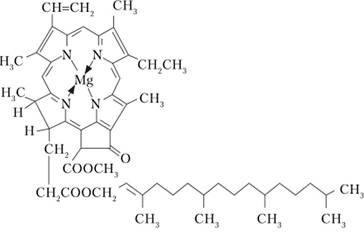
Рис. 15.12. Структура молекулы хлорофилла.
Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов света, и значительно более медленная темповая
стадия, представляющая собой ряд химических превращений, осуществляемых в отсутствие света. Суммарный процесс фотосинтеза заключается в окислении воды до кислорода и восстановлении диоксида углерода до углеводов:
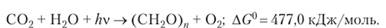
Протекание данного окислительно-восстановительного процесса (связанного с переносом электронов) возможно благодаря наличию в реакционном центре хлорофилла СЫ донора D и акцептора Л электронов; перенос электронов происходит в результате фотовозбуждения молекулы хлорофилла:
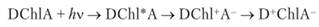
Возникающие в данном процессе заряженные частицы и А- принимают участие в дальнейших окислительно-восстановительных реакциях темповой стадии фотосинтеза.