Элементы группы VIВ

Хром применяется как важнейший компонент сталей различного назначения, в том числе нержавеющих. Большая часть хрома выплавляется в виде феррохрома (около 3 млн т/год). Соединения хрома применяются в различных отраслях промышленности: производство огнеупоров, пигментов, кожевенная промышленность. Производство молибдена составляет около 100 000 т/год. Большая часть его используется для легирования… Читать ещё >
Элементы группы VIВ (реферат, курсовая, диплом, контрольная)
Группа VIВ состоит из четырех ^/-элементов с четными атомными номерами: хром 24Сг, молибден 42Мо, вольфрам 74У и сиборгий (табл. 27.8). Последний назван в честь выдающегося американского химика Г. Сиборга (1912 1999), открывшего совместно с сотрудниками плутоний и другие трансурановые элементы.
Таблица 27.8
Характеристика элементов группы У1 В.
Свойство. | Элемент. | ||
241•. | 42Мо. | 14* | |
Радиус г атома (ковалентный), пм Содержание в земной коре со, %. | |||
Содержание в организме чело; | 0,01. | 1,5 10*. | МО-4. |
века со, %. | 9 10″ 6•. | 1,5 Ю" 5•. | ; |
Электроотрицательность х. | 1,7. | 2,1. | 2,3. |
Главные СО | +2, +3, +6. | +2, +3, +4, +5, +6. | +2, +3, +4, +5, +6. |
* Биогенный элемент.
У хрома в природе встречаются четыре стабильных изотопа (ЦСг — 83,79%). У молибдена — семь стабильных изотопов с содержанием в смеси от 9% и более. Самый распространенный изотоп 42Мо — 24,13%. У вольфрама пять стабильных изотопов (!^}У — 30,7%).
Распространенность хрома в природе достаточно высокая (см. табл. 27.8). Важнейшая хромовая руда — хромит РеСг204. Молибден и вольфрам приблизительно в 100 раз менее распространенные элементы, чем хром. Важнейший минерал — молибденит Мо82. Из минералов вольфрама наиболее важны шеелит СаУ04 и вольфрамит (Ре, Мп) У04.
Хром был открыт в 1797 г. Н.-Л. Вокленом (Франция), молибден — К. Шеелс в 1780 г. (Швеция). Позднее он же открыл вольфрам (1781).
Хром — металл, близкий по внешнему виду к стали. Молибден и вольфрам — серебристо-белые металлы. По увеличению твердости они располагаются в ряд У — Сг Мо. Некоторые физические свойства приведены в табл. 27.9. Это тугоплавкие металлы, причем вольфрам — самый тугоплавкий из металлов.
Таблица 279
Физические свойства металлов группы VIВ.
Свойство. | Металл. | ||
хром. | молибден. | вольфрам. | |
Плотность, г/смЗ. | 7,19. | 10,22. | 19,3. |
| |||
* °с. *КНИ' ^. | |||
Электрическое сопротивление, Ом • м (при 273 К). | 12,7−108 | 5,2 Ю8 | 5,65−10″8 |
Хром применяется как важнейший компонент сталей различного назначения, в том числе нержавеющих. Большая часть хрома выплавляется в виде феррохрома (около 3 млн т/год). Соединения хрома применяются в различных отраслях промышленности: производство огнеупоров, пигментов, кожевенная промышленность. Производство молибдена составляет около 100 000 т/год. Большая часть его используется для легирования сталей специального назначения. Молибденовая проволока используется в электротехнике в различных целях. В лампах накаливания вольфрамовая спираль закрепляется молибденовыми вводами. Вольфрам как самый тугоплавкий металл является материалом упомянутых спиралей. Однако большая часть добываемого вольфрама используется в твердых сплавах на основе карбида вольфрама WC (85 95%) и кобальта (5—15%). Производство вольфрамовых концентратов составляет около 50 000 т/год.
Хром относят к биогенным элементам, однако природные биологически активные вещества, содержащие хром, недостаточно изучены. Биологическая роль молибдена изучена гораздо лучше. Известен ряд ферментов, содержащих молибден и регулирующих обмен азота. Одним из таких ферментов является нитрогеназа, позволяющая микроорганизмам (нитробактериям, см. параграф 157) непосредственно связывать азот воздуха, синтезируя азотсодержащие органические вещества.
Элементы группы VIA имеют шесть валентных электронов. У хрома и молибдена в основном состоянии все электроны являются распаренными (параграф 208). Хром образует большое число химических соединений в СО +2, +3 и +6. У молибдена и вольфрама кроме этих СО появляются СО +4 и +5. С некоторыми лигандами металлы образуют соединения в необычных СО, включая 0 и даже отрицательные. Получено соединение хрома с оксидом углерода (И) Сг (СО)6 — бесцветные кристаллы, плавящиеся при 149 °C, с диамагнитными свойствами, растворимые в СС14, эфире и др. Под действием азотной кислоты гексакарбонилхром превращается в Сг (Ы03)2. Диамагнетизм вещества означает, что все электроны хрома образуют пары на б/-орбиталях, и тогда остаются шесть свободных валентных орбиталей для образования связей при участии электронных пар углерода; 3d-подуровень хрома расщепляется:
Другой пример соединения хрома в СО 0 — дибензолхром Сг (СбН6)2. Такого рода соединения образуются в органических растворителях (СС14, СНС13, бензоле, простых эфирах и др.).

Для получения хрома и его соединений хромовую руду ГеСг204 сплавляют с карбонатом калия при подаче избытка кислорода:
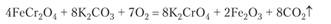
Из смеси продуктов растворимый хромат калия извлекают водой и добавлением серной кислоты его превращают в дихромат:
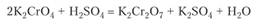
Дихромат калия сплавляют с серой, получая оксид хрома (Ш):
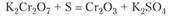
Оксид хрома (Ш) — темно-зеленый порошок, из которого металл получают восстановлением алюминием; применяется как пигмент в масляных красках.
Мри 1800 °C хром горит в кислороде, образуя Сг203. При 600—800°С он реагируете хлором, бромом, серой, переходя в СО +3. Расплавленный хром образует с углеродом карбиды различного состава.
При растворении в разбавленных серной и соляной кислотах хром переходит в СО +2:

Концентрированные кислоты, кислород и галогены при обычной температуре пассивируют поверхность хрома.
Ион Сг2+ придает раствору голубую окраску. Из раствора соли действием щелочи можно осадить гидроксид Сг (ОН)2 желтого цвета, являющийся основанием. Соединения хрома (Н) в твердом состоянии устойчивы, по в растворе медленно реагируют с водой, окисляясь до Сг3+:
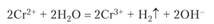
Гидроксид Сг (ОН)2 окисляется до оксигидроксида хрома (Ш) зеленого цвета:
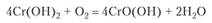
Соли хрома (Ш) в растворах устойчивы. Они всегда выделяются в виде кристаллогидратов, представляющих собой аквакомплексы хрома с координационным числом 6. Ион [Сг (Н20)(;]-н придает растворам синефиолетовую окраску. Он в значительной степени гидролизуется. При действии щелочи на раствор соли хрома (Ш) выпадает осадок гидроксида, отщепляющий часть воды:
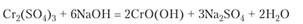
При прокаливании гидроксида хрома (Ш) и солей кислородсодержащих кислот образуется оксид хрома (Ш).
Гидроксид и оксид хрома проявляют амфотерные свойства. В присутствии избытка щелочи осадок СгО (ОН) растворяется с образованием комплексного хромита изумрудно-зеленого цвета:
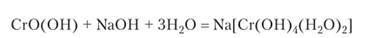
Зеленая окраска характерна и для многих других комплексных соединений хрома (Ш). Известен хлороаквакомплекс хрома [Сг (Н20)4С12]С1'2Н20 зеленого цвета. Он образуется при нагревании фиолетового раствора [Сг (Н20)6]С13. Эти два вещества имеют одинаковый состав, т. е. являются изомерами. Комплексный ион [Сг (Н20)4С12]+ медленно гидролизуется, в результате чего окраска раствора снова становится фиолетовой.
Все соединения хрома (Ш) окисляются до соединений хрома (У1). В кислой среде окисление возможно при участии таких сильных окислителей, как КМп04, а в щелочной среде могут использоваться даже довольно слабые окислители, например, йод. В шестивалентном состоянии хром образует преимущественно кислородные соединения: оксид Сг03 и соли хромовой кислоты Н2Сг04 (хроматы) и дихромовой кислоты Н2Сг207 (дихроматы). Возьмем примеры реакций окисления хрома (Ш):
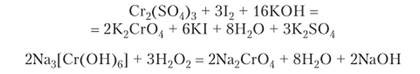
Образующиеся хроматы калия и натрия представляют собой растворимые в воде вещества желтого цвета. Нерастворимы в воде соли кальция, бария и свинца. В кислой среде желтые хроматы превращаются в дихроматы оранжевого цвета. В щелочной среде вновь образуются хроматы:

Таким образом, система хромат/дихромат подобна кислотно-основному индикатору.
При добавлении концентрированной серной кислоты к концентрированному раствору К2Сг207 постепенно образуется осадок оксида хрома (VI) в виде красных игольчатых кристаллов:
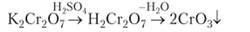
Кислоты хрома (У1) — сильные, но существуют только в растворе. В кислой среде дихроматы являются сильными окислителями. Смесь концентрированной серной кислоты с дихроматом калия, называемая хромовой смесью, применяется для мытья химической посуды, так как окисляет следы жиров и других загрязнений на стекле, после чего капли воды на стекле не зависают — наблюдается полная стекаемость.
Поскольку хроматы существуют только в щелочной среде, они оказываются слабыми окислителями, несмотря на наличие в их составе Сг. По силе окислительных свойств дихроматы близки к хлору. Поэтому реакция окисления иона СП дихроматом обратима:
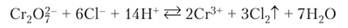
Равновесие смещается вправо по мере улетучивания газообразного хлора.
Молибден и вольфрам, подобно металлам 5-го и 6-го периодов в группах 1УВ—УВ, отличаются большей химической стойкостью и слабыми окислительными свойствами в высших степенях окисления. У них также встречаются более высокие координационные числа в комплексных соединениях.
Реагируя с кислородом при нагревании, оба металла переходят в высшие оксиды МоОэ и У03. Оксиды молибдена известны для всех СО от +2 до +6, а из оксидов вольфрама — только У02 и У04. Соединяясь с хлором, молибден образует МоС15, а вольфрам — УС16. Это также характеризует возрастание устойчивости высшей СО в группе. С фтором молибден и вольфрам образуют гексафториды, характеризующиеся низкими температурами кипения. Например, УР6 кипит при 19 °C, переходя в бесцветный газ с относительной плотностью по водороду В = 149.
При сплавлении металлов со щелочью и окислителем образуются молибдаты и вольфраматы:
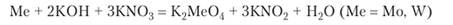
В кислой среде происходит образование солей со сложными анионами, называемых полимолибдатами (поливольфраматами). Например, обычным реактивом молибдена является гептамолибдат аммония (МН4)6Мо7024-4Н20. Для аналитических целей имеет значение образование еще более сложного нерастворимого соединения желтого цвета фосфоромолибдата аммония:
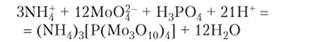
В анионах этого вещества атомы фосфора, находясь в центре, окружены четырьмя сложными группами Мо3О?0. Есть много других веществ такого типа, называемых гетерополисоединениями.
В комплексных соединениях молибдена и вольфрама встречаются как обычное координационное число 6, так и более высокое — 8. Один из самых устойчивых комплексов — октацианомолибдат (1У)-ион |Mo (CN)8]4~. Соль калия образует кристаллы K4[Mo (CN)8]-2Н20. В растворе вещество восстанавливается до K3[Mo (CN)8], так как имеет редокс-потенциал, близкий к потенциалу Fe3+/Fe2+.
Двухвалентный молибден образует немного соединений, но среди них есть вещества с очень необычной структурой, которые относят к кластерам (англ, «cluster» — кисть, пучок, скопление). Галогениды молибдеиа (Н) представляют собой гексамеры МобС112, МобВг12, Мо6112. В гексамере восемь атомов галогена ковалентно связаны с молибденом, а оставшиеся четыре могут участвовать в реакциях обмена. Например, желтый кластер Мо6С112 реагирует со щелочью, образуя растворимое в воде соединение К2[МоГ)С18(ОН)Г)]. При обмене с нитратом серебра четыре иона С1 замещаются на N03. Таким образом, соединение содержит группировку атомов [Мо6С18]4-, которая и является кластером. Атомы молибдена расположены в вершинах октаэдра (рис. 27.1), и расстояние между ними, равное 261 нм, почти совпадает с удвоенным ковалентным радиусом молибдена. Следовательно, между атомами молибдена имеется ковалентная связь. Атомы хлора расположены над гранями октаэдра, оказываясь в вершинах куба. Каждый атом Мо связан с четырьмя атомами хлора. Атомы молибдена слегка сдвинуты от центра грани внутрь куба. Внешние атомы хлора расположены на продолжении осей октаэдра.
Известно много типов кластеров различного состава и химической природы. Рассмотренные вещества были первыми изученными кластерами.