Расчеты энтропии и энергии Гиббса

Решение. Здесь протеканию процесса растворения способствует только энтропийный фактор. Разрушение кристаллической структуры при растворении означает рост неупорядоченности. Это и выражается в увеличении энтропии. Для оценки растворимости снова надо вспомнить, что стандартные значения функций относятся к системе в стандартном состоянии. В данном случае эго раствор хлорида натрия с концентрацией 1… Читать ещё >
Расчеты энтропии и энергии Гиббса (реферат, курсовая, диплом, контрольная)
Для расчета стандартного изменения энтропии химической реакции А,.5° необходимо знать энтропию отдельных веществ. Для индивидуальных веществ может быть определено абсолютное значение энтропии на основе постулата, называемого третьим началом термодинамики: энтропия идеального кристалла при абсолютном нуле температуры равна нулю. Тогда по известной теплоемкости вещества можно вычислить энтропию при данной температуре по уравнению.

Энтропия вещества последовательно возрастает при переходе от твердого к жидкому и газообразному состоянию, так как при этих фазовых переходах поглощается теплота и растет неупорядоченность. В химических реакциях энтропия возрастает особенно существенно при увеличении количества вещества газов. Поэтому знак AS можно определять «на глаз». Рассматривая реакцию.
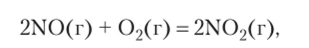
можно сказать, нс производя расчетов, что энтропия смеси в ходе реакции при постоянной температуре уменьшается, так как из 3 моль газа получается 2 моль газа.
В таблицы термодинамических свойств веществ вносятся значения стандартной энтропии, т. е. энтропии 1 моль вещества 5°, ДжДмольК), при стандартных условиях (приложение 3).
Для химической реакции стандартное изменение энтропии вычисляется по формуле, аналогичной расчету А, Н° по закону Гесса:
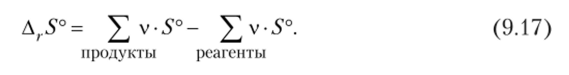
Таблицы термодинамических свойств веществ содержат также стандартные значения изменения энергии Гиббса образования сложных веществ из простых веществ, обозначаемые как AjG°. По этим данным рассчитывается стандартное изменение энергии Гиббса химической реакции ArG°:
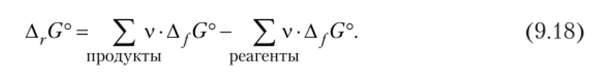
Следует обратить внимание на то, что ArG° относится к одному обороту химической реакции в системе, находящейся в стандартном состоянии. Это понятие подразумевает концентрации всех веществ в растворе 1 моль/л или давление каждого газа в смеси 101,3 кПа. Отсюда следует, что A,.G изменяется по мере протекания реакции, так как изменяются концентрации веществ. Подробнее это разъясняется в следующей главе.
Расчет АГС° производят как по табличным значениям AfG° веществ, участвующих в реакции, так и по предварительно вычисленным значениям А, Н° и Д,^, после чего применяют формулу (9.12) для изменения энергии Гиббса:
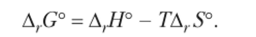
Пример 9.8. Рассчитайте двумя способами ArG° при 298,15 К для реакции оксида азота (П) с кислородом. Обсудите результат.
Решение. Напишем уравнение реакции и найдем необходимые табличные данные.
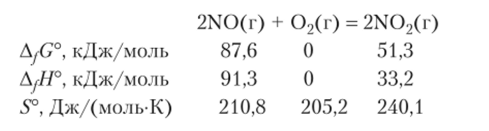
Рассчитаем изменения функций состояния для данной реакции:
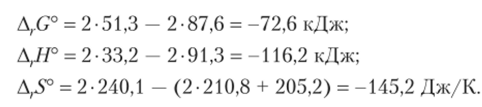
Рассчитаем изменение энергии Гиббса, но уравнению (9.12), обратив внимание на использование энергетических единиц (энтропия в Дж/К, энтальпия в кДж):
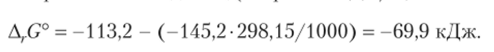
Расчет ArG° двумя способами дал практически совпадающие результаты. Поскольку расчет проведен для стандартного состояния, мы можем сказать, что в стандартном состоянии реакция идет самопроизвольно. В данной реакции изменение энтропии отрицательно, что можно обнаружить, просто рассматривая уравнение реакции (см. выше). Здесь энтропийный фактор не способствует протеканию реакции. Но изменение энтальпии тоже оказалось отрицательным (реакция экзотермическая) и способствующим протеканию реакции. В данном случае энергетический фактор контролирует направление реакции, так как абсолютное значение Д, Н° превысило слагаемое TA,.S°.
Пример 9.9. Имеется реакция 203 = 302, для которой Л,.//° = 285,8 кДж и Д,.5° = = 137,8 Дж/К. Какая из двух реакций — прямая или обратная — идет самопроизвольно?
Решение. Из приведенных значений очевидно, что как энергетический, так и энтропийный факторы способствуют протеканию прямой реакции. Для нее заведомо получается отрицательное значение Д,.С°. Обратная реакция, т. е. образование озона, самопроизвольно идти не может. Однако озон образуется при облучении кислорода ультрафиолетовыми лучами.
Пример 9.10. Растворение хлорида натрия в воде, т. е. процесс.
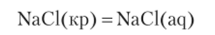
характеризуется следующими изменениями функций состояния: Д,.//° = +3,8 кДж/ моль, Д, S° = +43 ДжД. иольК), Д,.С° = -9,0 кДж/моль. Оцените роль отдельных факторов и приблизительную величину растворимости.
Решение. Здесь протеканию процесса растворения способствует только энтропийный фактор. Разрушение кристаллической структуры при растворении означает рост неупорядоченности. Это и выражается в увеличении энтропии. Для оценки растворимости снова надо вспомнить, что стандартные значения функций относятся к системе в стандартном состоянии. В данном случае эго раствор хлорида натрия с концентрацией 1 моль/л и кристаллы соли. Таким образом, растворение хлорида натрия идет самопроизвольно в одномолярном растворе, и растворимость, следовательно, превышает 1 моль/л.
В заключение главы рассмотрим понятие термодинамической устойчивости веществ. Об устойчивости или неустойчивости тех или иных веществ приходится говорить достаточно часто, и при этом не всегда ясно, о какой устойчивости идет речь. Коррозия железа означает, что этот металл неустойчив к действию воды и кислорода воздуха. Выделение газа при внесении питьевой соды в кипяток означает, что эта соль разлагается горячей водой. Эта же соль и без участия жидкой воды выделяет углекислый газ и пары воды при нагревании до 270 °C.
Под термодинамической устойчивостью подразумевается устойчивость вещества в данных условиях как такового, т. е. отсутствие у него превращений, идущих самопроизвольно (характеризующихся отрицательными значениями ArG) без участия других веществ.
Хлорид натрия ни в какое другое вещество превратиться не может. Это термодинамически устойчивое вещество. Другое хорошо известное вещество глюкоза, С6Н)206, может подвергаться различным превращениям, среди которых, например, разложение на графит и воду:
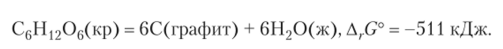
Как видим, у этого превращения отрицательное значение ArG°, и оно должно идти самопроизвольно. Следовательно, глюкоза — термодинамически неустойчивое вещество. Неизбежно возникающий вопрос, почему же глюкоза может длительное время храниться, не превращаясь в другие вещества, будет рассмотрен в гл. 11.