Коллоидные растворы.
Методические указания и контрольные задания по химии

То вещество, которое образует в дисперсной системе сплошную фазу, называют дисперсионной средой, а то, что распределено в среде — дисперсной фазой. Гомогенные дисперсные системы называют истинными растворами или просто растворами. Линейные размеры их частиц не превышают размеров отдельных ионов и молекул — до 1 нм. Гетерогенные дисперсные системы подразделяются на коллоидные системы (размеры… Читать ещё >
Коллоидные растворы. Методические указания и контрольные задания по химии (реферат, курсовая, диплом, контрольная)
Дисперсные системы — это системы, состоящие как минимум из двух веществ, одно из которых измельчено и распределено в другом.
То вещество, которое образует в дисперсной системе сплошную фазу, называют дисперсионной средой, а то, что распределено в среде — дисперсной фазой. Гомогенные дисперсные системы называют истинными растворами или просто растворами. Линейные размеры их частиц не превышают размеров отдельных ионов и молекул — до 1 нм. Гетерогенные дисперсные системы подразделяются на коллоидные системы (размеры частиц от 1 до 100 нм) и грубодисперсные или микрогетерогенные системы (размеры частиц более 100 нм).
Коллоидные системы, дисперсионная среда которых жидкость, называются коллоидными растворами или золями. Их можно рассматривать как частный случай истинных растворов. Дисперсная фаза — это растворенное вещество, а дисперсионная среда — растворитель.
Для получения коллоидных растворов используются любые реакции, в результате которых образуются труднорастворимые соединения:
FeCl3 + 3H2O = Fe (OH)3v + 3HCl (20).
AgNO3 + KI = AgIv +KNO3(21).
Ba (Cl)2 + Na2SO4 = BaSO4v+ 2NaCl (22).
Структурной единицей коллоидного раствора является мицелла — это отдельная частица дисперсной фазы с жидкой дисперсионной средой. Рассмотрим образование мицеллы на примере реакции (21). Избыток одного из компонентов действует как стабилизатор коллоидного раствора, то есть как вещество, препятствующее агрегации коллоидных частиц в более крупные и выпадению их в осадок.
Пусть в избытке будет азотнокислое серебро. Труднорастворимый AgI образует кристаллический агрегат, состоящий из m молекул AgI. Агрегат адсорбирует на поверхности ионы Ag+, находящиеся в избытке. Они придают агрегату положительный заряд и называются потенциалопределяющими ионами. Агрегат и потенциалопределяющие ионы образуют ядро (m AgI) n Ag+. С заряженной поверхностью ядра устойчиво связано некоторое число ионов противоположного знака — противоионов — (n-x)NO3-. Потенциалопределяющие ионы и связанные противоионы образуют адсорбционный слой. Агрегат вместе с адсорбционным слоем называется гранулой или коллоидной частицей. Она имеет электрический заряд, совпадающий с зарядом потенциалопределяющего иона (х+). В состав коллоидной частицы входит только часть имеющихся в растворе противоионов. Остальные противоионы xNO3- остаются в дисперсионной среде и образуют диффузионный слой. Заряды потенциалопределяющих ионов и противоионов полностью скомпенсированы. Поэтому мицелла электронейтральна.
Строение мицеллы золя иодида серебра имеет вид:
ядро.
{[mAgI]nAg+(n-x)NO3-}x+ • xNO3;
агрегат адсорбционный диффузионный.
слой слой Если в растворе избыток KI, то мицелла будет иметь вид:
{[mAgI]nI-(n-x)K+ }x- • xK+.
Строение мицеллы золя сульфата бария, полученного по реакции (22) с избытком хлорида бария: {m[BaSO4] n Ba2+ 2(n-x)Cl-}2x+ 2xCl;
Строение мицеллы золя Fe (OH)3: {m[(FeOH)3] nFe3+ 3(n-x)Cl- }3x+ 3xCl;
Устойчивость — способность коллоидных систем сохранять свое состояние и свойства неизменными с течением времени. Различают два вида устойчивости: кинетическую (седиментационную) и агрегативную. Кинетическая устойчивость характеризует способность частиц дисперсной фазы оставаться во взвешенном состоянии благодаря интенсивному броуновскому движению. Агрегативная устойчивость характеризует способность частиц дисперсной фазы противостоять их агрегации, т. е. укрупнению и слипанию. Это обусловлено наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц. Это можно сделать при добавлении электролита. Потеря агрегативной устойчивости золя приводит к укрупнению частиц дисперсной фазы, их слипанию Этот процесс называют коагуляцией. Коагуляция вызывает нарушение кинетической устойчивости, которое приводит к образованию осадка (коагулята). Этот процесс называется седиментацией.
Коагулирующим действием обладает тот ион, который заряжен противоположно частице. Коагулирующая способность электролита возрастает с увеличением заряда коагулирующего иона. Например, для золя иодида серебра коагулирущим действием будут обладать такие анионы, как Cl-, SO42-, PO43-. Из них наилучшим коагулирующим действием обладает ион PO43-. Процесс коагуляции начинается только после достижения определенной минимальной концентрации электролита, которая называется порогом коагуляции.
Примерный состав коагулята золей иодида серебра и гидроксида железа:
{[mAgI]nAg+ nNO3-}0, {m[(FeOH)3] nFe3+ 3nCl- }0.
Примеры решения задач Пример 1. Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 М раствора KI 0,028 л 0,005 М раствора AgNO3. Определите заряд частиц полученного золя и напишите формулу его мицеллы.
Д, а н о: СKI = 0,01 моль/л; СAgNO3 = 0,005 моль/л, VKI = 0,02 л; V AgNO3 = 0,028 л.
Определить заряд полученного золя. Написать формулу мицеллы золя.
Р е ш е н и е. При смешении растворов AgNO3 и KI протекает реакция: AgNO3 + KI = AgI + KNO3.
Определяем количество AgNO3 и KI, участвующих в реакции:
СVAgNO3 = 0,0050,028 = 1,410−4 моль.
CVKI = 0,020,01 = 2,010−4 моль Расчет показывает, что в растворе избыток KI, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы Iи частицы золя приобретают отрицательный заряд. Противоионами являются ионы К+. Формула мицеллы золя иодида серебра при условии избытка KI:
[m (AgI) nI- (n-x)K+]-x xK+.
Пример 2. Какой объем 0,002 М раствора BaCl2 надо добавить к 0,03 л 0,0006 М раствора Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4.
Д, а н о: СBaCl2 = 0,002 моль/л; С Al2(SO4)3 = 0,0006 моль/л, V Al2(SO4)3 = 0,03 л.
Найти VBaCl2. Написать формулу мицеллы золя.
Р е ш е н и е. Образование золя BaSO4 происходит в соответствии с уравнением реакции: 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3.
Если вещества участвуют в стехиометрическом соотношении, то справедливо соотношение: (CV)BaCl2 = (CV)Al2(SO4)3, следовательно.
VBaCl2 =.
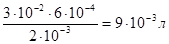
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Значит, для реакции необходимо взять более 0,009 л 0,002 М раствора BaCl2. Формула мицеллы золя сульфата бария: [m (BaSO4) nBa2+ 2(n-x)Cl- ]2x+2xCl;
Пример 3. Золь сульфида цинка был получен при взаимодействии растворов Zn (NO3)2 и Na2S. Определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к аноду. Напишите формулу мицеллы золя.
Р е ш е н и е. Образование золя ZnS происходит в соответствии с уравнением реакции: Zn (NO3)2 + Na2S = ZnS + 2NaNO3.
Анод — положительно заряженный электрод, к нему движутся отрицательно заряженные частицы. Значит противоионы мицеллы имеют отрицательный заряд, а сама мицелла заряжена положительно, что возможно при условии избытка Zn (NO3)2. На поверхности агрегата ZnS адсобируются потенциалопределяющие ионы Zn2+ (так как раствор Zn (NO3)2 в избытке), создавая таким образом положительный заряд мицеллы. Агрегат и потенциалопределяющие ионы образуют ядро, с которым связываются противоионы — NO3-.
Таким образом, в избытке был взят раствор Zn (NO3)2. Формула мицеллы золя иодида серебра при условии избытка Zn (NO3)2:
[m (ZnS) nZn2+ 2(n-x)NO3- ]2x+2xNO3;