Свойства констант равновесия

Состояние равновесия зависит от парциальных давлений (или концентраций) двух оксидов углерода: Пример 10.5. Имеется термохимическое уравнение реакции СН4(г) + С02(г) = 2СО (г) + 2Н2(г), Д, Н° = 247,4 кДж. Это объясняется тем, что в обратной реакции реагенты и продукты меняются местами. Константа равновесия равна 1 при 962 К. Рассчитайте константу равновесия при 900 К. Количество углерода… Читать ещё >
Свойства констант равновесия (реферат, курсовая, диплом, контрольная)
Отметим следующие свойства констант равновесия.
Константа равновесия обратной реакции равна обратной величине константы равновесия прямой реакции:

Это объясняется тем, что в обратной реакции реагенты и продукты меняются местами.
В химии часто встречаются последовательные обратимые реакции. Рассмотрим диссоциацию слабой трехосновной кислоты. Диссоциация идет ступенчато по отдельным стадиям, каждая из которых характеризуется своей константой:
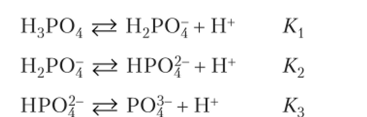
Сложением трех последовательных реакций диссоциации получим суммарную реакцию, для которой константа равновесия равна произведению констант последовательных стадий:
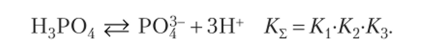
Константы равновесия зависят от температуры, причем увеличение или уменьшение константы зависит от знака стандартного изменения энтальпии реакции.
Запишем энергию Гиббса через изменение энтальпии и энтропии:
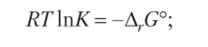
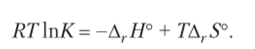
Разделим обе части уравнения на RT:
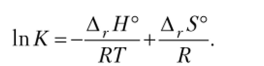
Дифференцируя это уравнение по температуре, получим.

Полученное уравнение, называемое уравнением изобары химической реакции, показывает, что 1пД и сама константа равновесия увеличиваются при повышении температуры (clT положительно), если Д, Н° > О, т. е. в случае эндотермической реакции. При этом условии знаки в правой и левой частях уравнения (10.11) совпадут. Если реакция экзотермическая (Д, Н° < 0), то при повышении температуры в левой части уравнения d K должен быть отрицательным. Э го означает уменьшение константы равновесия. Изменения констант равновесия при изменении температуры влекут за собой соответствующие сдвиги равновесия.
Для упрощения расчетов дифференциалы часто заменяют на малые изменения переменных Ах. Тогда получаем приближенное уравнение.

Для двух температур 7) и Т2 с соответствующими константами равновесия К, и К2 получим уравнение или 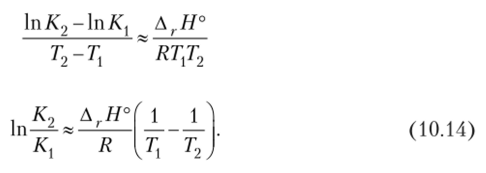
Пример 10.5. Имеется термохимическое уравнение реакции СН4(г) + С02(г) = 2СО (г) + 2Н2(г), Д, Н° = 247,4 кДж.
Константа равновесия равна 1 при 962 К. Рассчитайте константу равновесия при 900 К.
Решение. Данная реакция эндотермическая, и при понижении температуры константа равновесия должна уменьшиться, т. е. станет меньше 1. Подставляем числовые данные в уравнение (10.14), приписывая значениям при более низкой температуре индекс 1: 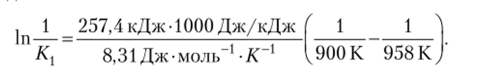
Вычисление дает: К, = 0,1119. Константа равновесия уменьшилась в соответствии с предварительной оценкой.
Химическое равновесие в гетерогенной системе. Равновесие в реакциях между твердым веществом и раствором или газом не зависит от массы твердого вещества. Это легко уяснить, представив себе насыщенный раствор поваренной соли. Независимо от того, имеется ли в осадке всего миллиграммовое количество соли или кристаллы заполняют половину объема сосуда, концентрация насыщенного раствора при данной температуре остается неизменной. В гетерогенной системе каждое вещество имеет разные концентрации в разных фазах. В твердой фазе концентрация чистого кристаллического вещества остается постоянной, и при рассмотрении химического равновесия ее удобнее всего выразить в долях. Доля чистого вещества в собственной фазе равна единице. В ходе химической реакции количество твердого вещества в системе может как увеличиваться, так и уменьшаться, но концентрация его остается равной единице. Это отражается в написании уравнения закона действующих масс — в него не входят концентрации твердых веществ. Уголь (графит) при температуре около 1000 °C реагирует с углекислым газом, образуя угарный газ:
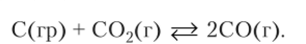
Состояние равновесия зависит от парциальных давлений (или концентраций) двух оксидов углерода:
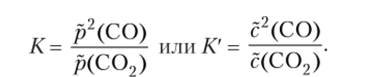
Количество углерода в системе на состояние равновесия не влияет.
Возьмем аналогичный пример для раствора. Бромид серебра AgBr, практически нерастворимый в воде, заметно растворяется в водном растворе аммиака, образуя комплексное соединение:
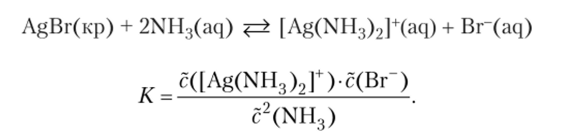
Количество бромида серебра в осадке на равновесие не влияет.