Энтропия и абсолютная температура

Если в течение промежутка времени ск система контактирует с окружающей средой, через границы системы передается теплота, происходит процесс энергообмена, в котором обменная координата энтропия dS изменяется, при этом происходит изменение внутренней энергии dU. Если теплообмен является единственным каналом, по которому происходит обмен энергией между системой и окружающей средой, то изменение… Читать ещё >
Энтропия и абсолютная температура (реферат, курсовая, диплом, контрольная)
Для того чтобы более четко сформулировать принцип необратимости, следует прояснить, какие процессы протекают при обмене системы с окружающей средой энергией в форме теплоты. Далее нам потребуется ввести новую переменную (параметр состояния) для того, чтобы сформулировать принцип необратимости в виде неравенства.
Для решения данной задачи вспомним, как закрытая система (например, газ в цилиндре иод поршнем) обменивается энергией с окружающей средой посредством совершения работы. Поршень перемещается, при этом меняются объем газа в цилиндре и объем окружающей среды. Совершение работы означает, что система взаимодействует с окружающей средой, причем в процессе этого взаимодействия изменяется параметр состояния V, объем системы. Образно говоря, работа «втекает» в систему через координату V, превращается в энергию системы. Через эту же координату энергия может «вытекать» из системы. Таким образом, координата V играет роль канала передачи энергии между системой и окружающей средой. Аналогичные рассуждения справедливы и для других видов обмена энергией между системой и окружающей средой: X, — (г = 1, 2,3,п), X, — обобщенная координата. X, обозначает переменные обмена, экстенсивные параметры состояния, поскольку экстенсивной величиной является энергия, которая поступает в систему в результате изменения этих параметров.
Из закона сохранения энергии следует, что часть работы, которая совершается над закрытой системой, диссипирует, рассеивается, однако остается при этом в системе, преобразуясь во внутреннюю энергию. Причем эту энергию нельзя «извлечь» из системы по тем же «каналам», по которым она в нее поступила.
Ранее была получена формула.
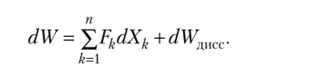
Таким образом, диссипация работы — это еще один канал обмена энергией.
Попробуем ответить на вопросы: по какому каналу поступает в систему тепловая энергия, какой параметр состояния должен изменяться в процессе теплообмена? Первое, что приходит в голову: речь идет о температуре? Но тепло может подводиться к системе и в изотермическом процессе, например, в случае изотермического расширения газа вся подводимая теплота переходит в работу. Если газ сжимать в адиабатных условиях, то температура его возрастает, хотя теплообмен отсутствует. Кроме того, температура — интенсивный параметр, а переменная обмена должна быть экстенсивной. Следовательно, температура не подходит на данную роль. Если обратиться к другим параметрам состояния, которые рассматриваются в курсах механики или электродинамики, то окажется, что с их помощью тоже нельзя описать процесс передачи тепла. Иными словами, нужна новая переменная. Эта переменная — энтропия S. Именно энтропия служит тем каналом, по которому система обменивается с окружающей средой энергией в форме теплоты. Другими словами, энтропия является той координатой, которая изменяется в процессе теплообмена.
Однако остается еще один вопрос: как быть с диссипированной работой? Представим себе такой эксперимент, пусть есть закрытая система, в которой находится мешалка. Мешалка вращается, при этом в систему подводится энергия и одновременно вся совершенная работа Wx2 полностью диссипируст, Wx2 = VE;ilIC<. и ДUx2 — Wx2. По сути дела, мешалка просто перемешивает рабочее тело (воздух, вода), не совершая никакой полезной работы.
Рассмотрим теперь второй эксперимент. К той же системе, с теми же начальными условиями, подведем энергию в форме теплоты, которая численно равна работе Wx2, Qx2 = Wx2 = AUX2. При этом параметры в состоянии 2 окажутся теми же, что и в конце первого эксперимента. Результатом обоих процессов является изменение внутренней энергии на одну и ту же величину. Отсюда следует, что диссипированную работу можно описать с помощью энтропии, т. е. притоку диссипированной работы соответствует возрастание энтропии.
Свойства энтропии рассмотрим позже, пока нам достаточно знать, что такой параметр есть.
Итак, мы выяснили, что внутренняя энергия системы, которая обменивается энергией с окружающей средой посредством теплообмена и совершения работы, является функцией энтропии и рабочих координат Xt(i =1,2,3,…, п):
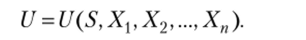
В простейшем случае, когда возможно только совершение работы сжатия и теплообмен, 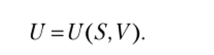
Отметим два свойства энтропии:
- 1) теплота, которую может воспринять система при одних и тех же начальных и конечных параметрах, пропорциональна массе системы, поэтому энтропия — экстенсивная величина;
- 2) системы, которые мы рассматриваем, не обладают памятью, т. е. текущее состояние системы не зависит от того пути, по которому система попала в данное состояние, таким образом, энтропия — параметр состояния.
Можно утверждать, что теплота — это энергия, которая переносится через границы системы, когда система обменивается энтропией с окружающей средой.
Если в течение промежутка времени ск система контактирует с окружающей средой, через границы системы передается теплота, происходит процесс энергообмена, в котором обменная координата энтропия dS изменяется, при этом происходит изменение внутренней энергии dU. Если теплообмен является единственным каналом, по которому происходит обмен энергией между системой и окружающей средой, то изменение энергии связано с изменением энтропии соотношением.
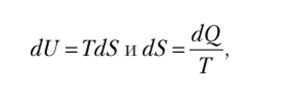
где Т —температура.
Таким образом, для описания процесса теплообмена системы с окружающей средой в термодинамике используется не количество теплоты, а энтропия, поскольку количество теплоты есть функция процесса, тогда как энтропия есть функция состояния. Поэтому внешним параметром системы в случае теплообмена является энтропия. Если рассматривать энтропию в качестве обобщенной координаты, то обобщенной силой является температура.
Поскольку энтропия является функцией состояния, а количество переданной теплоты не является таковой, функция 1 /Т — интегрирующий множитель.
Напомним, что интегрирующий множитель — это множитель, после умножения на который левая часть дифференциального уравнения.
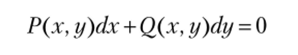
обращается в полный дифференциал некоторой функции Z (x, у). Таким образом, если ф(х, у) — интегрирующий множитель, то.
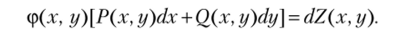
Температура также является функцией параметров состояния Т = T (S, Xv Х2,…, Хп) или Т = T (S, V) в простейшем случае. Температура — интенсивная т fwO.
величина, ее можно представить как частную производную I = — .
V dS)v
Определенная таким образом температура является термодинамической температурой. Термодинамическая температура — характеристика степени нагретости вещества, измеряется термометром.
Выясним теперь, как можно измерить термодинамическую температуру. Ранее уже говорилось об эмпирической температуре и способах ее измерения. Желательно было бы использовать для измерения термодинамической температуры те же термометры, что и для эмпирической. Проблема заключается в том, что существует несколько шкал эмпирических температур (Цельсия, Фаренгейта, Ренкина и т. д.), а термодинамическая шкала одна.
Указанная проблема решается следующим образом. Ранее мы выяснили, что значения эмпирических температур в разных шкалах взаимосвязаны, поэтому, если нам известно значение температуры в какой-либо эмпирической шкале, соответствующие этой температуре значения можно определить и в других шкалах: 0, 02, 03,…. Поэтому для практических целей достаточно установить взаимосвязь термодинамической температуры со значением 0 одной из температурных шкал:

После этого мы сможем установить связь Т со значениями 0t, 02, (c)3,… в других шкалах.
Выберем в качестве эмпирической температуру, измеряемую с помощью идеально-газового термометра 0, и установим взаимосвязь между Т и 0. Для этой цели приведем в контакт газовый термометр и термодинамическую систему, температура которой измеряется. Очевидно, что газовый термометр должен быть достаточно компактным, чтобы его масса не повлияла на результат измерения. К рабочему телу термометра (газу) подводится или отводится тепло от исследуемой системы, объем газа меняется, при этом совершается работа расширения. Будем предполагать, что процесс изменения объема протекает обратимо. За промежуток времени т внутренняя энергия газа меняется:
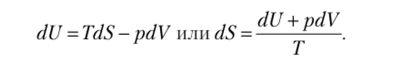
В то же время опыт Джоуля показал, что внутренняя энергия идеального газа зависит только от температуры (здесь под температурой мы подразумеваем эмпирическую температуру 0, которая измеряется идеальногазовым термометром). Поэтому для идеального газа справедливо Вспоминая, что уравнение состояния идеального газа имеет вид  представим дифференциал энтропии в форме
представим дифференциал энтропии в форме  В то же время.
В то же время.
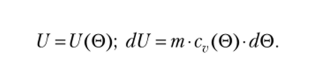

Сравнивая два уравнения, получаем  Поскольку энтропия — функция состояния,.
Поскольку энтропия — функция состояния,.
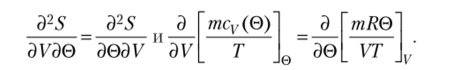
Поскольку Т = Т(0), выражение в квадратных скобках тСу зависит только от 0, поэтому I- ^.
а следовательно,.
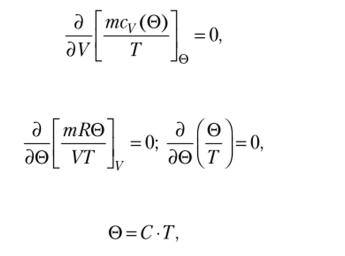
откуда где С — константа. Иными словами, температура, измеренная газовым термометром, пропорциональна термодинамической температуре. При этом значение С можно выбрать произвольно из соображений удобства.
После выбора значения С устанавливается однозначное соответствие между термодинамической температурой и той температурой, которую показывает газовый термометр. Из практических соображений удобно выбрать С = 1. В этом случае в качестве единиц измерения температуры можно сохранить кельвин.
Из соотношения dU = TdS следует, что энтропия имеет размерность энергии, отнесенную к размерности температуры, Дж/К. Удельная энтропия s = S/m.