Сильные и слабые электролиты

Степень диссоциации может быть определена также через количество вещества и концентрацию. Делая подстановку N=n • ЛГ". получаем. Слабые (включая средние) Степень диссоциации меньше 90% и изменяется обратно пропорционально 4с. К электролитам средней силы относятся те, степень диссоциации которых составляет от 10 до 90%; Галогениды некоторых металлов (Hg2+, Cd2+, Bi3+); некоторые соли миогоосновных… Читать ещё >
Сильные и слабые электролиты (реферат, курсовая, диплом, контрольная)
Электрическая проводимость растворов известна с XVIII в., но долгое время никто не предполагал, что в растворах имеются свободные электрически заряженные частицы. Теорию электролитической диссоциации веществ, выдвинутую Аррениусом в 1887 г., большинство современных ему ученых сначала категорически отвергали. Существование свободных ионов им представлялось невозможным. Это не укладывалось в научное мышление того времени. Интересно, что одним из важных аргументов, доказывающих реальность ионов в растворах, послужил не сам факт электрической проводимости, а характер зависимости проводимости от концентрации электролита. Есть два типа электролитов — сильные и слабые (табл. 13.2). У первых удельная электрическая проводимость возрастает приблизительно пропорционально концентрации раствора, а у вторых — пропорционально квадратному корню из концентрации. Так, если концентрацию слабого электролита увеличить в 4 раза, то проводимость увеличивается только в 2 раза. Это означает, что в растворах слабых электролитов при увеличении концентрации вещества происходит смещение равновесия в направлении соединения ионов в молекулы, и именно этим подтверждается реальность существования ионов.
Сильные электролиты представлены небольшим числом кислот (около 10) и щелочей (приблизительно столько же) и большим числом солей. Особенно высокую электрическую проводимость проявляют растворы сильных кислот и щелочей благодаря необычайной подвижности ионов Н+ и ОН-.
Сильные и слабые электролиты
Класс электролита. | Сильные Степень диссоциации близка к 100% (> 90%) и мало зависит от концентрации. | Слабые (включая средние) Степень диссоциации меньше 90% и изменяется обратно пропорционально 4с |
Соли. | Большинство солей. Практически все соли с однозарядными катионами. | Галогениды некоторых металлов (Hg2+, Cd2+, Bi3+); некоторые соли миогоосновных органических кислот. |
Кислоты. | HCl, HBr, HI, H2SO^, HNO3, HCIO3, НСЮ^, HMn04> CF3SO3H. | Остальные слабые. |
Основания. | Гидроксиды элементов групп IA (Li — Fr) и НА (Са — Ra). | Остальные слабые. |
Комплексные соединения. | Имеющие внешнюю сферу. | Не имеющие внешней сферы. |
Практически важной характеристикой электролита является степень диссоциации а.
Степенью диссоциации (ионизации) называется отношение числа структурных единиц вещества, распавшихся на ионы, к общему числу структурных единиц:

Степень диссоциации может быть определена также через количество вещества и концентрацию. Делая подстановку N=n • ЛГ". получаем.
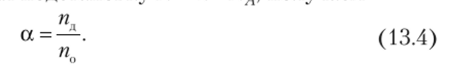
Количество вещества можно выразить через концентрацию и объем: п = с • V. Тогда получаем 
При практической работе с электролитами используют условное деление их на сильные, средней силы и слабые по степени диссоциации в растворе с концентрацией 0,1 моль/л:
- — к сильным электролитам относятся те, степень диссоциации которых превышает 90%;
- — к электролитам средней силы относятся те, степень диссоциации которых составляет от 10 до 90%;
- — к слабым электролитам относятся те, степень диссоциации которых меньше 10%.
Если классифицировать электролиты по наличию равновесия между ионами и молекулами, то электролиты средней силы следует отнести к слабым электролитам.
Большинство сильных электролитов — это соли и гидроксиды металлов, с ионными кристаллическими структурами. Отсюда понятно, что они и в растворах находятся в виде ионов. Кислоты в индивидуальном состоянии состоят из молекул, и большинство из них оказываются слабыми электролитами. Много электролитов имеется среди комплексных соединений.