Сила окислителей и восстановителей

Сравнивая значения AG° и АЯ°, можно заключить, что при проведении этой реакции в гальваническом элементе выделится менее 5 кДж теплоты, а остальная энергия может быть реализована в виде работы. Может возникнуть сомнение, можно ли сравнивать энергетические характеристики обычной химической реакции и процесса в гальваническом элементе? Для устранения такого сомнения достаточно напомнить, что… Читать ещё >
Сила окислителей и восстановителей (реферат, курсовая, диплом, контрольная)
Исследование окислительно-восстановительных реакций тесно связано с измерениями электрических потенциалов, так как передача электронов приводит к разделению положительных и отрицательных зарядов. Такого рода явление уже известно нам на примерах существования молекул, имеющих положительный и отрицательный полюса (полярные молекулы).
На границах раздела фаз всегда имеется некоторый скачок потенциала вследствие перехода электронов между фазами. Статическое электричество, создающее иногда немалые неудобства в жизни, обусловлено возникновением поверхностных зарядов. Сталкиваясь со статическим электричеством, люди обычно плохо представляют себе, между какими поверхностями возник соответствующий скачок потенциала. Рассмотрим два конкретных случая возникновения поверхностных потенциалов.
При соприкосновении поверхностей двух разных металлов, например меди и цинка (рис. 15.1), возникает скачок потенциала, называемый контактным потенциалом. Цинк более активный металл, чем медь, и легче отдает электроны. Некоторое число электронов переходит с цинка на медь. Распределяясь вследствие отталкивания по поверхности меди, они создают разность потенциалов между двумя металлами. Если контактирующие между собой медь и цинк опустить в кислоту, то электроны переходили бы к ионам водорода с поверхности меди и на меди возникали бы пузырьки водорода, но растворялся бы в кислоте цинк. На этом явлении основана электрохимическая защита от коррозии.
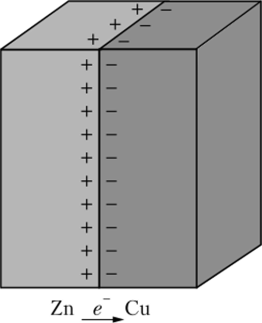
Рис. 15.1. Возникновение контактного потенциала на границе медь — цинк
В качестве другого примера возникновения скачка потенциала рассмотрим поверхность соприкосновения между металлом и раствором электролита. Согласно научной терминологии здесь соприкасаются проводник первого рода — металл (электронный проводник) и проводник второго рода — электролит (ионный проводник).
Система, состоящая из проводников первого и второго рода, называется электродом. Электрод, состоящий из металла и раствора его соли, называется ионно-металлическим.
Электрод обозначается составляющими его веществами или частицами, например: Zn I Zn2+, Си I Си2+.
В качестве металлов мы по-прежнему можем взять медь или цинк, а в качестве электролитов — растворы сульфата меди и сульфата цинка соответственно. С поверхности металла некоторое число ионов Ме2+ (в нашем примере это Си2+ и Zn2+) может перейти в раствор, так как очевидно, что концентрация ионов металла в твердом металле больше, чем в растворе. На металле остается некоторый избыток электронов, и возникает скачок потенциала, называемый электродным потенциалом. Избыток электронов препятствует дальнейшему переходу ионов металла в электролит, и на поверхности раздела фаз устанавливается равновесие. Условием равновесия является равенство работы самопроизвольного химического процесса перехода ионов в раствор и несамопроизвольного процесса разделения электрических зарядов: 
Работа (-АG) химического процесса по переносу 1 моль ионов равна разности химических потенциалов Me2* в двух имеющихся фазах, а электрическая работа равна z/чр, где 2 — заряд иона, F = 96 485 Кл-моль-1 — постоянная Фарадея или заряд 1 моль элементарных зарядов. Сделаем подстановку в уравнение (15.1):
откуда 
Известно, что значение AG зависит от концентрации, причем в данном случае только от концентрации ионов металла в электролите, так как сам металл в твердой фазе имеет постоянную концентрацию:
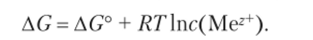
Делаем подстановку в уравнение (15.2):
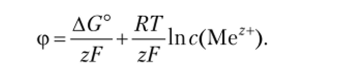
Второе слагаемое в полученном уравнении равно нулю при концентрации ионов 1 моль/л. В этом случае электродный потенциал принимает значение стандартного потенциала (р°. Уравнение принимает окончательную форму 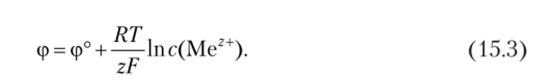
Это уравнение, связывающее значение электродного потенциала с температурой и концентрацией, называется уравнением Нернста. Стандартный потенциал (р° для разных металлов имеет разные значения, которые можно найти в таблицах электродных потенциалов. У цинка, отдающего ионы в раствор легче, чем медь, стандартный потенциал ниже, чем у меди. Из различия потенциалов разных электродов вытекает важное следствие, заключающееся в возможности создания химических источников тока — элементов или батареек.
Рассмотрим поведение системы, составленной определенным образом из медного и цинкового электродов (рис. 15.2). В стаканы с растворами сульфатов меди и цинка опущены медная и цинковая пластинки. Растворы соединяются трубкой, заполненной любым электролитом, например раствором КС1. На поверхностях раздела металлов и электролитов устанавливаются соответствующие потенциалы, и вся система, называемая гальваническим элементом, находится в равновесии. Замкнем через металлическую проволоку медную и цинковую пластинки. Электроны от цинка, имеющего более низкий потенциал и большую концентрацию электронов на поверхности, потекут по проводу к меди с более высоким потенциалом. Иначе говоря, возникнет электрический ток. В эту цепь можно поставить вольтметр. Тогда при условии концентраций электролитов 1 моль/л прибор покажет стандартное значение электродвижущей силы (ЭДС) 1,109 В (при 25°С). Электродвижущая сила, очевидно, представляет собой разность между потенциалами двух электродов гальванического элемента:
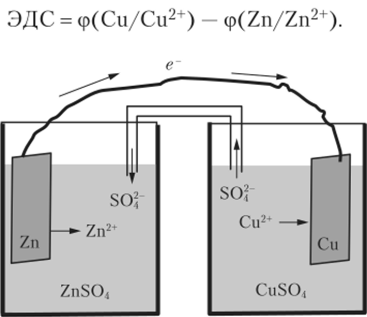
Рис. 15.2. Схема гальванического элемента.
Для получения положительного значения ЭДС вычитают из более высокого потенциала более низкий.
Отток электронов от цинка влечет за собой нарушение равновесия на его поверхности. Ионы начинают переходить в раствор: 
Реакция, идущая на поверхности металла в гальваническом элементе, называется электродной реакцией. Электрод, на котором идет окисление, называется анодом.
Электроны, перетекающие от цинка к меди, нарушают равновесие на поверхности меди. Ионы Си2+ из раствора соединяются с электронами и оседают на поверхности меди в виде металла:

Электрод, на котором идет восетановление, называется катодом.
Сложение двух реакций, идущих на электродах, дает уравнение реакции, идущей в гальваническом элементе:
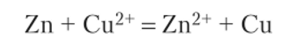
Такая реакция могла бы идти непосредственно между цинком и раствором соли меди. При этом выделялась бы теплота, так как АГН° = -217 кДж. При проведении реакции в гальваническом элементе электрическая энергия может быть использована на производство работы. У нас есть формулы и числовые данные для расчета этой работы в стандартном состоянии. По уравнению (15.2).
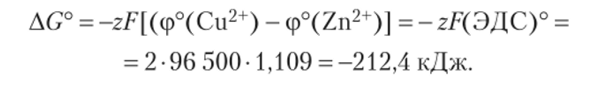
Сравнивая значения AG° и АЯ°, можно заключить, что при проведении этой реакции в гальваническом элементе выделится менее 5 кДж теплоты, а остальная энергия может быть реализована в виде работы. Может возникнуть сомнение, можно ли сравнивать энергетические характеристики обычной химической реакции и процесса в гальваническом элементе? Для устранения такого сомнения достаточно напомнить, что энергетика реакции определяется начальным и конечным состояниями системы и не зависит от пути перехода. В нашем примере независимо от пути превращения начальное состояние — это цинк и раствор соли меди, а конечное состояние — медь и раствор соли цинка.
Измерения ЭДС гальванических элементов являются одним из важнейших методов определения энергии Гиббса химических реакций. Это второе важное применение гальванических элементов, если первым считать практическое использование электроэнергии, даваемой батарейками.
Перейдем к вопросу об определении электродных потенциалов. Непосредственными измерениями можно определить только электродвижущую силу элемента. Поэтому для определения потенциалов отдельных электродов требуется выбрать какой-то удобный для измерений электрод и условно принять его потенциал за ноль. По целому ряду причин в качестве такого электрода был выбран водородный электрод (рис. 15.3). В стеклянный сосуд помещается сильная кислота и погружается пластинка из инертного металла платины, покрытая платиновой чернью, т. е. мельчайшим порошком платины. В сосуд непрерывно пропускается газообразный водород, насыщающий поверхность платины. Электродное равновесие устанавливается между водородом на поверхности металла и ионами водорода в растворе:
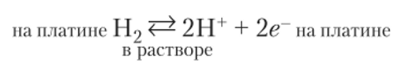 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">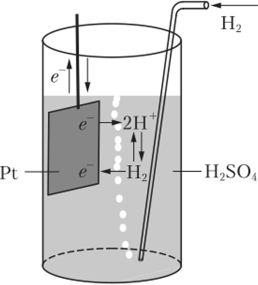
Рис. 15.3. Схема водородного электрода
За ноль принимается потенциал водородного электрода при я (ЬГ) = = 1 моль/л, температуре 298,15 К и давлении газообразного водорода 101,3 кПа.
Составляя гальванические элементы из изучаемого электрода и водородного электрода, измеряют ЭДС, которая, согласно условию (р°(Н+) = 0, равна потенциалу изучаемого электрода. При этом учитывается, какой электрод оказался анодом и какой катодом. Определенные таким образом потенциалы электродов (редокс-потенциалы) представляют в таблицах. Некоторые редокс-потенциалы приведены в табл. 15.1.
Таблица 15.1
Редокс-потенциалы в порядке уменьшения силы окислителей и усиления восстановителей
Окислитель. | Сопряженный восстановитель. | Среда. | <�р°, в (25 °С). |
f2 | F. | К. | +2,866. |
о3 | о2 + п2о. | к. | +2,076. |
Н202 | н2о. | к. | + 1,776. |
Мп04". | Мп2+ | к. | + 1,507. |
нею. | СП. | к. | + 1,482. |
рьо2 | РЬ2+ | к. | + 1,455. |
ску. | се. | к. | + 1,451. |
Вг03" . | вг. | к. | + 1,423. |
С12 | сг. | к. | + 1,35 827. |
Сг, 072; | Сг3+ | к. | + 1,232. |
Мп02 | Мп2+ | к. | + 1,224. |
02 | п2о. | к. | + 1,229. |
Вг2 | Вг. | к. | + 1,0873. |
Ю;Г. | Г. | к. | + 1,085. |
hno2 | NO. | к. | +0,983. |
N03; | NO. | к. | +0,957. |
Окислитель. | Сопряженный восстановитель. | Среда. | (р°, В (25 °С). |
Hg2+ | Hg. | К. | +0,851. |
Ag+ | Ag. | к. | +0,7996. |
Fe3+ | Fe2+ | к. | +0,771. |
02 | H202 | к. | +0,695. |
H3As04 | HAs02 | к. | +0,560. |
ь. | I. | к. | +0,5355. |
Cu2+ | Cu. | к. | +0,3419. |
s. | H2S. | к. | +0,142. |
so42; | so2 | к. | +0,172. |
Sn4+ | Sn2+ | к. | +0,151. |
H+ | H2 | к. | |
Pb2+ | Pb. | к. | — 0,1262. |
Sn2+ | Sn. | к. | — 0,1375. |
Fe2+ | Fe. | к. | — 0,447. |
Zn2+ | Zn. | к. | — 0,7618. |
Al3+ | Al. | к. | — 1,662. |
Na+ | Na. | к. | — 2,71. |
Ca2+ | Ca. | к. | — 2,868. |
Li+ | Li. | к. | — 3,0401. |
H202 | он; | Щ. | +0,878. |
CIO. | ci; | Щ. | +0,81. |
BrO. | Br. | Щ. | +0,761. |
СЮ3; | CL. | Щ. | +0,62. |
Mn04; | Mn02 | HI. | +0,595. |
Mn04; | Mn042- | Щ. | +0,558. |
IO. | г. | Щ. | +0,485. |
02 | он; | Щ. | +0,401. |
O3. | o2 + он; | Щ. | + 1,24. |
N03; | no2; | Щ. | +0,01. |
Cu (OH)2 | Cu20. | Щ. | — 0,08. |
Cr ()42; | [Cr (OH)4|; | Щ. | — 0,13. |
no2; | NO. | Щ. | — 0,46. |
S. | s2-o32; | Щ. | — 0,47 627. |
Fc (0H)3 | Fc (OH)2 | Щ. | — 0,56. |
S032; | S2032; | Щ. | — 0,571. |
H20. | H2 | Щ. | — 0,8277. |
so42; | so32; | 1Ц | — 0,93. |
|Zn (OII)4]2 | Zn. | Щ. | — 1,199. |
Для подробно рассмотренных выше электродов цинка и меди находим в таблице: (p°(Zn/Zn2+) = -0,764 В, (p°(Cu/Cu2+) = 0,345 В. Знак «-» у потенцииала цинкового электрода означает, что в сочетании с водородным электродом он является анодом. Вычислим ЭДС медно-цинкового элемента:
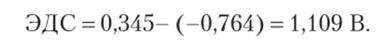
Это же значение ЭДС получается при непосредственном измерении на гальваническом элементе.
Кроме ионно-металлических существуют окислительно-восстановительные электроды. Их отличительная особенность состоит в том, что металл непосредственно в окислительно-восстановительной реакции не участвует. Его роль состоит только в посредничестве в обмене электронами между частицами в электролите. Окислительно-восстановительный электрод состоит из инертного металла (Pt) и раствора, содержащего окисленную и восстановленную форму вещества. Рассмотрим электрод, состоящий из платиновой пластинки, находящейся в растворе сульфата железа (П) и сульфата железа (Ш) (рис. 15.4). На поверхности металла ионы Fe2+ отдают электроны на металл, а ионы Ее3+ принимают электроны с металла:
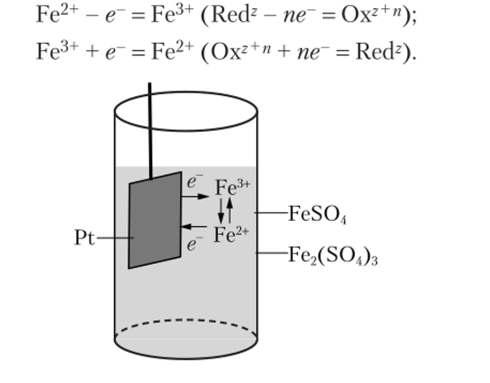
Рис. 15.4. Схема окислительно-восстановительного (редокс) электрода на примере системы Fe3+/Fe2+
Между металлом и раствором устанавливается скачок потенциала, зависящий от концентраций ионов:
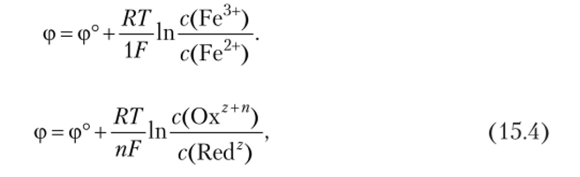
В общем виде где п — число электронов в электродной реакции. В этом уравнении можно вычислить коэффициент для температуры 298,15 К и перейти к десятичному логарифму. Тогда уравнение принимает следующий вид:
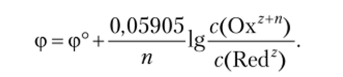
Электродный процесс обмена электронами может сопровождаться протолитическими реакциями — передачей протонов и идти с участием ионов и молекул среды. Редокс-потенциал будет зависеть от концентраций всех частиц, участвующих в электродной реакции. По такому тину восстанавливается перманганат-ион:
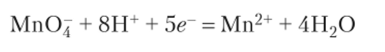
В этом случае зависимость потенциала от концентраций имеет следующий вид: 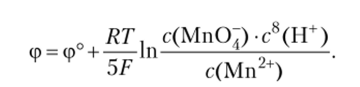
Концентрация воды в уравнение не входит, так как растворитель присутствует в огромном избытке и его концентрация может считаться постоянной.
Редокс-потенциалы в табл. 15.1 характеризуют не только свойства электродов, но одновременно и силу окислителей и восстановителей. По мере понижения потенциала уменьшается сила окислителей и возрастает сила сопряженных с ним восстановителей. К числу сильных окислителей можно отнести те, значение электродного потенциала которых выше 0,7 В. Сильными восстановителями можно считать те, для которых потенциал ниже 0,5 В в кислой среде.