Комплексные соединения.
Общая химия

Кроме обычных солей, оксидов и гидроксидов очень многочисленной разновидностью соединений металлов являются комплексные соединения, называемые также координационными соединениями. Нередко употребляется и сокращенное название «комплексы». Они не являются отдельным классом соединений в традиционном ряду оксиды — кислоты — основания — соли, так как среди комплексных соединений есть свои кислоты… Читать ещё >
Комплексные соединения. Общая химия (реферат, курсовая, диплом, контрольная)
Изучив содержание главы 16, студенты должны: знать
- • понятие о комплексных соединениях;
- • основные положения координационной теории строения комплексных соединений;
- • важнейшие разновидности комплексных соединений;
- • типичные реакции комплексных соединений;
- • характеристику устойчивости комплексных соединений в растворах; уметь
- • указывать составные части комплексного соединения в формуле;
- • называть комплексное соединение по международной номенклатуре;
- • рассчитывать концентрации продуктов диссоциации с использованием констант нестойкости;
владеть
• навыками прогнозирования протекания реакций комплсксообразования.
Понятие о комплексных соединениях
Кроме обычных солей, оксидов и гидроксидов очень многочисленной разновидностью соединений металлов являются комплексные соединения, называемые также координационными соединениями. Нередко употребляется и сокращенное название «комплексы». Они не являются отдельным классом соединений в традиционном ряду оксиды — кислоты — основания — соли, так как среди комплексных соединений есть свои кислоты, основания и соли. Главным признаком, объединяющим комплексные соединения в отдельное множество, является наличие в них центрального атома, образующего химические связи с окружающими атомами, которых может быть от двух до девяти. Число этих атомов превышает степень окисления, или, как иногда говорят, классическую валентность центрального атома. Отсюда вытекает и второй характерный признак: комплексное соединение и мысленно, и реально можно разделить на две, а иногда и более, составные части, способные существовать как устойчивые сложные вещества. Само слово «комплекс» переводится с латинского как «связь, сочетание».
Основы современных представлений о строении комплексных соединений были заложены швейцарским химиком Альфредом Вернером в 1893 г. в его координационной теории и изложены в книге «Новые воззрения в области неорганической химии», 5-е издание которой было переведено на русский язык (1936).
Рассмотрим желтую кровяную соль, полученную А. С. Маркграфом около 1750 г. Это одно из первых известных науке комплексных соединениий. По систематической номенклатуре вещество называется гексацианоферрат (Н) калия. Его формула в современном написании K4[Fe (CN)6], а до создания координационной теории его представляли как двойную соль 4KCNFe (CN)2. В этом соединении у железа степень окисления +2, т. е. оно двухвалентно. Один из способов получения этого комплексного соединения заключается в действии раствора цианида калия на нерастворимый в воде цианид железа:

Получается раствор светло-желтого цвета, из которого кристаллизуется комплексное соединение с кристаллизационной водой — K4[Fe (CN)6| -ЗН20. Вещество не проявляет обычных свойств ни цианида железа, ни цианида калия. В отличие от последнего, оно не ядовито. Присутствие иона Fe2+ в растворе не обнаруживается: при добавлении щелочи осадок гидроксида железа (П) не выпадает. С сульфатом меди происходит обменная реакция, и образуется коричневый осадок:
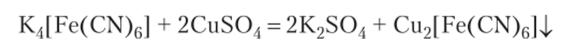
Эти и другие свойства желтой кровяной соли доказывают, что в ее составе имеется очень устойчивый ион [Fe (CN)6]4_, называемый комплексным ионом, и ионы К+. В ионе [Fe (CN)6]4_ атом железа связан с шестью группами CN, имея степень окисления +2, и поэтому вещество относится к комплексным соединениям.
Прежде чем дать определение понятия «комплексные соединения», следует обратить внимание на то, что координационное число атома (с. 126) может превышать валентность не только в комплексных соединениях. Например, в кристаллах хлорида железа (Ш) FeCl3 каждый атом железа связан с шестью атомами хлора, а последние, в свою очередь, являются мостиками между атомами железа. В результате трехвалентное железо в этом веществе имеет координационное число 6. Однако в формуле FeCl3 число атомов хлора совпадает с валентностью железа. Такую формулу невозможно мысленно разбить на две формулы сложных веществ. С учетом этого можно дать следующее определение.
Комплексные соединения — это вещества, в формулах которых число атомов, образовавших связи с центральным атомом, превышает его валентность.
Составные части комплексного соединения имеют особые названия. Часть формулы, заключенная в квадратные скобки, составляет внутреннюю сферу комплексного соединения, или комплексную частицу. В устойчивых комплексных соединениях комплексная частица переходит в раствор как единое целое. Часть формулы за квадратными скобками называется внешней сферой комплексного соединения. Это катионы или анионы, компенсирующие электрический заряд внутренней сферы. В рассмотренном примере во внешней сфере могли бы быть и другие катионы: Na4[Fe (CN)6|,.
Ca2[Fe (CN)6] и т. д. Очевидно, что между внешней и внутренней сферами комплекса имеется связь ионного типа.
Внутренняя сфера комплекса может иметь не только отрицательный заряд, но и положительный, если с металлом связаны незаряженные частицы. Простейшим примером являются аммиачные комплексы: [Co (NH3)6]Cl3 и |Cu (NH3)4]SO/1. Если с металлом связаны одновременно анионы и молекулы, то комплексная частица может оказаться незаряженной. В этом случае комплекс не имеет внешней сферы и представляет собой молекулу: [Co (NH3)3(N02)3], [Pt (NH3)2Cl2|. При определении заряда комплексной частицы применяется следующее правило: заряд равен алгебраической сумме степени окисления центрального атома и зарядов частицу связанных с ним. Если заряд внутренней сферы известен, то по этому правилу можно вычислить степень окисления центрального атома.
Сердцевиной внутренней сферы комплексного соединения является центральный атом. В большинстве комплексов это атом металла в положительной степени окисления. В отдельных случаях возможна и степень окисления 0, и даже отрицательная степень окисления. В относительно небольшом числе комплексных соединений центральным атомом может быть неметалл: В, Si, Р и другие неметаллы групп III—V.
Ионы (как правило, анионы) и молекулы, непосредственно связанные с центральным атомом во внутренней сфере комплекса, называются лигандами. В составе лиганда должны быть атомы, имеющие валентные электронные пары, с помощью которых образуются донорно-акцепторные связи с центральным атомом. Таких ионов и молекул очень много. Легче было бы перечислить молекулы, не способные выступать в роли лигандов. Как пример можно назвать предельные углеводороды. В их молекулах нет свободных валентных электронных пар. Но карбоаиионы, например СН3_, могут входить в состав комплексов в качестве лигандов.
Атом лиганда, образующий донорно-акцепторную связь с центральным атомом, называется донорным атомом.
Для некоторых остатков кислородсодержащих кислот, таких как N03, SOI' СЮ4, образование связей с металлом во внутренней сфере комплекса не характерно. Они обычно играют роль ионов внешней сферы. Большинство анионов, среди которых анионы галогенов, гидроксид-ион, фосфатионы РО;|~, НРО4-, Н2Р04, нитрит-ион N02, могут находиться, в зависимости от природы других лигандов, как во внешней, так и во внутренней сфере комплекса.
Неорганические вещества сравнительно редко имеют молекулярное строение. Поэтому и в роли лигандов выступают не очень многочисленные неорганические молекулы: вода, аммиак, гидроксиламин NH2OH, оксид углерода (И). Донорными атомами в этих молекулах являются кислород, азот, углерод. Несопоставимо более многочисленны в качестве лигандов органические молекулы. Сюда относятся амины NH2R, NHR2, NR3 (R — углеводородные радикалы) и другие азотсодержащие молекулы; вещества разных классов, содержащие кислород и серу, фосфор. При наличии в составе комплексного соединения органических молекул и ионов сами комплексы становятся веществами, занимающими промежуточное положение между неорганическими и органическими соединениями. Соответственно координационная химия, как иногда пишут, находится на стыке неорганической и органической химии.
Комплексные соединения с органическими лигандами оказываются таким же неисчерпаемым источником материалов разного назначения, как и сами органические соединения. Одним из наиболее рано возникших применений комплексных соединений оказался химический анализ металлов, сплавов, руд благодаря разнообразию окраски, растворимости и других свойств этих соединений. Комплексные соединения применяются в технологии разделения и очистки металлов. Наличие органических лигандов сближает комплексные соединения с природными биологическими веществами. Необходимые для жизнедеятельности микроэлементы находятся в клетках в виде комплексов с белками. Поэтому целесообразно искать новые лекарственные средства среди комплексных соединений. Их применение в этой области является уже достаточно широким, и в перспективе число таких веществ будет возрастать.
Металлы разных блоков таблицы Менделеева проявляют различную способность к образованию комплексных соединений. Наиболее сильными комплексообразователями являются ионы металлов Яблока. Большое число их комплексов было получено уже в XIX в. Длительное время координационная химия была составной частью химии d-элементов. Было известно также сравнительно небольшое число комплексов металлов p-блока. В более поздний период, с середины XX в., развернулось и изучение комплексов /-элементов. Тогда же были открыты органические вещества, названные комплексонами, способные прочно связывать в комплексы двухзарядные ионы 5-элементов Вс2+-Ва2+. Приблизительно на 20 лет позднее начала быстро развиваться химия комплексных соединений с макроциклическими лигандами. Эти лиганды дают прочные комплексы с ионами щелочных металлов, которые вообще не образуют комплексы с обычными лигандами. Отметим, что ионы щелочных металлов часто встречаются в составе комплексных соединений, но они находятся во внешней сфере, не являясь комплексообразователями. Применение макроциклических лигандов изменило представление о ионах щелочных металлов как не способных к комплексообразованию.
В итоге оказывается, что комплексообразователями могут быть ионы всех металлов.