Теплоемкость, энтальпия и энтропия.
Второй закон термодинамики

Эту формулировку следует понимать так: для того чтобы работала периодически действующая машина, необходимо чтобы были минимум два источника теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемого из высокотемпературного источника, в то время как другая часть теплоты должна быть передана низкотемпературному источнику. Высокотемпературный источник… Читать ещё >
Теплоемкость, энтальпия и энтропия. Второй закон термодинамики (реферат, курсовая, диплом, контрольная)
Теплоемкость и ее виды. Удельной теплоемкостью с называют количество теплоты д, которое требуется для изменения температуры единицы количества вещества на один градус: с = д/ъТ, с = dg/dT.
В зависимости от способа измерения единицы количества вещества, характера термодинамического процесса и величины интервала температур различают несколько видов теплоемкостей.
1. В зависимости от единицы количества вещества (1 кг, 1 м3, 1 моль) теплоемкость бывает массовой с [Дж/(кгК)], объемной с' [Дж/(м3— К)] и молярной сй [ДжДмольК)].
Связь между ними выражается следующей зависимостью:
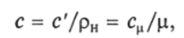
где рн — плотность при нормальных физических условиях.
Количество теплоты соответственно определяется по формуле.
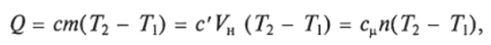
где m — масса газа, кг; Ун — объем газа, приведенный к нормальным физическим условиям; п — число молей газа.
2. Теплоемкость зависит от характера процесса и свойств газа. В зависимости от способа подвода теплоты различают теплоемкость при постоянном давлении (изобарную) ср и теплоемкость при постоянном объеме (изохорную) cv. Понятия «теплоемкость при постоянной температуре» и «адиабатная теплоемкость» редко применяются, так как при Т = const с = d^/O = оо, а при dg = 0 с = О/d/ = 0.
Еще в 1842 г. один из основоположников закона сохранения и превращения энергии Р. Ю. Майер установил, что.
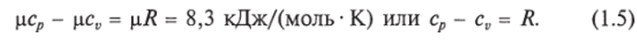
Физический смысл этой зависимости легко уяснить. Если для нагревания 1 моля (или 1 кг) газа в цилиндре над поршнем на один градус при постоянном объеме, т. е. при закрепленном неподвижно поршне, надо затратить количество теплоты сю то при постоянном давлении к этому количеству теплоты добавится работа ц/? (или Я), которую будет совершать расширяющийся газ, толкая освобожденный поршень.
Отношение к = cp/cv называют показателем адиабаты. Отметим, что зная к и используя уравнения (1.5), можно определить 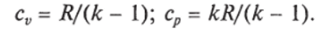
3. Поскольку теплоемкость изменяется с температурой, в зависимости от интервала температур различают истинную © и среднюю (ст) удельные теплоемкости. Истинной называют теплоемкость, соответствующую бесконечно малому интервалу температур: с = dq/dT, а средней — теплоемкость, соответствующую конечному интервалу изменения температуры: ст = q/(T2 — Г)).
Зависимость теплоемкости от температуры может быть выражена числовым рядом, основное значение в котором имеют два первых члена:
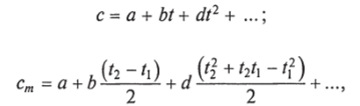
где a, b, d — постоянные, зависящие от природы газа.
Экспериментально установлено, что величина теплоемкости реальных газов зависит и от давления, влияние которого при высоких температурах, свойственных продуктам сгорания в тепловых двигателях (1000… 2000 °С), незначительно. При расчетах же паровых машин, турбин, преобразователей теплоты пренебрегать влиянием давления на теплоемкость нельзя.
При практических расчетах обычно пользуются табличными данными средних теплоемкостей в интервале температур от 0 до I. В этом случае количество теплоты, потребное на нагрев 1 кг рабочего тела от 0 до /, или до /2, будет.
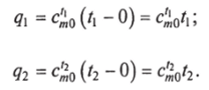
Здесь с^0 и с?0 — табличные значения теплоемкостей в интервалах температур (0…/]) и (0…/2).
Количество теплоты, потребное для нагрева 1 кг тела от tx до /2, определяется как разность:
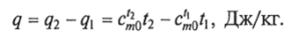
Энтальпия. В ряде случаев оказывается целесообразным объединение параметров и и pv в общий калорический параметр, называемый энтальпией:
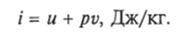
Энтальпия — термодинамическая функция, имеющая смысл полной (внутренней и внешней) энергии системы. Она складывается из внутренней энергии и и упругостной энергии pv, обусловленной наличием внешнего давления окружающей среды р, т. е. pv есть работа, которую надо затратить, чтобы ввести рабочее тело объемом v в среду, имеющую давление р.
Для идеального газа справедливы соотношения:
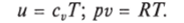
При р = const можно получить:
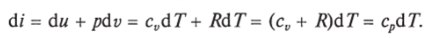
Продифференцировав i — и + pv и подставив в дифференциальное уравнение первого закона термодинамики для потока рабочего тела, можно получить.
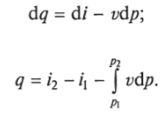
Энтальпия измеряется в тех же единицах, что и теплота, работа и внутренняя энергия (Дж/кг). Поскольку энтальпия, так же как и внутренняя энергия, является функцией состояния, то ее абсолютная величина может быть определена только с точностью до некоторой постоянной, условно выбранной для начала отсчета.
По международному соглашению за начало отсчета энтальпии для воды и водяного пара принята так называемая тройная точка (Т = 273,16 К и р = 0,0006 Па), в которой возможно одновременное существование трех фаз: льда, жидкости и пара. За начало отсчета энтальпии для газов может быть принята температура Т- 0 К.
Второй закон термодинамики. Второй закон термодинамики, как и первый, является опытным законом, основывающимся на многовековых наблюдениях ученых, однако установлен он был только в середине XIX в.
Наблюдения за явлениями природы показывают, что возникновение и развитие самопроизвольно протекающих в ней естественных процессов, работа которых может быть использована для нужд человека, возможно лишь при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой. Эти процессы всегда характеризуются односторонним их протеканием от более высокого потенциала к более низкому (от более высокой температуры к более низкой или от более высокого давления к более низкому). При протекании указанных процессов термодинамическая система стремится к тому, чтобы прийти в равновесие с окружающей средой, характеризуемое равенством давления и температуры системы и окружающей среды.
Из наблюдений за явлениями природы также следует, что для того чтобы заставить процесс протекать в направлении, обратном направлению протекания самопроизвольного процесса, необходимо затратить заимствованную из внешней среды энергию.
Второй закон термодинамики представляет собой обобщение изложенных положений и заключается в следующем.
- 1. Самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой.
- 2. Самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении от более высокого потенциала к более низкому.
- 3. Ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются.
- 4. Процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Формулировки второго закона термодинамики, данные различными учеными, вылились в форму постулатов, полученных в результате развития положений, высказанных французским ученым Сади Карно.
В частности, постулат немецкого ученого Р. Клаузиуса состоит в том, что теплота не может переходить от холодного тела к теплому без компенсации. Сущность постулата английского ученого В. Томсона заключается в том, что невозможно осуществить цикл теплового двигателя без переноса некоторого количества теплоты от источника теплоты с более высокой температурой к источнику с более низкой температурой.
Эту формулировку следует понимать так: для того чтобы работала периодически действующая машина, необходимо чтобы были минимум два источника теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемого из высокотемпературного источника, в то время как другая часть теплоты должна быть передана низкотемпературному источнику. Высокотемпературный источник иногда называют теплоотдатчиком или верхним источником теплоты, а низкотемпературный — теплоприемником, нижним источником теплоты или холодильником.
Энтропия. В термодинамике пользуются еще одним параметром состояния рабочего тела — энтропией, устанавливающей связь между количеством теплоты и температурой (Р. Клаузиус, 1850). Поясним этот параметр на основе следующих соображений.
Уравнение первого закона термодинамики можно записать в виде.
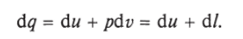
В этом уравнении dq не является полным дифференциалом, поскольку в правую часть уравнения входит член d/, не являющийся полным дифференциалом, так как работа является не параметром состояния газа, а функцией процесса. Вследствие этого уравнение нельзя проинтегрировать в интервале двух произвольно выбранных состояний газа.
Из математики известно, что всякий двучлен можно представить в виде полного дифференциала, если его умножить на так называемый интегрирующий множитель.
При умножении на интегрирующий множитель 1 /Т (где Т — абсолютная температура), приведенное уравнение примет вид.

Уравнение (1.6) можно представить в несколько ином виде, а именно:
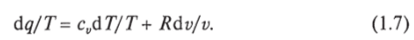
Выражение (1.7) говорит о том, что dq/T представляет собой полный дифференциал некоторой функции s (т. е. dq/T = ds), являющейся параметром состояния газа, поскольку она зависит только от двух параметров состояния газа и поэтому не зависит от того, каким путем газ из одного состояния перешел в другое. Этот параметр состояния газа в общем случае называют энтропией газа и обозначают буквой S (Дж/К). Энтропию, отнесенную к 1 кг газа, называют удельной энтропией газа и обозначают буквой s [Дж/(кгК)).
Приведенное ранее уравнение dq = di — vdp также является неполным дифференциальным уравнением, поскольку dq не является полным дифференциалом. Однако и это уравнение при умножении его на интегрирующий множитель 1/7' может быть приведено к виду полного дифференциального уравнения.
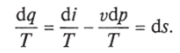
Следовательно,.
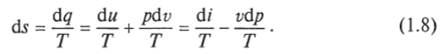
Учитывая, что для идеального газа pv = RT и, следовательно, 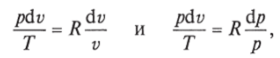
а также.
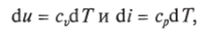
уравнение (1.8) для идеального газа может быть преобразовано следующим образом:
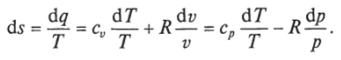
После интегрирования оно примет вид.
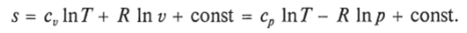
Изменение энтропии в интервале между двумя состояниями газа (7 и 2) выражается уравнением.
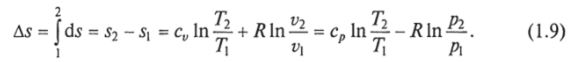
Из уравнения (1.9) следует, что количество теплоты, участвовавшее в том или ином термодинамическом процессе при изменении рабочего тела от состояния 7 до состояния 2, можно выразить следующим образом:

Этот интеграл можно вычислить, если известна функциональная зависимость между Tns. Пользуясь этой зависимостью, строят кривые в системе координат s— Т, отображающие те или иные термодинамические процессы.
На основании выражения (1.10) можно заключить, что для процесса 1—2 (рис. 1.5) площадь 7— 2—s2—sb лежащая под кривой, отображающей этот процесс, выражает количество теплоты, участвующее в этом процессе.
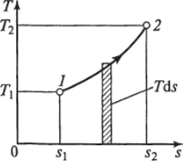
Рис. 1.5. Графическое изображение подвода теплоты в 7',.s-диаграмме.
Для определения численных значений энтропии пользуются началом отсчета при Т = 0 К, для которого i0 = 0.
Физический смысл энтропии. Энтропию нельзя измерить, ее смысл затруднительно продемонстрировать с помощью наглядных пособий, но можно понять по следующим интерпретациям.
1. Энтропия — мера ценности теплоты, его работоспособности и технологической эффективности. Можно сказать, что для изолированной системы (нагреватель — рабочее тело) As = 0, при получении от нагревателя количества теплоты qu 3| = (ф/Г,) и чем меньше sit т. е. чем выше Ти тем больше совершаемая системой работа.
Повседневный опыт свидетельствует, что чем выше температура теплоносителя при том же количестве теплоты q, т. е. чем меньше энтропия s = (q/T), тем теплота ценнее, поскольку она может быть использована не только для совершения работы, но и для технологических нужд — выплавки металла, отопления и т. д.
- 2. Энтропия — мера потери работы вследствие необратимости реальных процессов. Чем больше необратимость процесса в изолированной системе, тем больше возрастает энтропия s2 « 5, и тем большая доля энергии не превращается в работу, рассеиваясь в окружающую среду.
- 3. Энтропия — мера беспорядка. Если установить некоторую меру неупорядоченности макросистемы — неупорядоченности расположения и движения частиц D, то можно записать s = к InZ).
Следовательно, возрастание беспорядка означает возрастание энтропии, рассеивание энергии. При подводе теплоты увеличивается хаотичность теплового движения частиц, и энтропия возрастает. В противном случае охлаждение системы при постоянном объеме есть извлечение из нее теплоты, а следовательно, и энтропии. Упорядоченность системы при этом повышается, а энтропия уменьшается. При конденсации газа в жидкость молекулы занимают более определенные положения, упорядоченность их расположения скачкообразно увеличивается, что соответствует скачкообразному уменьшению энтропии. При дальнейшем понижении температуры тепловое движение становится все менее интенсивным, беспорядок — все меньшим, а значит, и все меньшей становится энтропия. Когда жидкость превратится в твердое вещество, молекулы (ионы) образуют правильные кристаллические решетки, т. е. неупорядоченность опять уменьшится, а с нею уменьшится и энтропия и т. д. Такая закономерность позволяет предположить, что при абсолютной температуре, равной нулю, тепловое движение полностью прекратится и в системе установится максимальный порядок, т. е. неупорядоченность и энтропия станут равными нулю. Это предположение согласуется с опытом, но не поддается опытной проверке (так как абсолютная температура, равная нулю, недостижима) и носит название третьего закона термодинамики.
Следовательно.
Обратимые и необратимые термодинамические процессы. Для исследования термодинамических процессов вводят понятия о равновесных (обратимых) процессах.
Состояние рабочего тела, при котором давление и температура, а следовательно, и удельный объем во всех его точках не изменяются без внешнего энергетического воздействия во времени, называется равновесным состоянием.
Последовательное изменение состояния рабочего тела, происходящего в результате энергетического взаимодействия рабочего тела с окружающей средой, называется термодинамическим процессом. Процесс, при осуществлении которого тело последовательно проходит непрерывный ряд состояний равновесия, называется равновесным.
Обратимым процессом называется такой термодинамический процесс, который допускает возможность протекания его через одни и те же равновесные состояния как в прямом, так и в обратном направлениях, а в окружающей среде не остается никаких изменений.
Если указанное условие не выполняется, то процесс оказывается необратимым. Примером необратимого процесса является передача теплоты в паровом котле от газов с температурой 600… 1000 °C к пару, имеющему температуру 400…500°С, так как обратная передача теплоты от пара к газам без изменения их температур невозможна.
В чистом виде в природе и технике обратимые процессы не наблюдаются. Однако их изучение имеет большую роль, так как многие реальные процессы близки к обратимым.