Реальные газы и водяной пар

Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно дает результаты, недостаточно точные для современной паротехники. В настоящее время наиболее точным является уравнение состояния реальных газов, разработанное М. П. Вукаловичем и Н. И. Новиковым (МЭИ) применительно, в основном, к водяному пару. Вывод этого уравнения основан на предположении наличия в реальных газах ассоциаций… Читать ещё >
Реальные газы и водяной пар (реферат, курсовая, диплом, контрольная)
Реальные газы. К реальным газам в технической термодинамике принято относить перегретые пары некоторых жидкостей. В отличие от воображаемого идеального газа реальный газ, при соответствующих условиях, может быть сжижен, т. е. сконденсирован или переведен в твердое состояние.
В технике широко применяют пары различных веществ: воды, аммиака, хлористого метила, сернистого ангидрида и др. Наиболее широкое применение получил водяной пар, являющийся основным рабочим телом паровых двигателей, отопительных и других устройств.
Известно, что законы, применимые к идеальным газам, нельзя распространять на рабочие реальные газы. В связи с этим на водяной пар, используемый в теплоэнергетике, при определенных значениях давления и температуры не распространяется уравнение состояния Клапейрона. Из ряда предлагавшихся уравнений состояния, применимых для него с известной степенью приближенности, можно отметить уравнение Ван-дер-Ваальса, составленное для реальных газов:
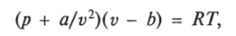
где а и b — постоянные для данного газа.
Слагаемое a/v1 в первом множителе учитывает влияние сил взаимодействия молекул, а величина Ь во втором множителе учитывает влияние объема молекул (поскольку в идеальном газе, для которого справедливо уравнение состояния Клапейрона, объем молекул полагается равным нулю).
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно дает результаты, недостаточно точные для современной паротехники. В настоящее время наиболее точным является уравнение состояния реальных газов, разработанное М. П. Вукаловичем и Н. И. Новиковым (МЭИ) применительно, в основном, к водяному пару. Вывод этого уравнения основан на предположении наличия в реальных газах ассоциаций молекул, механически объединенных в двойные, тройные и более сложные комплексы, образующиеся в результате взаимодействия между ними. Для этого уравнения характерно наиболее близкое совпадение результатов расчетов с опытными данными. Однако для практических целей оно также непригодно из-за сложности и необходимости выполнения трудоемких вычислений. На практике обычно пользуются готовыми данными, которые берут из таблиц водяного пара или из /,^-диаграммы водяного пара.
Промежуточное состояние вещества между состоянием реального газа и жидкостью принято называть парообразным или просто паром. Превращение жидкости в пар представляет собой фазовый переход из одного агрегатного состояния в другое. При фазовом переходе наблюдается скачкообразное изменение физических свойств вещества.
Примерами фазовых переходов являются процесс кипения жидкости с появлением влажного насыщенного пара и с последующим переходом его в лишенный влаги сухой насыщенный пар или обратный кипению процесс конденсации насыщенного пара. Во всех этих фазовых переходах существует однозначная связь между давлением и температурой (в данном примере — связь давления с температурой кипения или конденсации).
Одно из основных свойств сухого насыщенного пара заключается в том, что дальнейший подвод теплоты к нему приводит к возрастанию температуры пара, т. е. к переходу его в состояние перегретого пара, а отвод теплоты — к переходу в состояние влажного насыщенного пара. В современной теплоэнергетике основным рабочим телом является водяной пар. Поэтому термодинамические свойства паров рассмотрим на примере водяного пара.
Водяной пар. Характер процессов кипения и парообразования в координатах Т, s с выделением областей I…IVфазового состояния воды показан на рис. 1.10:
область / — газообразное состояние перегретого пара, обладающего свойствами реального газа;
область II — равновесное состояние воды и насыщенного водяного пара (двухфазное состояние). Двухфазную область //также называют областью парообразования;
область ///, ограниченная изотермой ЕК — жидкое состояние (вода).
Области ///, //и //, / отделены так называемыми пограничными линиями: левой ЛК и правой KD. Общая для левой и правой.
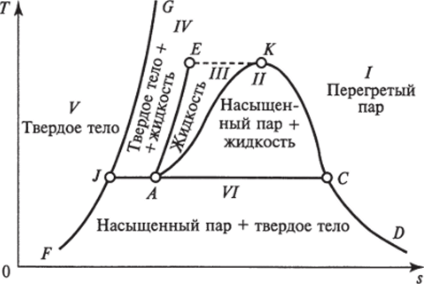
Рис. 1.10. Фазовая диаграмма водяного пара в Г, 5-координатах пограничных линий (областей I, II и III) точка К обладает особыми свойствами и называется критической точкой. Эта точка имеет определенные параметры ркр, укр и Ткр, при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее ее жидкая фаза) не может существовать при температурах выше Ткр. Будучи нагретой до этой температуры, весь объем воды практически мгновенно должен превратиться в пар. Вместе с тем пар при давлениях больших, чем ркр, и при охлаждении до температуры Гкр непосредственно превращается в жидкость, минуя область влажного пара. Критическая точка воды имеет следующие параметры: ркр = 22,136 МПа; Ткр = 374,15 °С; fKp = 0,326 м3/кг.
Значения р, Т, vw s для обеих пограничных линий (кипения и сухого насыщенного пара) приводятся в специальных таблицах термодинамических свойств водяного пара.
На современных крупных тепловых электростанциях основным двигателем является паровая турбина, где в качестве рабочего тела используется водяной пар, который получают в паровых котлах. Процесс парообразования в котлах обычно происходит при постоянном давлении, т. е. р = const.
На рис. 1.11 и 1.12 изображены процессы нагрева воды до кипения, парообразования и перегрева водяного пара соответственно в р, у- и Г, s-диаграммах.
Рассмотрим процесс получения водяного пара из воды. Начальное состояние жидкой воды, находящейся под давление р0 и имеющей температуру 0 °C, изображается на p, v- и 7, s-диаграммах точкой а. При подводе к воде теплоты при р = const температура ее увеличивается, а удельный объем растет. В некоторый момент времени температура воды достигает температуры кипения и состояние ее при этом изображается точкой b. С дальнейшим подводом теплоты начинается процесс парообразования с сильным увеличением объема. При этом образуется двухфазная среда — смесь воды.
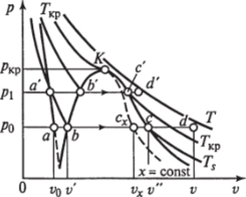
Рис. 1.11. p.f-диаграмма для воды и водяного пара.
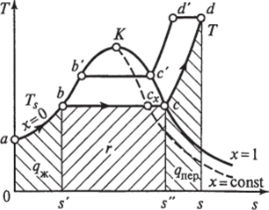
Рис. 1.12. Г, s-диаграмма для воды и водяного пара и пара, называемая влажным насыщенным паром. Температура смеси остается постоянной, так как вся теплота расходуется на испарение жидкой фазы. Процесс парообразования на этой стадии является изобарно-изотермическим и изображается участком Ьс. Наконец, в некоторый момент времени вся вода превращается в пар, называемый сухим насыщенным. Его состояние изображается точкой с.
При дальнейшем подводе теплоты температура пара увеличивается и происходит процесс перегрева пара с— d. Точка d соответствует состоянию перегретого пара и в зависимости от его температуры может находиться на разных расстояниях от точки с.
Для обозначения величин, относящихся к различным состояниям воды и пара, устанавливается следующая индексация: индекс 0 означает, что величина относится к начальному состоянию воды;
индекс ' — к воде, нагретой до температуры кипения; индекс «— к сухому насыщенному пару; индекс л: — к влажному насыщенному пару; без индекса — к перегретому пару.
Рассматривая процесс парообразования при более высоком давлении рх > /?0, можно отметить, что точка а соответствующая состоянию жидкой воды при температуре О °С и новом давлении, остается практически на той же вертикали, так как удельный объем воды почти не зависит от давления. Точка Ь соответствующая состоянию воды при температуре кипения, смещается вправо (на p, v-диаграмме) и поднимается вверх (на Г, s-диаграмме), так как с увеличением давления увеличивается температура кипения и, следовательно, удельный объем воды. Точка с соответствующая состоянию сухого насыщенного пара, смещается влево, так как с увеличением давления удельный объем пара уменьшается, несмотря на увеличение температуры.
Соединение множества точек b и с при различных давлениях дает нижнюю и верхнюю пограничные кривые аК и Кс. Из /?, v- диаграммы видно, что по мере увеличения давления разность удельных объемов V" и v'уменьшается и при некотором давлении становится равной нулю. В этой точке, называемой критической, сходятся пограничные кривые аК и Кс. Состояние, соответствующее точке К, называется критическим. Оно характеризуется тем, что при нем пар и вода имеют одинаковые удельные объемы и не отличаются по свойствам. Область b—K—с (в /?, ^-диаграмме) соответствует влажному насыщенному пару.
Состояние перегретого пара изображается точками, лежащими над верхней пограничной кривой Кс.
Следует отметить, что на Г, s-диаграмме площадь 0—a—b—s' изображает количество теплоты, потребное для нагрева воды до температуры кипения. Количество подведенной теплоты, равное теплоте парообразования г, выражается площадью s’bcs" и следующим соотношением:
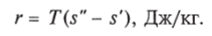
Количество подведенной теплоты в процессе перегрева водяного пара изображается площадью s" cds.
На Г, з-диаграмме видно, что по мере увеличения давления теплота парообразования уменьшается и в критической точке становится равной нулю.
Обычно Т, s-диаграмма применяется при теоретических исследованиях, так как ее практическое использование сильно затрудняется тем, что количество теплоты в ней выражается площадями криволинейных фигур.
i, s-диаграмма водяного пара. Рассмотренная Т, s-диаграмма дает возможность наглядно представить характер протекания процесса превращения воды в пар различных состояний (влажный, сухой насыщенный и перегретый). Однако при пользовании этой диаграммой установить количество теплоты сложно, так как это связано с необходимостью определения по диаграмме соответствующих площадей, в основном ограниченных кривыми линиями. Поэтому для практических расчетов обычно пользуются /, s-диаграммой водяного пара, по которой это выполнить можно значительно проще. /, 5-диаграмма (рис. 1.13) представляет собой график в системе координат /, 5, на который нанесены: изобары, изохоры, изотермы, пограничные кривые и линии постоянной степени сухости пара.
Диаграмма строится следующим образом. Откладывая на осях координат значения /'и 5'для различных состояний воды при температуре кипения и сухого насыщенного пара, получают нижнюю (х = 0) и верхнюю (х = 1) пограничные кривые с критической точкой К, разделяющей их.
Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного пара в область перегретого пара происходит без перелома на верхней пограничной кривой.
В /, 5-диаграмме водяного пара наносятся также линии постоянного паросодержания (х = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением р и температурой /. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы.
Состояние влажного насыщенного пара определяется в технике давлением р и паросодержанием х. Точка, изображающая это состояние, находится на пересечении изобары и линии х = const.
Рис. 1.13. /, 5-диаграмма для воды и водяного пара (а) и ее практически используемая область для водяного пара (б)
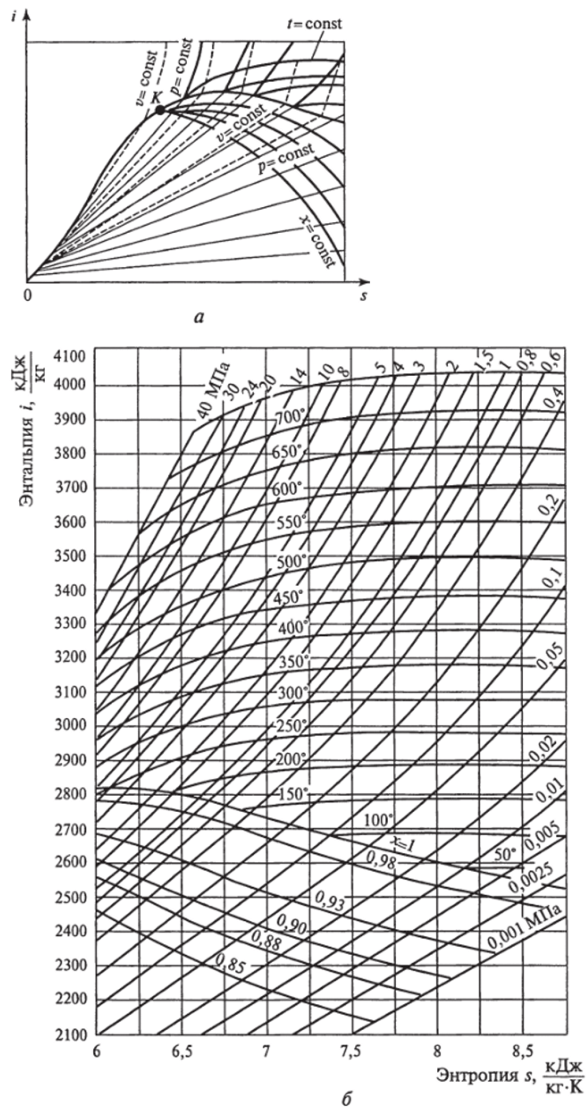
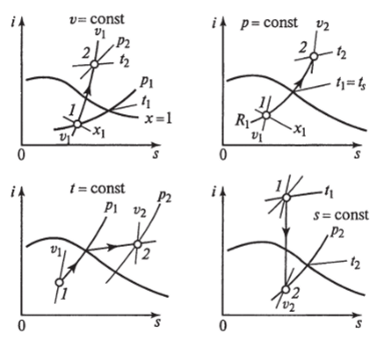
Рис. 1.14. Основные термодинамические процессы для водяного пара в s-диаграмме На рис. 1.14 представлены основные термодинамические процессы для водяного пара в /, s-диаграмме.
/, 5-диаграмма получила широкое распространение в технике. Достоинством /, 5-диаграммы является то, что техническая работа и количество теплоты изображаются на ней отрезками, а не площадями.