Протекторная защита.
Коррозия и защита металлов

Для защиты стальных конструкций в качестве протекторов применяют сплавы на основе металлов: Al, Mg, Zn. Магниевые сплавы благодаря своему высокому отрицательному потенциалу и невысокой поляризуемости находят применение в средах с низкой электропроводностью. Протекторы на основе алюминиевых сплавов применяют для защиты сооружений, эксплуатирующихся в проточной морской воде, а также для защиты… Читать ещё >
Протекторная защита. Коррозия и защита металлов (реферат, курсовая, диплом, контрольная)
Протекторная защита является разновидностью катодной защиты. Для ее реализации защищаемый металл приводят в контакт с протектором, в качестве которого выступает металл или сплав, имеющий в данной коррозионной среде потенциал меньший, чем у защищаемого. Вследствие создания таким образом короткозамкнутого гальванического элемента возникает защитный ток, катодно поляризующий защищаемый металл.
Суть протекторной защиты можно объяснить с помощью поляризационной диаграммы (рис. 8.1), характеризующей поведение двух контактирующих металлов.
Как следует из рис. 8.1, при контакте защищаемого металла с протектором потенциал защищаемого металла смещается от стационарного (Е) в область отрицательных значений, а потенциал протектора облагораживается. При этом значения потенциалов защищаемого металла и протектора, а также ток в контактной паре (/) зависят от сопротивления среды. Если коррозионная среда имеет высокую электропроводность, то потенциалы контактирующих металлов равны между собой (?ащ| Мс = Д щ|). В случае если омическое падение напряжения в среде (ДЕ) отлично от нуля, то потенциалы протектора (? ащ2) и металла (Еш ми|2) будут отличаться:

В контактной паре протектор/защищаемый металл на протекторе протекает анодная реакция ионизации металла, а на защищаемом.
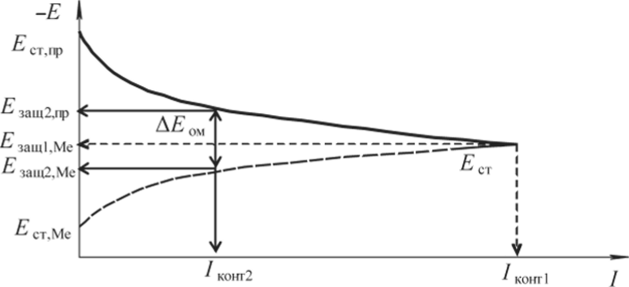
Рис. 8.1. Поляризационная диаграмма для контактной пары протектор/.
защищаемый металл:
?ст пр и Ест Ме — стационарные потенциалы металла-протектора и защищаемого металла; ?адщ| Мс — потенциал металла и протектора в контакте в среде с высокой электропроводностью; Е^щ2 Мс и Еулш2п — потенциал металла и протектора в контакте в среде с высоким омическим сопротивлением; АЕом — омическое падение напряжения в коррозионной среде металле — реакции восстановления деполяризатора Рассмотрим работу контактной пары протектор/защищаемый металл на конкретном примере магний/сталь:
— кислая среда.
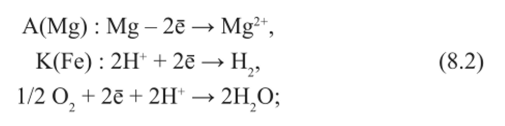
— нейтральная среда.
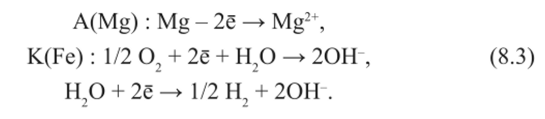
Коррозионная диаграмма пары магний/сталь приведена па рис. 8.2.
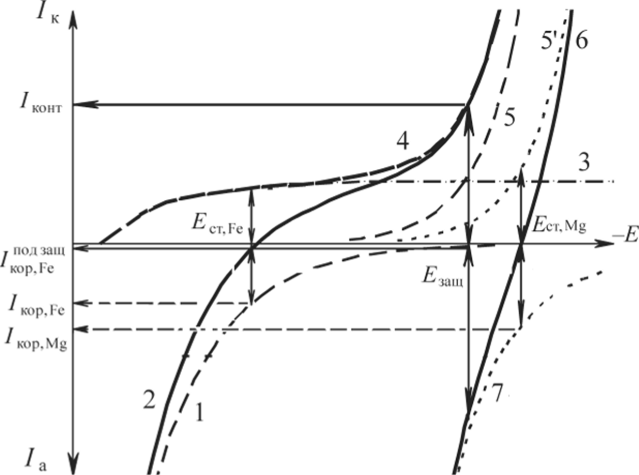
Рис. 8.2. Коррозионная диаграмма протекторной защиты стали магнием:
1 — парциальная кривая ионизации железа; 2 — суммарная катодно-анодная кривая коррозии железа; 3 — парциальная кривая восстановления кислорода; 4 — суммарная катодная кривая на железе; 5 и 5' — парциальные кривые восстановления ионов водорода на железе и магнии соответственно; 6 — суммарная катодноанодная кривая коррозии магния; 7 — парциальная кривая ионизации магния Растворение металла протекает, как правило, по механизму замедленной ионизации (кривые 1 и 7 на рис. 8.2), образование водорода в любой среде контролируется замедленным разрядом (кривые 5 и 5' на рис. 8.2), а скорость восстановления растворенного в коррозионной среде кислорода определяется транспортными ограничениями, т. е. диффузионной доставкой растворенного молекулярного кислорода к поверхности металла (кривая 3 на рис. 8.2). В средах, близких к нейтральным, процесс коррозии стали обычно протекает с кислородной деполяризацией при установлении стационарного потенциала Ест Рс со скоростью /кор Рс, равной предельному диффузионному току восстановления кислорода, а магния — с водородной деполяризацией при потенциале Е у Mg. При замыкании контакта между магнием и сталью образуется короткозамкнутый гальванический элемент, в котором в качестве положительного электрода выступает сталь, а отрицательным является магний. При этом потенциал стали смещается от величины стационарного потенциала железа Ecr Fc в сторону более отрицательных значений вплоть до Е . При таком потенциале, согласно анодной поляризационной кривой железа, скорость его растворения (/" «р fT) практически равна нулю. На этом и основан принцип протекторной защиты.
Для того чтобы в контактной паре возникал ток, катодно поляризующий защищаемый металл, применяемые для изготовления протекторов металлы должны иметь отрицательный стационарный потенциал по отношению к потенциалу защищаемого металла, низкую пассивируемость в рабочей среде и низкую поляризуемость.
Для защиты стальных конструкций в качестве протекторов применяют сплавы на основе металлов: Al, Mg, Zn. Магниевые сплавы благодаря своему высокому отрицательному потенциалу и невысокой поляризуемости находят применение в средах с низкой электропроводностью. Протекторы на основе алюминиевых сплавов применяют для защиты сооружений, эксплуатирующихся в проточной морской воде, а также для защиты портовых сооружений и конструкций, располагающихся в прибрежном шельфе. Цинковые протекторы, имеющие потенциал, близкий к потенциалу алюминиевых сплавов, но меньшую токоотдачу, чем магниевые и алюминиевые, рекомендуются в случаях, когда необходимо обеспечить взрывопожаробезопасность, исключить выделение и накопление водорода.
Протектор работает эффективно, если переходное сопротивление между ним и окружающей средой невелико. Поэтому катодная защита с помощью протекторов рекомендуется для предотвращения коррозии в средах с электропроводностью более 2 См/м (металлоконструкции судов малого и среднего тоннажа, различные конструкции портовых сооружений, внутренние поверхности танков, резервуаров с электропроводными средами).
Протекторную защиту применяют также в тех случаях, когда получение электрической энергии извне для организации катодной защиты связано с трудностями, а сооружение специальных электролиний экономически невыгодно, например труднодоступные участки подземных трубопроводов. В этом случае для исключения колебаний электросопротивления грунта под влиянием сезонных изменений погоды и для уменьшения сопротивления растеканию тока протекторы помещают в специальную засыпку (активаторы).
Практическая часть
Цель работы — оценить эффективность протекторной защиты стали магнием в 3% растворе NaCI и определить степень контроля катодного, анодного процессов и омической составляющей.
Методика эксперимента
1. Для проверки эффективности протекторной защиты провести коррозионные испытания стального образца с протекторной защитой и без нее. Для проведения коррозионных испытаний подготовить два стальных образца: измерить их геометрические размеры, зачистить и обезжирить поверхность, промыть проточной водопроводной водой, тщательно просушить и взвесить с точностью до ±0,0002 г.
Один из образцов (образец 1) поместить в стакан с 3% (масс) раствором хлорида натрия, второй (образец 2) — в ячейку, показанную на рис. 8.3.
Перед тем как замкнуть контакт между рабочим электродом и протектором, измерить потенциалы стального образца t) и магниевого протектора (Есг). Далее замкнуть контакт и снова измерить потенциалы защищаемого электрода (Е Fc) и протектора (? ш). Миллиамперметром зафиксировать ток в цепи (/). Оставить электроды на 2 ч в коррозионной среде. Периодически измерять потенциалы защищаемого электрода и протектора и контактный ток.
По окончании коррозионных испытаний разомкнуть магниевый протектор и стальной образец. Стальные образцы (образцы 1 и 2) вынуть из раствора, промыть их водопроводной водой, просушить фильтровальной бумагой, удалить продукты коррозии с помощью школьной резинки и взвесить.

По убыли массы рассчитать скорость коррозии (г/(м2-ч)) образцов:
где т] и т2 — масса стального образца исходная и после выдержки в соляном растворе; S — площадь образца; t — время выдержки в растворе.
Сравнить полученные результаты расчета, отметить различие, рассчитать эффективность протекторной защиты:
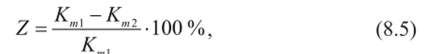
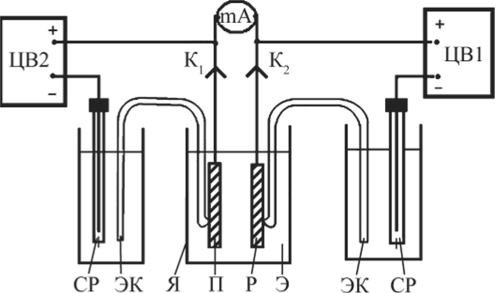
Рис. 8.3. Схема лабораторной установки протекторной защиты:
ЦВ1 и ЦВ2 — цифровые вольтметры; К, и К, — разъемные контакты (зажимы «крокодил»); тА — миллиамперметр; СР и ЭК — хлорсеребряный электрод сравнения и электролитический ключ; Я — электролитическая ячейка; П — протектор (магниевый стержень); Р — рабочий электрод (стальной образец);
Э — 3% (масс) раствор NaCl.
где Кт[ и Кт2 — отрицательные показатели изменения массы испытуемых образцов 1 и 2 в отсутствие защиты и при протекторной защите соответственно.
2. Для определения контролирующей стадии при протекторной защите стали магнием построить поляризационную диаграмму контактной пары (как на рис. 8.1) по данным измерения потенциалов и контактного тока в ходе коррозионных испытаний.
Вычисление степени контроля (СК) разных стадий (катодная, анодная, омическая) позволяет оценить эффективность протекторной защиты с точки зрения определения доли созданной ЭДС между сталью и магниевым протектором, которая используется для сдвига потенциала защищаемого металла в отрицательную область, т. е. для замедления коррозии. Расчет степени контроля в процентах осуществляют следующим образом:
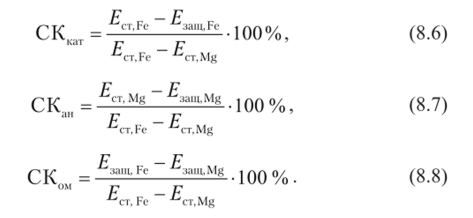
Оформление отчета.
Описать суть протекторной защиты металлических конструкций и требования к материалу-протектору.
Сформулировать цель исследования.
Привести схему экспериментальной установки протекторной защиты.
Основные результаты экспериментов привести в виде графика зависимости Е—/(рис. 8.1) и таблиц (табл. 8.1 и 8.2) с пояснением расчетов.
Таблица 8.1
Результаты оценки эффективности протекторной защиты
Образец. | Площадь образца (5), см2 | Масса образца, г. | Скорость коррозии (KJ, г/(м2 • ч). | Степень защиты (Z), %. | |
исходная. (ю,). | конечная. (т2) | ||||
Образец 1 (без протекторной защиты) Образец 2 (с протекторной защитой). | —. | ||||
Параметры протекторной защиты
Таблица 8.2
Без протекторной защиты.
Стационарный потенциал стального образца (?.iFc), В. | Стационарный потенциал магниевого протектора (?.t Mg), В. |
С протекторной защитой.
Время. (0,. мин. | Потенциал Fe под защитой (Е «В. v защ. Рс'7 | Потенциал Mg при защите. (?, Щ. М8)'В | Контактный ток в парс Fe’Mg мА. | Степень контроля (СК), %. | ||
анодного. (СК"). | катодного (СК). v кат'. | омического. (СКJ. | ||||
Сделать вывод об эффективности протекторной защиты с точки зрения снижения коррозионных потерь и расхода на защиту создаваемой ЭДС в контактной паре, о стабильности работы протектора.
Вопросы к коллоквиуму.
- 1. Сущность катодной защиты, способы реализации катодной защиты.
- 2. Принцип протекторной защиты (пояснить с помощью коррозионной диаграммы).
- 3. Достоинства и недостатки, области применения протекторной защиты.
- 4. Требования к материалам, применяемым в качестве протекторов.
- 5. Порядок выполнения работы и обработка результатов.